全氟化合物污染現狀及風險評估的研究進展
張美,樓巧婷,邵倩文,毛碩乾,李璠,林忠洲,*
1. 寧波海洋研究院,寧波 315832 2. 寧波大學海洋學院,寧波 315823
自20世紀50年代以來,全氟化合物(polyfluorinated compounds, PFCs)因具有優良的熱穩定性、高表面活性以及疏水疏油性能,被大量應用于化工電鍍、涂料、紡織、皮革、合成洗滌劑、炊具制造和消防設施等諸多領域。近年來,隨著對PFCs研究的深入,發現PFCs除具有優良的化學性質以外,還具有難降解、遠距離遷移和生物蓄積等特性,且表現出多種毒性效應。PFCs污染已遍及全球各類生態系統,甚至在極地各類環境介質和動物組織中也可檢出PFCs。當PFCs在動物和人體內的蓄積達到一定濃度閾值,會產生相應的毒性效應,包括臟器毒性、神經毒性、免疫和內分泌毒性、生殖毒性和致癌性。然而,因發展的需求,部分PFCs的生產和使用量仍與日俱增。因此,各類環境介質中PFCs的污染現狀、降解方法以及對生物的健康風險值得關注和更深入的研究。
1 全氟化合物(Polyfluorinated compounds)
1.1 簡介
PFCs是一類分子中與碳原子連接的氫原子全部被氟原子所取代的高氟有機化合物。由于氟具有極大的電負性(-4.0)和低極性,使得C-F鍵具有很強的極性,C-F鍵是自然界中鍵能最大的共價鍵之一(鍵能約為460 kJ·mol-1)[1]。由于PFCs優良的物理化學性質,被廣泛應用于工業生產和日常生活中。環境介質中的PFCs難以被物理、化學及生物作用降解,甚至在某些強氧化劑和強酸堿等極端條件下仍可以保持穩定[2-3]。目前,在空氣[4]、水體[5]、沉積物[6]、土壤[7]、野生生物[8]甚至極地冰原地區[9]都可檢出PFCs。
1.2 生產現狀
自1951年由3M公司成功研制以來,PFCs被廣泛用于諸多生活消費和工業生產領域。全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)和全氟辛酸(perfluorooctanoic acid, PFOA)是產量最大的PFCs[10]。據統計,在1970—2002年間,全球全氟辛烷磺酰氟(perfluorooctanesulfonyl fluoride, POSF)和相關化合物產品及副產物的產量分別約為96 000 t和26 500 t[11];在1951—2004年間,PFOA的產量約3 600~5 700 t,全氟壬酸(perfluoro-n-nonanoic acid, PFNA)在1975—2004年的產量約800~2 300 t[12]。Wang等[13-14]評估1958—2015年,PFOS及PFOS前體物質、x-全氟辛烷磺酰胺/磺胺醇(x-perfluorooctanesulfonamides/sulfonamidoethanols, xFOSA/Es)和POSF排放量分別為1 228~4 930 t、1 230~8 738 t和670 t[13];1951—2015年期間,全氟羧酸(perfluoroalkyl carboxylic acid, PFCAs)的排放量為2 610~21 400 t[14](如圖1)。

圖1 在1951—2030年間各類全氟化合物 在全球的預估生產量[13-14]注:PFOS、xFOSA/Es、POSF和PFCAs表示全氟辛烷磺酸、 x-全氟辛烷磺酰胺/磺胺醇、全氟辛烷磺酰氟和全氟羧酸。 其中,2002年前PFOS生產量數據的統計時間為1958—2002年。Fig. 1 Estimated production of various perfluorinated compounds during 1951—2030 years[13-14] Note: PFOS, xFOSA/Es, POSF and PFCAs stand for perfluorooctane sulfonate, x-perfluorooctanesulfonamides/sulfonamidoethanols, perfluorooctanesulfonyl fluoride and perfluoroalkyl carboxylic acid. The time range for production estimation is from 1958 to 2002 in terms of PFOS data before 2002.
由于PFCs對生物存在潛在毒性效應,全球最大的生產商3M公司宣布從2001年起,自愿逐步停止PFOS及其相關產品的生產,并于2003年初,完全停止PFOS的相關生產[15]。美國環境保護署(United States Environmental Protection Agency, USEPA)與8家全球領先的制造商簽署相關協議,計劃到2010年將減少95%的PFOA及相關化學品的排放,爭取在2015年停止相關生產。1951—2002年間,全氟烷酸(perfluoroalkanesulfonic acids, PFSAs)的排放量實質性減少,而PFCAs的排放量仍較為穩定,甚至在2002—2012年出現上升的趨勢[13-14]。由于缺乏有效的代替物,2001年后我國仍在生產并使用PFOS[16],2001—2006年間,生產量逐年增加,2006—2011年間年產量為200~250 t,其中,約有一半出口至巴西、日本和歐盟等國家和地區,一半供國內生產使用[17]。
目前,PFOS等部分PFCs已被大多數國家禁止生產,但因為其具有難降解、遠距離遷移和生物累積性,所以PFCs在全球范圍內的各種環境介質中仍能被檢出[4-7]。毒理學研究表明,PFCs對動物具有臟器毒性[18]、免疫和內分泌毒性[19]、神經毒性[20]、致癌性[19]、生殖及發育毒性[19]等。2009年5月,聯合國環境規劃署(United Nations Environment Programme, UNEP)正式將PFOS及其鹽類和POSF等9種物質列為新型持久性有機污染物(persistent organic pollutants, POPs)并列入斯德哥爾摩公約,160多個國家和地區同意減少并最終禁止使用該類物質[13]。2014年,我國環境保護部聯合十一部委下發了關于“全氟辛基磺酸及其鹽類”等10種持久性有機污染物禁止生產、流通、使用和進出口公告。
2 全氟化合物的污染現狀(Pollution status of PFCs)
環境介質中的PFCs來源主要分為直接來源和間接來源,直接來源是指生產和使用過程中直接排入環境,間接來源主要是PFCs前體物質的降解及遠距離遷移,后者是偏遠地區PFCs污染最主要的來源。一些工廠產生的廢氣不經處理直接排入大氣,大氣沉降作用可將附著在顆粒相的PFCs帶入水體和土壤等。土壤中的PFCs能滲透到地下水系統造成污染,地表徑流作用可將污染物帶至更大的支流水域,最后匯入海洋。近年來,短鏈PFCs被大量生產用于代替中長鏈PFCs,如全氟丁基磺酸(perfluorobutanesulfonic acid, PFBS)(C=4)被廣泛使用來代替PFOS[21],所以在各類環境介質中PFCs的總濃度仍保持較高水平。
2.1 空氣中的全氟化合物污染
空氣是人類和陸生動物暴露PFCs的重要途徑[22]。陸生動物基本上24 h均暴露在空氣中,可通過呼吸途徑攝入PFCs。藥代動力學模型分析結果表明,人體從灰塵中攝入PFCs的量和血液中PFCs濃度水平存在顯著的相關性[23],Haug等[24]研究發現,室內灰塵PFCs濃度與生活在此環境中人類血清中PFCs含量呈現顯著正相關關系,其中,女性從灰塵中攝入PFCs的量占總攝入量的50%,這些研究結果都強調了空氣作為PFCs暴露途徑的重要性。
與統計的生產、使用及排放量相對應,PFOS和PFOA是大氣環境中主要的2種PFCs。Liu等[25]對深圳的大氣開展研究,得出PFCs的主要物質組分及所占百分比分別如下:PFOA(35%)>PFOS(22%)>PFPeA(11%)>PFBA(9.9%),其中,PFPeA(perfluoropentanoic acid)為全氟正戊酸,PFBA(perfluorobutyric acid)為全氟丁酸;PFCs、PFOA和PFOS含量范圍為3.4~34 pg·m-3、1.5~15 pg·m-3和nd~4.3 pg·m-3(nd表示未被檢測出,下文同)。近年來,PFBS和PFHxA等短鏈PFCs被大量生產并使用,環境介質中也檢出較高含量的短鏈PFCs。何鵬飛等[26]對深圳的空氣開展研究發現,15種PFCs中,短鏈PFCs如PFPeA和全氟己酸(perfluorohexanoic acid, PFHxA)的檢出率均大于70%,呈短鏈PFCs>中鏈PFCs>長鏈PFCs分布,大部分站點PFBS濃度為PFOS的2~4倍。夏慧等[27]對上海市家庭、宿舍和辦公室灰塵中PFCs進行研究,發現PFOA含量最高,占總PFCs的60%,PFOA和PFBS檢出率為100%,PFOS的檢出率僅為65.9%。空氣中短鏈PFCs的大量檢出,推測原因是碳鏈較短的離子型PFCs,蒸氣壓較高,更易揮發到大氣中[27]。對日本家庭室內的空氣和灰塵進行分析,PFOS和PFOA含量范圍分別為11~2 500 ng·g-1dw和69~3 700 ng·g-1dw (dw為dry weight的縮寫,2.1和2.3中沉積物和土壤樣品的單位均以dw計),表明家庭灰塵中存在一定濃度的PFCs[28]。中國武漢一家工廠產品存儲室空氣中PFOS、PFOA和全氟己烷磺酸(perfluorohexane sulfonate, PFHxS)均能被檢出,其中PFOS含量高達461.84~4 305.68 ng·g-1,而原料倉庫和電解車間的PFOS含量分別為159.73~1 046.07 ng·g-1和141.26~471.83 ng·g-1,遠高于辦公室的濃度65.91~75.39 ng·g-1[29]。若無相應的防護措施,生產部門的工人通過呼吸攝入PFOS和PFOA量更大,應引起足夠重視。在瑞典的家庭住宅、公寓、護理中心、辦公室和車輛中進行采樣分析發現,灰塵中PFOS和PFOA含量顯著正相關,辦公室PFOS濃度最高,為110 ng·g-1,其次分別為公寓(85 ng·g-1)、住宅(39 ng·g-1)、日托中心(31 ng·g-1)和車輛內(12 ng·g-1)。PFOA在公寓內濃度最高,為93 ng·g-1,其次分別為辦公室(70 ng·g-1)、住宅(54 ng·g-1)、日托中心(41 ng·g-1)和車輛內(33 ng·g-1)[30]。室外、住宅、辦公室或工廠車間等這些作為人類日常活動的主要場所,空氣中均能檢出不同濃度的PFCs,長時間攝入高濃度的PFCs對人體健康存在一定的風險。其中,工廠車間或者粉塵較多的環境中PFCs污染更嚴重,對長時間處于這樣環境的人群攝入PFCs的量以及相關的風險評估應更深入研究。
Bj?rklund等[30]對成年人和兒童通過灰塵攝入的PFCs進行評估,結果表明空氣中的灰塵是人體攝入PFCs的重要途徑。在粉塵多的環境下,呼吸是成年人和兒童攝入PFOS和PFOA的主要途徑,分別占PFOS總攝入量的58%和82%,占PFOA總攝入量40%和77%[30],評估結果發現嬰幼兒通過灰塵和皮膚攝入PFCs的量比成年人高1~5倍,并且通過灰塵直接攝入PFCs量比皮膚攝入高[27]。Ericson等[23]的研究表明,在較差的環境下,成年人和嬰幼兒通過灰塵攝入PFCs的量分別占總攝入量的4%和20%。相同環境中,嬰幼兒通過呼吸和皮膚接觸攝入PFCs的量高于成年人,由于嬰幼兒身體還未發育完全,排出機制尚未完善,對外來污染物抵抗力較弱,這就導致他們更容易受PFCs的影響。因此,室內灰塵作為人體攝入PFCs的重要途徑,對嬰幼兒的危害大于成年人。
2010至2012年,在泰國北標府、暖武里府、曼谷和北欖府4個地區采集空氣進行分析,空氣中PFOS和PFOA含量范圍分別為0.44~6.75 ng·g-1和0.23~0.46 ng·g-1,北欖府地區的含量最高,這與附近工廠的生產排放相關[31]。Liu等[25]和何鵬飛等[26]的研究中PFCs含量最高的站點位于制造業發達的地區,分布著較多的五金電鍍和電子制造工廠。Ge等[4]對中國香港、印度金奈、日本金澤和沖繩4個地區大氣進行PFCs分析,香港大氣中PFCs含量是其他地區的2倍及以上,這與香港的采樣點附近有大型國際機場相關。工業生產和交通活動頻繁的環境中的粉塵顆粒及PFCs污染比一般環境高,在這類環境工作的人群應多加防護措施,相關部門更應加強監管并給予一定的安全管理。對4個城市的全氟烷基磺酸(per- and polyfluoroalkyl substances, PFASs)濃度進行分析發現,所有站點中,PM0.1的PFASs含量最高,推測大氣中的顆粒物對PFCs具有一定的吸附作用[4]。Pattanasuttichonlakul等[31]研究發現,泰國空氣中總懸浮顆粒的PFOS和PFOA含量高于PM10,PFOS的含量分別為0.74~1.08 ng·g-1和0.41~0.51 ng·g-1,PFOA的含量分別為0.20~0.32 ng·g-1和0.06~0.18 ng·g-1。深圳空氣中PFCs含量與PM2.5和PM10均呈顯著正相關關系,這與大氣顆粒物中某些氧化物能與PFCs發生異相氧化有關[25-26]。PFCs可以吸附在總懸浮顆粒物上,而總懸浮顆粒能吸附在呼吸道(如鼻子和喉嚨),吸附在顆粒物質上的PFCs會隨其吸附在呼吸道上;雖然PM10的PFCs含量較低,但PM10能進入呼吸道(如肺),長時間的攝入勢必會引起相關的健康問題。雖然很多研究的評估結果表明大氣中PFCs的污染水平對人體健康尚未造成急性毒害作用,但PFCs具有富集效應且種類繁多,應值得警惕。
2.2 水環境中的全氟化合物污染
工農業生產和生活中排放的廢水已成為地表水和海洋環境PFCs污染的一個重要來源。2004至2005年對日本淀川流域和附近污水處理廠進行采樣分析,得出PFOS和PFOA含量范圍分別為0.4~123 ng·L-1和4.2~2 600 ng·L-1,污水處理廠出水處和支流的表層水樣出現了最高濃度,表明該污水處理廠排出的廢水是當地地表水PFCs污染的一個重要來源[32]。Guo等[33]的研究結果表明,生活污水是韓國水環境中PFCs污染的主要來源,污水中的PFCs主要為PFOA和PFOS,排入和排出污水處理廠的PFOA濃度分別為2.3~615 ng·L-1和3.4~591 ng·L-1,PFOS濃度分別為nd~68.1 ng·L-1和nd~8.9 ng·L-1,污水處理廠的處理使污水中的PFOS濃度降低,而PFOA濃度卻升高了。美國污水處理廠排放的廢水中除全氟十一烷酸(perfluoroundecanoic acid, PFUnDA)和全氟十二烷酸(perfluorododecanoic acid, PFDoA)外,其他PFCs(C6及以上)檢出率為100%[34]。美國地區水樣中PFASs的檢出率高于70%,經特定工藝處理后的飲用水PFASs含量處于較低水平,但個別站點的PFHxA含量仍高達62 ng·L-1[35]。松花江江水中總PFCs濃度為0.143~1.41 ng·L-1,其中PFOA檢出率最高,濃度范圍為nd~0.678 ng·L-1,研究發現松花江的PFCs污染主要來自當地污水處理廠排入的廢水[36]。污水處理廠的目的在于降低或消除廢水中的污染物,但研究發現部分污水處理廠最終排出的水體中PFCs濃度仍處于較高的水平。
PFOS和PFOA的生產和使用雖已被禁止或削減,但由于其使用量大且難降解,很多研究發現環境中PFCs污染仍以這2個物質為主。上海黃浦江水體中14種全氟烷酸類化合物(perfluoroalkyl acids, PFAAs)總含量范圍為39.8~596.2 ng·L-1,其中PFOA和PFOS為主要物質,均值分別為139.6 ng·L-1和46.5 ng·L-1[37]。韓國的生活污水、印度恒河、泰國湄南河、中國東部農村地區地表水和太湖的PFCs均以PFOS和PFOA為主[7,33,38-40]。隨著PFOS和PFOA被禁止和限制使用,短鏈PFCs被大量生產使用,導致殘留在環境中的短鏈PFCs不斷增加。南非斯特倫堡-普蘭肯堡河周邊地表水PFCs含量范圍為62.30~186.4 ng·L-1,PFCs(C≤8)如PFBA(10.2~28.4 ng·L-1)和全氟庚酸(perfluoroheptanoic acid, PFHpA)(10.5~77.6 ng·L-1)在所有位點均被大量檢出,其中PFOA和PFOS含量分別為12.8~62.62 ng·L-1和nd~12.4 ng·L-1,低于美國環境保護署規定的飲用水閾值(PFOA為200 ng·L-1,PFOS為400 ng·L-1)[6,41]。大凌河和湯遜湖的水體中PFAAs均以PFBA和PFBS為主,大凌河中PFBA和PFBS含量分別為2.90 μg·L-1和1.35 μg·L-1,湯遜湖中分別為3.66 ng·L-1和4.77 ng·L-1[42-43]。與2年前相比,大凌河水體PFBS和PFOA濃度分別增加了6.9倍和3.7倍,PFBA則一直保持高濃度水平[42]。上海市工廠附近地表水的PFCs主要由PFOA、PFBS和PFPeA組成[44]。上海市地表水及天津市地下水的PFCs以PFOA和PFBS為主,上海市地表水PFOA和PFBS含量分別為50.67 ng·L-1和29.84 ng·L-1,天津市地下水含量分別為1.1 ng·L-1和0.81 ng·L-1,這與工業上使用PFBS代替PFOS有一定相關性[8,45-46]。隨著工業生產對PFCs的需求與日俱增,短鏈PFCs的生產和排放對環境所造成的污染不容忽視。
短鏈PFCs生物富集能力比較弱,但它們在各類環境介質中的降解需要一定周期,大量的排放會使環境中的殘留量不斷增加。水體的PFBS和PFBA在水平方向上可沿水流向遠距離輸送,在垂直方向上可向深層滲透[43]。研究發現,1996至2010年間,瑞典婦女血液中的PFBS以每年11%的速度增長,推測部分短鏈PFCs在生物體內具有一定的富集能力[47]。Krippner等[48]研究發現,短鏈PFASs在玉米幼苗中的富集能力大于長鏈PFASs。對PFCs代替產品的結構、性質、毒理學特征和用途都應深入研究,關于它們生產和使用的規定均應明確。武漢東湖水樣中PFHxS、PFHpA和PFNA的檢出率為100%,PFUnDA和全氟十二酸(perfluorododecanoic acid, PFDoDA)在70%的水樣中均未被檢出;研究表明,短鏈PFSAs和PFCAs主要分布在水相,長鏈PFCAs和PFSAs更傾向于與顆粒物結合,積累于沉積物或水生生物中[49]。評估生態環境中PFCs污染的程度,不僅要對水體開展研究,還需要對水生環境中的沉積物和生物進行深入研究。
上海市機場附近、氟化工廠和金屬電鍍廠附近的地表水中PFCs含量分別為142~264 ng·L-1、200~2 143 ng·L-1和211~705 ng·L-1,PFOA是最主要的PFCs,最高含量可達1 985 ng·L-1,PFOS處于較低的濃度水平,含量范圍為<0.06~4.44 ng·L-1[44],不同區域地表水中PFCs含量的差異表明,氟化工廠和金屬電鍍生產過程排放的污水會直接對周邊的地表水產生影響。雨水中PFNA/PFOA、PFBA/PFOA和PFHpA/PFOA的比值在不斷升高,這與周邊地區有氟化工廠的排放相關,表明這大氣降水會將PFCs及其前體物質從氟化工業地區帶到鄰近的農村地區[7]。PFBA和PFHpA可反映人類和牲畜的排泄物(可作為家庭和農場污水的間接指標)和大氣降水來源,PFNA則反映了氟調聚物醇的降解和其他工業的來源[50]。Fagbayigbo等[6]研究發現,人類活動區域附近河流的PFOS和PFOA含量高于其他區域,推測研究區域的PFCs主要來源于人類活動,如工業生產、農業排放和生活垃圾等。與上游水域相比,黃浦江下游尤其是臨近工廠和城市化地區的水體中PFAAs的含量大大增加,每年由黃浦江排入長江的PFAAs量為2 263.4 kg,工業污水、城市污水和地表徑流被認為是最主要的污染來源[51]。污水處理廠、工農業生產和生活產生的污水的直接排放仍然是水環境中PFCs污染的主要源頭。
除了地表水和海水外,飲用水中的PFCs污染也引起人們的關注。飲用水是人體攝入PFCs的一個重要途徑,已有研究表明,飲用水中PFOA的含量水平和當地居民血清中PFOA含量呈正比關系[52]。對德國萊茵河流域的水質進行系統性調查,發現該地區水庫的水體PFCs污染較為嚴重,而飲用該水源的居民血液中PFOA含量比其他地區高出5倍[53-54]。研究發現,中國居民血清中至少有13%的PFOA來源于自來水,南京部分地區居民血液中8.2%的PFOS來源于自來水,這表明自來水是中國居民接觸PFCs的重要途徑[55]。在中國城市自來水調查中,大部分城市的自來水均含有PFOS和PFOA,其中大部分城市自來水PFCs含量均處于較低的水平,但深圳和廣州自來水濃度均大于10 ng·L-1,長期飲用會對人體健康產生一定的風險[56]。部分傳統飲用水凈化工藝如混凝、沉淀、氯化等對PFCs的去除效率較低,因此在飲用水中仍存在一定量的PFCs,從而導致人類暴露于PFCs。盡管飲用水中PFCs含量處于較低水平,但人體每日攝入量較大,因此自來水中PFCs對人類的健康風險應該被進一步重視和研究。
2.3 土壤及沉積物中的全氟化合物污染
陸地上,大氣中的PFCs經過雨、雪及其他干濕沉降等,最后進入到土壤;水生環境中,沉積物作為底棲生物的活動區域,是PFCs沉降和儲存的場所[12],土壤和沉積物可以作為評估環境中PFCs污染程度的指示物。與水體相似,土壤和沉積物中的PFCs以PFOS和PFOA為主。但水體中的PFCs除了PFOA和PFOS外,短鏈PFCs如PFBA、PFHxA和PFBS均能被大量檢出[6-8,45],沉積物和土壤中的PFCs組成與水體存在一定的差異。對常熟、太倉、揚州、鹽城、淮安、泰安、聊城和天津7個城市的農村地區以及蘇州城區的土壤進行分析,發現17種PFCs的檢出率大于80%,其中PFOA和PFUnDA的檢出率為100%,僅次于PFBA和全氟癸酸(perfluorodecanoic acid, PFDA),而PFHxS和PFBS幾乎未被檢出[7]。山東半島沿海地區沉積物中PFCs以PFOS和PFOA為主,PFBA、全氟戊酸(perfluoropentanoic acid, PFPA)、PFHxA、PFHpA、PFBS和PFHxS的檢出率分別為35%、65%、75%、90%、70%和80%,除PFNA(95%)外,碳鏈長度為8及以上的PFAAs檢出率為100%[57]。黃河、海河、遼河、珠江和東江表層沉積物中的PFCs以PFOS、PFOA、PFDA和PFUnDA為主,檢出率分別為100%、63%、42%和44%,短鏈PFHpA和PFHxA的檢出率低于30%[58]。江蘇省湖泊表層沉積物中長鏈PFCs(C9~C14)的含量是短鏈PFCs(C4~C7)的3倍[59]。研究發現部分PFCs蒸氣壓低,可適度溶于水中,易吸附于固體(如土壤和沉積物)[60]。PFCs(C≥7)具有較高的平衡解離常數,更易被沉積物或土壤吸附[57]。不同碳鏈長度的PFCs在不同環境介質的分布情況不僅與當地PFCs排放情況有關,還與PFCs本身的化學結構及性質相關。
不同區域環境中的PFCs組成部分存在差異。珠江沉積物中PFSAs含量高于PFCAs,PFCs的主要組分以及所占比例分別如下:PFOS(51%~84%)、PFOA(5.5%~31.7%)和PFBS(5.8%~31.4%)[61]。黃浦江沉積物中PFCAs含量高于PFSAs,PFCs的主要組分以及所占比例分別如下:PFOA(48.8%~100%)、PFOS(0%~48%),PFBS僅在2個站點中被檢出[61]。山東半島沉積物中PFOA和PFOS的檢出率均為100%,PFBS的檢出率僅為70%[57]。Gao等[62]研究發現,珠江口沉積物中PFASs含量均值為0.79 ng·g-1,PFBS和PFHxS是最主要的組分,均值分別為0.43 ng·g-1和0.19 ng·g-1。近10年來,珠江口水體、沉積物及海洋生物中PFBS的檢出含量不斷增加,這與PFBS作為PFOS的關鍵替代品,被大量生產使用及排放相關。不同地區沉積物中各類PFCs組成比例存在差異,這不僅與當地水環境的水利條件等相關,還與當地經濟發展和生產結構相關。
大氣沉降和遠距離遷移會給環境帶入PFCs,但當地工業生產活動和其他人類活動才是環境中PFCs的最主要來源。與大氣和水體污染情況相似,工業發達地區的土壤中PFCs污染更嚴重。胡國成等[63]對廣州、深圳、東莞和珠海4個城市的土壤進行分析,4個城市土壤PFOS和PFOA的含量范圍分別為0.05~2.41 ng·g-1和0.02~1.24 ng·g-1,其中東莞和深圳土壤的PFOS和PFOA平均含量略高于廣州和珠海,這與城市產業結構組成和當地的經濟活動等相關。對上海黃浦江和蘇州河附近污泥、沉積物和土壤中的PFOS進行分析,發現PFOS總濃度范圍分別為62.5~276 ng·g-1、141~237 ng·g-1和413~755 ng·g-1,遠高于非工業區[64]。研究發現近岸水域沉積物比遠岸沉積物中的PFASs含量高[62]。在珠江和黃浦江沉積物的研究中,PFCs含量最高的站點位于城市中心或河口處,其中河口處的PFCs含量顯著高于其他站點[61]。Wang等[29]對工廠附近的土壤和散養雞的雞蛋進行分析,發現距離工廠3 km以內,土壤和雞蛋中PFOA、PFHxS和PFOS含量隨距離增加而下降。Strynar等[65]對美國、日本和墨西哥農區土壤的13種PFCs進行分析,發現工業區和污水處理工廠附近的土壤總PFCs含量高于其他地區,最高含量分別為129、35.5和10.8 ng·g-1。經濟發達和人為活動頻繁的東部平原地區湖泊沉積物中PFCs含量遠高于人為活動較少的內蒙古-新疆地區及青海-西藏地區,濃度分別為1.72、0.333和0.462 ng·g-1[66],Qi等[66]使用模型分析確定了食品包裝、紡織、電鍍、消防、半導體工業、貴金屬和涂料工業的排放為主要排放源,研究區域中77.7%的PFCs(C4~C14)和22.3%的PFOS來源于這些生產過程;江蘇省湖泊沉積物中20.6%、52.4%、20.2%和6.8%的PFASs分別來源于紡織品處理、含氟聚合物加工助劑及氟樹脂涂料、金屬電鍍和貴金屬這4個行業的生產[59]。對不同地區各類環境介質的PFCs進行分析評估,并使用模型確定環境中PFCs的具體來源,為相關部門的監管提供一定的基礎數據和依據。
2.4 水生動物中的全氟化合物污染
持久性有機物屬于親脂性物質,可大量富集在生物體的脂肪組織,而PFCs屬于親蛋白物質,更傾向于富集于高蛋白的器官和組織。Ahrens等[67]對德國灣港海豹(Phocavitulina)的13個組織中的PFCs進行分析,發現肝臟的PFCs含量最高(1 071 ng·g-1ww,ww為wet weight),脂肪最低(均值為11.4 ng·g-1ww)。丹江水庫的魚類中,肝臟PFCs濃度比肌肉高,分別為36.7~87.9 ng·g-1dw和3.02~38.9 ng·g-1dw,PFCs在生物組織內的分配受其與蛋白結合能力影響[68-69]。水環境中,不同的動物對PFCs的富集能力和模式具有差異,棲息環境、環境介質中的濃度、食物來源及攝食速率、代謝速率和生長速率等均是影響因素。韓國西部的水域環境中,PFAAs在魚體內含量最高,其次為蟹類和牡蠣(OstreagigasThunberg)[70],營養等級是影響生物富集PFCs的一個重要因素。中國巢湖的鮒魚(Carassiusauratus)、紅鰭鲌(Chanodichthyserythropterus)和花鮕(HemibarbusmaculatusBleeker)等5種魚類肌肉中17種PFAAs含量均值為12.71 ng·g-1ww,PFOS均值為4.57 ng·g-1ww,表明不同物種間對PFCs的富集能力存在一定的差異性[71]。魚類對PFCs的富集仍以PFOS和PFOA為主,中國太湖的魚類中PFASs以PFOS和PFHxS為主,但PFOS濃度均值比PFHxS高出20多倍[72]。日本大牟田市附近河流中黃鰭刺鰕鯱魚(Acanthogobiusflavimanus)的總PFCs含量高于鯔魚(Mugilcephalus),尤其是PFOA(8.3和1.3 ng·g-1ww)、PFHxA(6.8和<0.25 ng·g-1ww)和PFHxS(5.1和<0.77 ng·g-1ww)[73]。兩者雖均為底棲魚類,但是黃鰭刺鰕鯱魚主要攝食多毛類和蝦,鯔魚則主要攝食底棲微藻[73]。
水環境中的PFCs會直接或間接對生活在此環境的生物產生影響。研究表明水生動物體內PFAAs的濃度與水體中PFAAs濃度呈顯著正相關關系(P<0.01)。Hong等[70]研究發現韓國西海岸中PFAAs濃度最高的魚和蝦均來自污染最嚴重的水域,He等[69]研究發現,丹江口水庫的魚類肌肉中PFCs含量比鐘祥河段和襄陽河段高,分別為16.50、15.88、和8.10 ng·g-1dw,調查發現丹江口水庫上游有許多大型工業園區,涉及印染、造紙、機械、皮革和電力等行業,有大量的污水排入。芬蘭萬塔灣是一個相對封閉的海灣,周邊的工廠和污水處理廠給萬塔灣帶入了大量的污染物,萬塔灣的鱸魚(Lateolabraxjaponicus)體內PFAAs含量比波羅的海、派延奈湖高4~15倍,分別為20~46 ng·g-1ww、1.8~7.4 ng·g-1ww和3.5~3.7 ng·g-1ww[74]。PFAAs在蟹類的殼與大腿的PFAAs含量為軟體組織的一半,表明表皮吸收是水生動物從水環境中攝入PFCs的途徑之一[70]。水體環境的PFCs污染程度對水生動物有直接的影響,其中攝食和表皮吸收都是攝入PFCs的重要途徑。
海洋環境中PFCs經過食物鏈不斷傳遞放大,在頂級哺乳動物體內達到最大值。生物放大因子(bioaccumulation factors, BAF)是研究水生生態系統中有機污染物的分配行為和評估它們生態風險的重要參數,BAF可以作為評估和監測水環境中有機污染物污染程度的指示參數。Liu等[71]研究發現,BAFs、生物懸浮固體積累因子(biota-suspended solid accumulation factors, BSSAFs)和生物沉積積累因子(biotasediment accumulation factors, BSAFs)分別為0.35~12 370.51、7.77~8 452.92和9.10~6 984.61,隨著PFCs碳鏈長度的增加,這些參數值不斷增大,表明碳鏈長度越大,越容易在水生動物體內富集。目前關于生物體對長碳鏈PFCs的攝入效率、及其毒性和降解的研究較少,更多更深入的相關研究有待開展,以期更全面地了解PFCs。Chen等[72]對太湖水生環境的各類環境介質及生物開展研究,發現PFAAs、PFOS、PFDA、PFUndA和PFDoA的含量與對應的營養等級呈顯著正相關關系,它們的營養級放大因子(trophic magnication factor, TMF)均大于1,這表明PFSAs和PFCAs(C>8)可以在食物鏈中傳遞放大。PFCs通過營養級傳遞與放大的作用與物種所在營養等級有密切關系,營養等級越高,PFCs的富集能力越強,其中PFOS和PFCAs(C8~C14)隨營養級有顯著的放大作用[68,75]。對美國薩拉索塔灣和查爾斯頓港2個地區的海水、沉積物、浮游動物、魚和海豚進行分析發現,PFCs的污染以PFOS和10個碳鏈長度的PFCAs為主,2個流域中PFCs的生物放大系數(biomagnification factors, BMF)范圍分別為1~156和1~30,表明PFOS和PFCAs(C8~C11)具有沿食物鏈累積放大的特性[75]。
水生生態系統中,PFCs可通過食物網的捕食和攝食,從營養等級較低的有機體(如水生植物、浮游植物和浮游動物)轉移到營養等級更高的有機體(如肉食性、雜食性魚和鯨豚)。因此,高營養級的生物體內的PFCs濃度更高。海洋鯨豚作為海洋環境的頂級捕食動物,對PFCs的富集能力更強,鯨豚可作為評估海洋環境PFCs污染的指示生物。與環境介質相似,海洋鯨豚臟器中的PFCs以PFOS為主。歐洲波羅的海和北大西洋的港灣鼠海豚(Phocoenaphocoena)肝臟中,PFOS為最主要的PFCs,含量分別為159~2 425 ng·g-1ww和204~2 404 ng·g-1ww,其次為全氟辛烷磺酰胺(perfluorooctane sulfonamide, PFOSA),濃度分別為2~95.3 ng·g-1ww和2.3~237 ng·g-1ww[76]。格陵蘭島的斑紋海豹(Phocalargha)和虎鯨(Orcinusorca)肝臟中PFASs含量分別為138和169 ng·g-1lw (lw是lipid weight的縮寫),PFOS占總PFCs的50%以上,分別為93和122 ng·g-1lw[77]。2002—2014年擱淺在香港東部水域的成年印度太平洋江豚(Neophocaenaphocaenoides)和中華白海豚(Sousachinensis)的肝臟中總PFASs含量水平高達30.5~2 720 ng·g-1dw和136~15 300 ng·g-1dw,其中PFOS分別為127~1 960 ng·g-1dw和190~13 200 ng·g-1dw,遠高于世界其他地區海洋哺乳動物PFCs的污染水平[8],這與珠江口繁忙的海上交通以及發達的工業有很大關系。Lam等[8]研究發現,珠江口水域35%的中華白海豚和4%的印度太平洋江豚肝臟中PFOS含量大于676.7 ng·g-1ww的臨界閾值濃度(tentative critical concentrations, TCC),這表明生活在此水域環境的海洋哺乳動物正在遭受一定程度的PFCs污染風險。美國查爾斯頓港是世界聞名的港口,繁忙的海上運輸以及工程建設給海洋環境帶來嚴重的污染,該地區的海豚血清PFCs濃度高達574.0~8 670 ng·L-1[78]。Fair等[79]通過關聯性分析證明,瓶鼻海豚血液中高濃度的PFCs會對海豚造血、免疫和肝腎功能造成不利影響。對各地區海洋哺乳動物臟器中PFCs的污染水平開展研究,不僅能反映當地海洋環境的污染程度,還能在一定程度上指示沿海居民的健康情況,同時也對世界各地海洋鯨豚的保護起到一定的警示作用。
研究發現海洋哺乳動物幼年個體的PFCs濃度水平顯著高于成年個體,寬吻海豚(Tursiopstruncatus)、虎鯨和白鯨(Delphinapterusleucas)等均出現這種現象[64,68,79],Shaw等[80]的研究發表明海洋哺乳動物新生兒體內的PFOS含量是成年雌性個體的2~6倍,Ishibashi等[81]的研究表明幼年貝加爾湖海豹(Phocasibirica)血清和肝臟的PFCs是成年個體的2~4倍。PFCs在鯨豚體內可以實現妊娠傳遞和母乳轉移,研究發現PFCs在虎鯨妊娠過程中的轉移率為2.2%~11%[77],瓜頭鯨(Peponocephalaelectra)的轉移率為5.1%~9.5%[82]。海洋環境中高濃度的PFCs不僅會對當前生活在此環境中的生物產生危害,還會對它們的子代產生影響,對整個生態系統的多樣性產生影響。
2.5 人體內的全氟化合物污染
PFCs在人體血液的富集模式與各類環境介質的模式存在異同點,PFOS和PFOA是人體血液中最主要的PFCs,但PFOS含量一般都遠高于PFOA;除PFOS和PFOA外,PFHxS也是血液中主要的PFCs,而部分短鏈PFCs如PFBS的檢出率較低或未被檢出。德國慕尼黑地區孕婦在分娩前、分娩中、分娩后6個月的血液中PFCs以PFOS和PFOA為主,后者濃度均值高于前者[83](如圖2)。Olsen等[84]對年齡在20~69歲的616名美國公民的血漿開展研究,在2006、2010和2015采集的血漿中主要的PFCs組分及含量分別為PFHxS(1.5、1.3、0.9 ng·mL-1)、PFOS(14.5、8.4、4.3 ng·mL-1)和PFOA(3.4、2.4、1.1 ng·mL-1),PFBS和PFHxA均未被檢出。2008年和2010年采集的澳大利亞公民血漿中,PFOS、PFOA和PFHxS的含量范圍分別為5.3~19.2和4.4~17.4 ng·mL-1、2.8~7.3和3.1~6.5 ng·mL-1、1.2~5.7和1.4~5.4 ng·mL-1,其他PFCs的濃度均低于1 ng·mL-1[85]。429名波蘭公民血漿中的PFCs以PFOS(1.61~40.14 ng·mL-1)、PFOA(0.67~12.56 ng·mL-1)、PFHxS(0.12~10.16 ng·mL-1)和PFNA(0.2~5.32 ng·mL-1)為主[86]。PFCs在挪威公民的血清、血漿和全血中的分布有一定的差異,但仍以PFOS(48%~51%)和PFOA(16%~19%)為主,PFBS僅占1%[87]。Zhang等[88]對廣州地區的321個臍帶血清進行分析,PFHxS、PFOS和PFOA為最主要的成分,均值分別為3.87、2.99和1.23 ng·mL-1,其中PFOS和PFOA不同異構體組成有一定的差異,這表明血清中PFASs可能具有不同的暴露途徑和新陳代謝方式。Wu等[89]的研究表明,上海市民血清中PFOS和PFOA為主要成分,分別占總PFCs的49.5%和34.2%,含量分別為8.53~99.37 ng·mL-1和5.56~36.29 ng·mL-1。上海687個臍帶血樣品中的PFOS和PFOA占總PFASs的80%,其中PFOA含量高于PFOS,分別為6.96和2.48 ng·mL-1[90]。與其他國家的研究結果不同,國內近2年的研究發現,短鏈PFCs如PFBA和PFBS的檢出率較高,最高可達86.7%,濃度最高可達3.37 ng·mL-1[88-89],短鏈PFCs在人體中的降解周期較短,但是若持續性攝入且攝入量較大,短鏈PFCs在人體內仍能積累至較高的濃度。PFOS和PFOA在人體內的富集模式存在差異,這與人為攝入量以及不同的PFCs與血液中的蛋白結合緊密程度具有差異相關[83],且PFOS和PFOA在人體中的消除半衰期不同。
通過分析成對的母體血清、臍帶血和母乳,發現在妊娠過程中PFCs可穿過胎盤屏障實現妊娠轉移[91]。配對的孕婦血、臍帶血、羊水和胎盤中PFASs含量分別為13.9~45.8 ng·mL-1fw、6.2~27.2 ng·mL-1fw、0.129~1.234 ng·mL-1fw和6.55~17.0 ng·g-1fw (fw為fresh weight的縮寫),羊水中PFOA的含量與孕婦血(R=0.738,P<0.01)和臍帶血(R=0.683,P<0.001)呈顯著正相關關系[92],PFASs可實現母嬰傳遞,也表明羊水可以作為妊娠期間胎兒PFOA暴露的標志物,研究還發現孕婦血至臍帶血傳遞的效率隨PFCAs(C7~C12)碳鏈數增加而增加[92],而具體傳遞效率有待進一步研究。在2007年12月至2009年10月期間,分別采集德國慕尼黑地區孕婦的分娩前、分娩中、分娩后6個月的血液、臍帶血、6個月和19個月的嬰兒的血液進行分析(變化趨勢如圖2),產婦在分娩完成后,血液中PFOS、PFOA和PFHxS均有下降趨勢[83],從圖2中可以看出,出生后6個月的嬰兒血清中PFCs的含量高于母體[83],母體通過妊娠可將一部分PFCs排出,嬰兒則可以通過妊娠和母乳獲得PFCs。Lee等[93]對韓國361名2歲兒童的血清開展研究,其中PFHxS、PFOS、PFOA和PFNA等的檢出率在74.2%以上,研究發現,母乳持續喂養的時間與子代血清中PFHxS、PFOS、PFHpA、PFOA、PFNA、PFDA和PFUnDA含量呈正相關關系(P<0.001)。Liu等[94]對國內12個省份的母乳進行分析,發現所有母乳中均能檢出PFOS和PFOA,均值為46 pg·mL-1,上海的郊區和市區的母乳中PFOA含量分別為814和616 pg·mL-1,評估發現上海地區嬰兒PFOA的每日攝入評估值(estimated daily intake, EDI)為88.4 ng·kg-1·d-1,接近德國風險評估中心和飲用水委員會聯邦院提出的每日耐受攝入量值(100 ng·kg-1·d-1),表明上海地區嬰兒暴露在較高濃度PFCs的環境中。
母體中高濃度的PFCs不僅對她們身體有毒害作用,還可通過胎盤屏障、妊娠及哺乳傳給子代。嬰幼兒發育尚未完善,污染物的排出機制尚未健全,更易富集PFCs。PFCs不僅能對剛出生的嬰兒的健康造成風險,對他們后期的生長發育也能產生不同方面和不同程度的影響。對臺灣429個母子對進行研究,臍帶血PFOS的濃度與出生嬰兒的體重和身高呈負相關關系[95]。高濃度的PFOS暴露,尤其是胎兒時期,對個體的葡萄糖等代謝產生干擾,使得人類肥胖或患疾病的概率更高[90,96]。母體血清PFOS含量與兒童后期發育過程中的認知、學習記憶、行為和注意力集中等能力呈負相關關系[97-100]。
對世界各地區不同人群血液中PFCs含量進行調查,結果如表1所示。不同地區人群PFCs污染程度具有差異性,除了與當地PFCs污染情況相關,還與飲食習慣和人體的自身代謝等相關。我國廣州和上海的人群血液中PFCs含量均值比世界其他地區高(如表1),這與我國環境中PFCs污染有很大關系。Olsen等[84]分析美國紅十字會獻血者血液中的PFCs,女性血液中PFHxS、PFOA和PFOS的含量顯著低于男性(P<0.01),濃度水平分別為0.65和1.16 ng·mL-1、0.98和1.23 ng·mL-1、3.5和5.32 ng·mL-1。法羅群島男性血液中的PFHxS、PFOA、PFOS、PFNA和PFDA含量均高于女性,如表1所示[101]。對北海道2 132名產婦進行研究,發現僅育有一個孩子的女性血液中PFHxS、PFOS、PFOA、PFNA和PFDA的含量高于育有2個及以上孩子的女性[102]。挪威女性全血的PFOS、和PFHxS和全氟庚磺酸(perfluoroheptanesulfonate, PFHpS)含量低于男性[87],兩性對PFCs的富集能力存在一定差異,不僅與兩者的攝食和生活習慣相關,還與他們的排出機制有關。除了尿液等常規排出機制外,女性還可以通過妊娠、哺乳和月經途徑排出部分PFCs。在最優的多元模型中,發現無生育的女性相比,生育過的女性的PFOS、PFOA、PFHxS和PFNA的濃度分別比未生育的女性低46%、70%、19%和62%[103]。模型分析發現母乳喂養的時間與女性體內PFAS水平的降低有關,在典型的情況下,女性通過母乳喂養能使體內的PFOA平均每個月減少2%~3%[103]。藥動學模型分析結果發現兩性體內PFCs含量的差異,其中月經途徑排出占30%的貢獻[103]。

圖2 孕婦和新生兒不同時期血液中全氟化合物(PCFs)含量[83]注:PFOA和PFHxS表示全氟辛酸和全氟己烷磺酸。Fig. 2 Concentration of perfluorinated compounds (PCFs) in pregnant women and newborns at different times [83] Note: PFOA stands for perfluorooctanoic acid; PFHxS stands for perfluorohexane sulfonate.
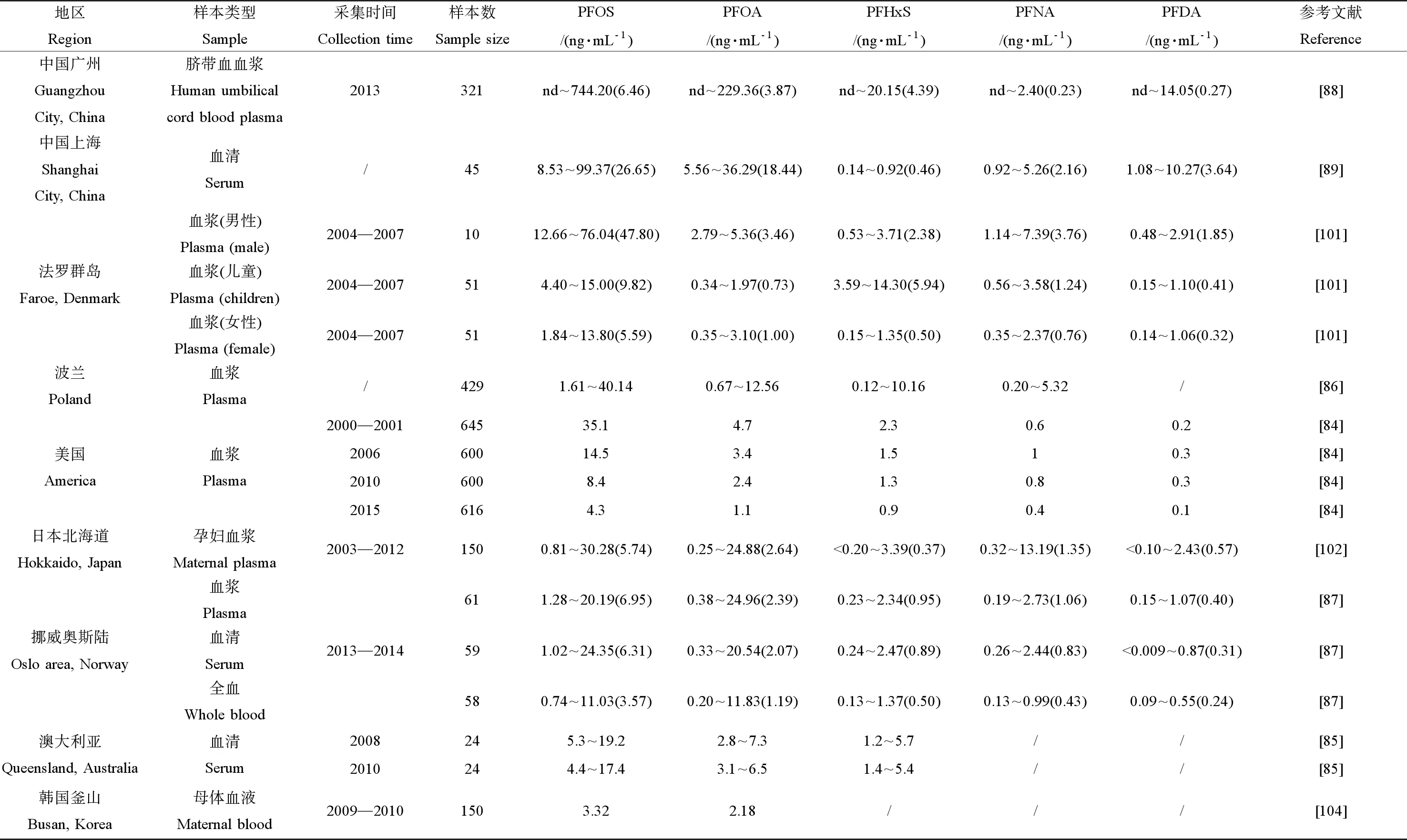
表1 不同國家和地區人體血液中PFCs的含量水平Table 1 Concentrations of PFCs in human blood from different countries and regions
注:PFNA和PFDA表示全氟壬酸和全氟癸酸;nd表示未檢出;括號中的數值表示均值。
Note: PFNA stands for perfluoro-n-nonanoic acid; PFDA stands for perfluorodecanoic acid. nd, not detected. Data in parentheses was mean value.
2.6 食品中的全氟化合物污染
飲食被認為是人類暴露PFCs的最重要途徑。海鮮是人體攝入PFOS的主要膳食來源,占總攝入量的78.9%,而肉類是造成PFOA膳食暴露的主要因素,占總攝入量的93.2%[105]。在歐洲和亞洲的研究中,人類血液中PFOS和PFOA以及部分長鏈PFCs主要與魚類等海鮮的食用相關[106-107]。Tittlemier等[108]和Schecter等[109]測定美國人和加拿大人血液中PFCs的含量,并調查他們的飲食消費模式,發現牛肉是PFCs的最主要來源。Noorlander等[110]對荷蘭的食物進行分析,發現貝類和魚類PFOS濃度水平分別為582和308 pg·g-1ww,全氟十三酸(pentacosafluorotridecanoic acid, PFTrDA)分別為268和229 pg·g-1ww。瑞典市場上的魚類研究結果如下:PFOS、PFUnDA和PFTrDA含量分別約為1 290、316和123 pg·g-1ww[111]。Llorca等[112]在2009年對西班牙海鮮市場常見的魚類開展研究,發現除PFOS和PFOA這2種常見的PFCs外,PFPeA和PFBS檢出頻率也較高。來自中國17個城市的食物中PFOS和PFOA含量分別為0.05~1.99 ng·g-1fw和0.06~12.5 ng·g-1fw[105]。Wu等[113]對遼寧、山東、江蘇、浙江、福建和廣東的海鮮食品進行分析發現,魚體中PFOS占總PFCs的38%,含量為<1.4~1 627 pg·g-1ww;PFOA是貝類中最主要的PFCs,含量為<5.4~7 543 pg·g-1ww。珠江口水域淡水魚臟器中PFOS的LogBAF值范圍為2.1~5.0,風險比值(hazard ratio, HR)為0.05~2.8,其中鰱魚(Hypophthalmichthysmolitrix)、鯰魚(Silurusasotus)和黑魚(Channaargus)HR值大于1[114],這3種魚類都是沿海居民飲食中的重要組成部分,長期食用會對人體健康產生一定的危害。Jian等[115]的綜述分析表明,在人類日常食用的蔬菜、蛋類、肉類產品、海鮮產品和碳酸飲料等樣品中均能檢出不同濃度的PFCs。對不同地區的不同食物開展PFCs分析研究,可為當地人類暴露風險評估提供基礎數據并建立良好的基線。
相比成年人,嬰兒的膳食較為單一,以母乳和嬰兒食品為主。母乳是嬰兒攝入PFOS和PFOA的主要來源,分別占總攝入量的99%和94%[105]。很多PFCs在母乳中均能被檢出,有研究表明母乳喂養時間與嬰兒體內PFCs含量呈正相關關系[83,93-94]。對來自巴塞羅那市20名婦女的母乳(產后40 d采集)進行分析,95%的母乳中PFCs以PFOS和全氟-7-甲基辛酸(perfluoro-7-methyloctanoic acid, i,p-PFNA)為主,而PFOA檢出率僅為40%,濃度為21~907 ng·L-1[116]。在所有品牌的嬰兒配方奶粉和嬰兒谷類食品中均能檢出PFOS、PFOA、PFNA、i,p-PFNA和PFDA,最高檢出含量達1 289 ng·kg-1[116]。除原始材料外,這些食品中的PFCs還可能來源于生產和加工過程中所用的包裝和容器。Llorca等[116]評估發現,西班牙地區嬰兒每天通過母乳傳遞途徑攝入PFCs的量為300 ng,其中每日攝入PFOS和PFOA的量均低于歐洲食品安全局指南的參考值(PFOS為150 ng·kg-1bw;PFOA為1 500 ng·kg-1bw)。通過妊娠轉移、母乳傳遞和食品攝入等途徑,造成的嬰幼兒生命早期的PFCs暴露,需要更深入的風險評估研究,并需要確定污染物的來源以及傳遞效率。
3 全氟化合物的毒性效應(Biotoxicity of PFCs)
PFCs可通過各種途徑(飲食、呼吸和皮膚接觸等)進入生物體內,因其強穩定性和生物蓄積性而難以被生物體降解或代謝。研究表明,PFCs屬于親蛋白的化合物,主要富集在血液、肝臟、肌肉和脾臟等器官,血液和肝臟中的濃度最高[67,78]。根據大量的研究結果,可將PFCs的毒性效應歸納為以下幾點。
3.1 器官毒性
使用連續染毒方法研究全氟辛烷磺酸鉀(potassium perfluorooctanesulfonate, PFOS-K)對小鼠腎臟的氧化性損傷作用,實驗發現,在6~24 mg·kg-1bw劑量范圍內,PFOS-K使小鼠腎臟內活性氧(R=0.990)及丙二醛(R=0.997)含量增多,谷胱甘肽(R=-0.994)含量減少,超氧化物歧化酶(R=-0.917)、谷胱甘肽過氧化物酶(R=-0.986)和過氧化氫酶(R=-0.991)活力降低[117]。PFOS-K會導致小鼠腎臟腫大,腎臟中自由基的清除能力顯著下降,造成了腎臟的抗氧化系統遭到破壞,大量積累的脂質過氧化物造成腎功能損傷[117]。血清PFCs的濃度與腎功能相關,一定濃度的PFOA能影響腎小球濾過率,影響人體內尿酸的排出[118]。臺灣225名患有哮喘的兒童血清中PFASs(包括PFOA、PFOS、PFBS、PFDA、PFHxS和PFNA)的濃度與尿酸水平升高相關[119],患有尿毒癥的青少年和成年人血清中的PFUnDA濃度比患有慢性腎衰竭的兒童高[120]。目前關于PFCs對腎臟的不良影響,雖尚未得出準確的致病機理以及致病閾值,但已有的研究結果為未來研究提供了基礎數據和資料,如不同的腎功能標志物的選取和PFCs劑量范圍的選擇。
青少年頸動脈內膜中層厚度與PFOS相關,血脂障礙的研究結果表明PFASs的暴露會對兒童心臟的代謝產生影響[121]。對小鼠進行PFOS-K經口染毒實驗,在雄性和雌性小鼠體內均能觀察到肝細胞腫大、內質網增生和肝細胞質空泡化,嗜酸性粒細胞數量增加,可導致機體更易發生相關炎癥[122]。在PFOS-K濃度達到20 mg·L-1時,小鼠體內的肝細胞腺瘤顯著增加[122]。經過28 d PFOS和PFOA的亞慢性染毒后發現,小鼠的肝臟和肺部損傷較為嚴重,表現為肝細胞腫大、肝細胞質空泡化、肺部充血和上皮壁增厚[123]。研究表明,PFOS影響肝臟的正常功能和基因表達轉錄,這與過氧化物酶體增殖激活受體(peroxisome proliferators-activated receptor, PPAR)及其下游基因表達過度上調有關[18]。PFOS已被證明能抑制大鼠肝細胞系和肝臟體外細胞間隙的連接通訊,這種作用機制也可能參與肝癌的發生。彭思遠等[124]利用基于超高效液相色譜-質譜(Ultra High Performance Liquid Chromatography-Mass Spectrometry, UPLC/MS)的代謝組學方法開展研究發現,PFOA的肝臟毒性與膽堿代謝、三羧酸循環、嘌呤代謝和核酸代謝等多個重要通路均有關聯。張紅霞等[125]采用2-DE蛋白質組學技術與ProQ Diamond dye磷酸化蛋白染色結合的方法研究PFDoA暴露對大鼠肝臟蛋白磷酸化水平的影響,發現經PFDoA處理后,30個磷酸化蛋白表達水平發生顯著變化,并成功鑒定出18個蛋白點[125]。生物信息學分析發現,這18個蛋白點主要涉及糖脂代謝、氨基酸代謝、應激防御及電子傳遞等途徑[125]。鑒于細胞內代謝途徑的多樣性和各通路相互作用的復雜性,未來還需要從轉錄組學和蛋白組學等方面對已得到的生物標志物的變化機理進行驗證和更深入的研究,以期更全面闡明PFCs產生毒性效應的作用機制。
3.2 神經毒性
動物實驗研究表明,PFOS能夠通過胎盤和血腦屏障,影響動物發育期神經系統[126]。PFCs對神經系統的作用主要包括影響細胞的生長分化、腦發育、神經突觸的形成及其可塑性、神經遞質的傳遞、離子通道的穩定,引發神經炎癥和引起神經細胞氧化應激[127]。劉嘉穎[128]采用Wistar大鼠進行不同劑量的PFOS口服染毒實驗,24 h后發現大鼠大腦皮層、海馬和小腦中谷氨酸含量明顯升高,推測谷氨酸釋放過多可導致興奮性氨基酸受體被過度激活,促使Ca2+內流造成細胞內Ca2+超載,引發自由基產生、細胞膜損傷、代謝酶被破壞、線粒體呼吸鏈中斷和神經細胞凋亡等一系列病理改變,上述反應可能在引起大鼠神經毒性的機制中起重要作用。劉曉暉等[126]總結已有研究發現,PFOS暴露能夠顯著誘導神經元Ca2+超載,進而激活其下游分子信號;還可通過誘導谷氨酸釋放,激活突觸后神經元,促使Ca2+內流和超載,引起神經毒性。PFOS暴露還能夠引起腦組織神經遞質的變化,改變神經的興奮性,引起一系列神經毒性效應[129]。
部分PFCs對人體的神經系統具有一定的毒性效應,進而對人類的行為和認知等能力產生影響。Goudarzi等[130]對6個月和18個月的兒童開展研究,發現6個月的女童心理發育指數與PFOA含量呈負相關關系,但在18個月的兒童身上則未發現此規律。研究發現母體和兒童血清PFOA含量均與相對應的智商、理論、注意力和神經心理功能測定結果有關[131]。母體血清中PFOS含量對數與較差的行為調節、元認知和全局執行功能的出現概率呈正相關關系,其他PFAS則未出現這種關聯性[132]。H?yer等[98]研究發現,母體血清中PFOA含量與多動癥及其他行為問題有正相關關系,PFOS則與多動癥相關。臍帶血PFNA濃度與兒童注意力集中程度、沖動或過度活躍和對立違抗性障礙相關[99],PFASs與外在行為和注意缺陷多動障礙的發生有潛在負相關關系[100]。
3.3 免疫和內分泌毒性
Yang等[132]早期的研究結果表明,PFOA能夠降低小鼠血清中免疫球蛋白M和免疫球蛋白G的含量,弱化B細胞和T細胞免疫功能,誘導免疫抑制,使脾細胞和胸腺細胞的數目分別減少約90%和50%,導致小鼠脾臟和胸腺萎縮。研究揭示PFOA和PFOS具有雌激素協同活性、抗甲狀腺激素活性和PPAR激活效應,這些化學物可以通過干擾機體激素的正常功能,從而對生殖、內分泌系統等產生不利影響[133]。使用PFNA對小鼠進行分子毒理實驗,發現PFNA可激活PPARα和PPARγ進而對淋巴細胞產生毒性效應,小鼠的促腎上腺皮質激素和皮質醇的血清濃度上升,同時在脾臟和胸腺中觀察到細胞周期阻滯和凋亡[134]。對小鼠進行PFCs毒理學實驗,發現PFOS主要作用位點位于B細胞,隨著PFCs含量增加,小鼠血液中白細胞、淋巴細胞、中性粒細胞(僅PFOA)和骨髓中的巨噬細胞數量下降,腫瘤壞死因子和白細胞介素6輕微上升[135-136]。
利用美國國家健康和營養檢查調查(The National Health and Nutrition Examination Suvvey, NHANES)的相關數據,對12至19歲兒童血清PFAS濃度和普遍免疫功能的指標進行研究,當血清PFOS含量增加一倍,兒童體內風疹病毒抗體和腮腺炎病毒抗體濃度分別下降13.3%和5.9%[137]。Huang等[138]的研究表明,血清PFCs、PFOS、PFUnDA、PFDoA、PFSA和PFBS的含量與心血管疾病呈現顯著正相關關系,血清PFDoA的含量與心臟與充血性心力衰竭有顯著正相關關系,PFNA和PFUnDA的含量與冠心病的發生有顯著正相關關系,PFNA含量與心臟病發作存在顯著正相關關系。葡萄糖平衡、血清蛋白和脂質譜是代謝綜合征的指標,研究發現血清中直鏈PFOA含量的增加可導致總膽固醇和血清蛋白含量的上升、β細胞功能增強及血清球蛋白下降;支鏈PFOS含量與β細胞功能呈正相關,與血清球蛋白含量呈負相關[139]。甲狀腺激素在調節生長、發育和代謝方面是必不可少的,關于韓國嬰兒的研究結果表明,與健康嬰兒相比,患有先天性甲狀腺功能減退癥的嬰兒血清中PFOA、PFNA、PFDA、PFUnDA和總PFASs水平更高[140]。雖然甲狀腺激素與PFCs之間存在關聯,但尚未有明確的致病機理和模式。Kim等[141]研究發現,PFOS的暴露與胰島素的耐受性及氧化應激反應呈正相關關系,而維生素C的補充則可以彌補PFOS對胰島素耐受性的破壞作用。由于各方面條件限制,內分泌干擾物和個人特征之間的相互作用十分復雜,較難得出PFCs和生化結果之間的具體作用機制[142]。
3.4 生殖及發育毒性
高濃度PFCs的暴露可導致男性性腺發育不良、精子數量減少、精液質量下降以及不育率上升[143-144]。PFCs的暴露會導致不育男性睪丸酮濃度比正常人低,一定濃度的PFCs暴露會使萊氏細胞(可產生睪固酮)發生增生[145]。胚胎發育毒性實驗結果表明,PFOA可導致動物早期流產、生長發育遲緩和青春期發育異常[128]。Lau等[1]在小鼠實驗中發現,當分娩期小鼠的PFOS暴露濃度達到5 mg·kg-1以上時,子代小鼠表現出無力和不活躍等癥狀,并在24 h小時內有95%以上的死亡率,當濃度低于5 mg·kg-1時,小鼠的存活率明顯增加;分別給交配前、交配期、妊娠期和哺乳期的小鼠注射一定濃度的PFOS,當注射濃度達到0.4 mg·kg-1時,子代出現行動遲緩的表現[146]。母體臍帶血中PFOA和PFOS的含量與嬰兒的出生大小和體重呈現負相關關系[147]。母體受到高濃度PFCs的暴露會延遲嬰兒的發育,母體臍帶血中PFCs含量越高,嬰兒肢體活動能力越差,暴露濃度越高,嬰兒出現畸形的幾率越高[148-149]。
PFHxS、PFOA和PFOS還可以通過胎盤實現有效的轉移[150],PFCs不僅會對直接暴露的個體產生影響,還會影響他們子代的發育和生長[140]。Lee等[93]對韓國361名2歲的兒童開展研究分析,發現兒童的身高與他們血清中PFHxS、PFOS、PFOA、PFNA和PFDA含量呈負相關關系,體重與PFNA含量呈負相關關系,PFCs的血清濃度與2歲兒童的生長參數成負相關關系。PFCs可通過妊娠和哺乳途徑轉移至子代,PFCs不僅會對胚胎產生毒性效應,還會對兒童后期肢體行為、學習能力和生殖發育產生影響。
3.5 致癌性
PFOA和PFOS會抑制谷胱甘肽過氧化物酶的活力同時誘導過氧化氫酶,使體內自由基的產生和消除失去平衡,從而造成氧化損傷,直接或間接地損害遺傳物質,引發腫瘤[29,54]。Bonefeld-Jorgense等[151]的研究表明,血液中PFCs起著類激素的作用,PFCs與激素競爭激素受體從而導致雌性激素分泌失調而引發乳腺癌。關于PFCs污染的工作環境對神經損害的調查報告顯示,工作環境中高濃度的POSF暴露會引致膀胱癌[152];還有研究表明血漿中PFOA和PFOS含量與膀胱、胰腺、前列腺或肝臟等癌癥相關聯[1,153];體外實驗研究表明,PFCs可對激素依賴性乳腺癌細胞T47D產生作用,PFOS和PFOA不具有雌激素活性,但它們能增強17β-雌二醇對雌激素應答基因表達、激活細胞外信號調節激酶ERK1/2以及影響激素剝奪T47細胞的生長[154];基于這些關于人類和動物的實驗結果,國際癌癥研究機構(IARC)將PFOA列為可能的人類致癌物(2B)[155],但是關于相應的生物毒性的具體濃度閾值國內外研究尚無確定結果。
關于PFCs的毒性研究大多集中于動物模型或體外細胞模型,近年來部分研究把人體內PFCs含量與人群流行病學研究結果進行大數據的結合分析,探究某類PFCs是否屬于人群疾病發生的特異性敏感指標,發現部分流行性疾病患者體內的PFCs含量與正常人群具有顯著性差異,但是具體致病機制仍有待進一步探索完善。目前的研究大多是針對單一化合物的毒性效應,但環境中各類PFCs以及其他具有各類毒性的環境化學污染物常常共存于自然界中,它們之間存在協同或拮抗作用,是否對機體產生更為復雜的毒性效應,這些都值得我們進一步研究。
4 健康風險評估(Health risk assessment)
人類暴露PFCs主要有3個途徑:飲食攝入、皮膚接觸和呼吸。母乳、牛奶、果蔬、肉食和海鮮等食物均檢出了不同水平的PFCs,其中肉類和海鮮是人體內PFCs的主要來源;衣物和家具等是皮膚攝入PFCs的主要來源;空氣和灰塵是呼吸攝入PFCs的主要來源。皮膚接觸和呼吸攝入這2個途徑的作用過程涉及參數過多,攝入PFCs的量難以準確考量。
挪威成年人血清中PFCs含量與他們每日攝入PFCs的量呈正相關關系,每日從魚類攝入PFOS和PFOA的量高達0.60和1.5 ng·kg-1·d-1,分別占PFCs攝入的38%和81%[106]。連續7 d對實驗參與者的食物進行取樣,并對他們血液進行分析,計算得出德國居民從飲食中攝入PFOS和PFOA的量分別為1.4和2.9 ng·kg-1·d-1。通過藥代動力學模型計算得出PFOS和PFOA日攝入量為1.60和0.5 ng·kg-1·d-1,推測德國居民體內的PFCs主要來源于日常的飲食[156-157]。Zhang等[105]研究發現,肉類是人體攝入PFOA的主要來源,幼童、青少年和成年人通過肉蛋攝食攝入PFOA的每日耐受攝入量(tolerable daily intake, TDI)分別為254~301 ng·d-1、440~540 ng·d-1和486~577 ng·d-1;海鮮產品則是攝入PFOS的主要來源(表2)。美國國家健康和營養調查使用一級藥代動力學模型研究血清中的PFOS,成年人和兒童攝入PFOS的總量高達2 200和640 ng·d-1[153]。對于成年人來說,飲食是攝入PFCs的主要途徑;對兒童來說,飲食和呼吸攝入PFOS的量是相近的[158]。Zhang等[105]的評估表明,未成年人每日通過灰塵攝入PFOS和PFOA的量分別為0.23~0.31 ng·d-1和9.68~13.4 ng·d-1,成年人的攝入量分別為0.31~13.4 ng·d-1和0.27~11.4 ng·d-1,其中幼童通過呼吸攝入PFOS和PFOA的EDI值高于成年人(表2)。
除了直接的食品攝入外,食品的外包裝和炊具等的使用也是人類攝入PFCs的途徑之一,而相關的報道還比較少。PFCs中的N-EtFOSA(N-ethyl perfluorooctane sulfonamide)、N,N-Et2FOSA(N,N-diethyl perfluorooctane sulfonamide)、N-MeFOSA(N-methyl perfluorooctane sulfonamide)和PFOSA主要用于防水和防油脂的食品包裝材料及炊具,推斷包裝材料是食品中PFCs的來源途徑之一[159]。Begley等[159]的研究表明,家庭廚房所用的炊具中PFOA的殘留在ng·g-1水平上,微波爐爆米花包裝袋的PFOA水平卻高達300 ng·g-1。在極端加熱的實驗中發現,加熱過程中,炊具本身的PFOA會不斷被釋放出來。
目前全球對PFCs的參考攝入量并沒有統一的標準值,英國食品、消費品和環境中化學品毒性委員會建議PFOS和PFOA的TDI值分別為300和3 000 ng·kg-1[127];德國衛生部飲用水委員會給出的PFOS的TDI參考值為100 ng·kg-1[157]。Fromme等[156]綜合了潛在的PFCs攝入途徑,使用模型計算得出成年人最高和平均日常攝入PFOS的量分別為1.6和8.8 ng·kg-1,PFOA為2.9和12.6 ng·kg-1。參考上述各個國家給出的標準閾值,大部分地區人群攝入PFCs的量均未超出。但是全世界各地環境介質中PFCs含量不同,人類攝食結構有一定的差異,不同年齡層和不同性別通過相同途徑攝入PFCs的量也有差異,應進行有針對性的探究。
5 PFCs的降解研究(Degradation of PFCs)
國內外關于水體中PFCs降解的方法主要有傳統的物理吸附、超聲降解、生物降解、電化學法和光化學法等。常規的水處理工藝主要是混凝-沉淀-過濾-消毒,很難將水中PFCs去除,水體中高濃度的PFCs會對人體的健康造成潛在的威脅。近年來,已有較多研究使用納米材料去除水體中的PFCs,研究機制包括物理機制(吸附和納濾)、化學機制(光化學和電化學)等。近年來越來越多的研究以紫外照射和納米材料為基礎構建不同體系,以期探究出治理水環境中PFCs的綠色高效方法。


表2 中國不同城市不同年齡段人群通過淡水魚類及海鮮產品、飲用水、肉蛋類 和灰塵攝入PFOS和PFOA的每日攝入量估計值[105,107]Table 2 Estimated daily intake (EDI) on a body weight basis of selected perfluorinated compounds via consumption of freshwater fish and seafood, drinking water, meat, egg and dust ingestion by Chinese, as stratified by sampling location and age [105,107]
注:na表示未測定。
Note: na, not available.
近年來的研究結果表明,以紫外光照射和納米材料為體系的方法對水環境中PFCs的去除效率都較為可觀,但對于反應過程具體產物的生成和相關處理方案仍需更多研究,距離實際環境及大規模應用還有較長的路要走。明確新材料去除水體環境中PFCs的作用機制及最優條件,并對它們的降解產物進行處理,是未來環保事業發展的一個新方向。
6 總結與展望(Summary and prospect)
本文主要綜述了近年來各類環境介質中PFCs的污染現狀、毒性效應、攝入風險評估及降解處理等方面的研究進展。雖然PFOS和PFOA已被禁止或限制使用,但各類環境介質及動物體內的PFCs污染仍以這2個物質為主。各類PFCs在不同的環境介質中的分配行為具有差異,短鏈PFCs在空氣中的檢出率更高,而長鏈PFCs更傾向于富集在沉積物或者土壤中。PFCs在環境中的分配行為、效率以及主要影響因素有待進一步研究。近年來,環境中短鏈PFCs的檢出率處于較高水平,甚至有些地區的PFCs污染以短鏈PFCs為主,這與短鏈PFCs被作為PFOS和PFOA的替代品大量生產使用并排放到環境中相關。短鏈PFCs的生物富集能力較弱,但它們在人體和環境介質中的降解都需要一定的時間,當它們在動物體內累積到一定濃度時,會對生態系統、動物和人類產生毒性效應。海洋食物鏈頂端的動物(魚類或鯨豚等)的臟器富集PFCs的能力比各類環境介質或者其他生物都更強,這對鯨豚動物的保育管理工作和人類海鮮攝食均有一定的警示作用。一些地區環境中部分短鏈PFCs含量呈現上升趨勢,這對當下短鏈PFCs生產和使用的管理工作有一定警示作用。
PFCs可穿過胎盤屏障和通過母乳傳遞,孕期PFCs的暴露對新生兒的出生身高及體重、肢體發育和認知行為能力等產生影響,這對備孕及懷孕女性的飲食等各方面具有一定的指示作用。近年來,研究將兒童血清、母體血清和母乳中的PFCs濃度與兒童肢體行為及認知能力等數據聯合分析,探究PFCs對嬰幼兒早期發育的影響。另外,部分研究將血清中PFCs濃度和常見疾病、生理生化參數、人類飲食及生活習慣等相結合,利用大數據統計信息試圖篩選出導致疾病發生的特異性指標,為下一步更明確的機制研究提供依據。隨著基礎數據的完善和分析技術的不斷發展,可對污染物的作用位點、通路和具體毒性效應開展更深入的研究。
近年來,越來越多關于環境介質中PFCs降解的研究在開展,其中水環境中PFCs的降解研究已初見成果,但主要限定于室內實驗條件下的研究,而非實際環境中的應用。對水環境以及其他介質環境中PFCs的降解方法、降解條件以及降解產物處理的相關應用研究,將會是未來關于PFCs污染治理的重點方向之一。

