全氟辛烷磺酸對哮喘小鼠炎癥反應的影響
曹文銳,任靜,賀妮楠,陳靜,秦小迪,董光輝,曾曉雯
廣州市環境污染與健康風險評價重點實驗室,中山大學公共衛生學院預防醫學系, 廣州 510080
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)是近年來引起科學家們關注的一種持久性有機污染物,廣泛應用于工業生產和生活用品中,如潤滑劑、織物整理劑、涂料和食品包裝材料等[1]。已有的研究表明PFOS對免疫系統、肝臟系統和腎臟系統等多器官均有毒性。哮喘是一種以慢性氣道炎癥為特征的特異性疾病,其免疫學機制主要表現在Th1/Th2細胞免疫平衡失調并以Th2型細胞免疫占優勢的免疫反應[2-3]。人群流行病學研究結果顯示,PFOS暴露與哮喘的發生、發展之間存在一定的相關性[4-5],如哮喘兒童體內的PFOS濃度與哮喘的嚴重程度、血清IgE水平呈正相關[4]。但是,PFOS對哮喘發生發展的免疫毒性機制仍未明確。有實驗研究發現,PFOS暴露可引起小鼠Th1和Th2型細胞因子及多種炎性細胞因子分泌失衡,使機體免疫功能偏向于Th2型免疫應答[6-7],此外,PFOS暴露可加重卵清蛋白(ovalbumin, OVA)致敏小鼠氣道高反應性,升高血清IgE水平,表明PFOS有促進機體發生哮喘的傾向,但不同實驗結果并不完全一致[8-9]。因此,建立哮喘小鼠模型能更有利于探討PFOS在誘導機體哮喘發展進程中的作用機理。
基于以上研究結果,本研究擬通過建立PFOS暴露的哮喘小鼠模型,從Th1/Th2炎癥反應的角度探討PFOS暴露對哮喘發展的影響。
1 實驗方法(Experimental methods)
1.1 實驗對象與分組
清潔級(SPF級)6~8周成年雄性C57BL/6J小鼠36只,購自中山大學動物實驗中心(許可證號:SCXK(粵)2011-0029),適應性飼養7 d后,將小鼠稱重編號,按隨機數字表法均分為6組,每組6只。
1.2 動物染毒及模型建立
整個實驗過程分為2個階段:
(1)第一階段為PFOS染毒:將白色粉末狀PFOS鉀鹽(純度≥98%,Sigma-Aldrich,St. Louis,MO,USA)溶于體積分數為2%的Tween-80溶液(Sigma-Aldrich, St. Louis, MO, USA)中配制成PFOS溶液。根據文獻報道,在職業人群中PFOS的血清濃度中值為10 400 ng·mL-1(82.6~31 400 ng·mL-1),普通人群中PFOS血清濃度中值為26.25 ng·mL-1(8.53~99.37 ng·mL-1)[10-11],因此參考職業人群和普通人群血清中PFOS暴露情況,我們將染毒劑量設置為0.1、1、5和10 mg·kg-1·d-1,并設置對照組及OVA單獨組。給予2% Tween-80,小鼠每天經口灌胃染毒,連續7 d,前述研究結果顯示OVA致敏模型的炎癥反應已遠高于單純PFOS染毒組的效應(數據待發表),因此,在此次7 d的短期染毒實驗中沒有再設置單純的PFOS染毒組。模型制作期間每日記錄小鼠體重及基本情況。
(2)第二階段為哮喘模型建立:從第8天開始使用OVA誘導哮喘小鼠模型(圖1),第二階段無PFOS染毒處理。對照組僅注射含5 mg Al(OH)3的100 μL PBS懸液,Al(OH)3購自Sigma-Aldrich(St. Louis, MO, USA),其余各組均在第8和14天腹腔注射OVA致敏液(50 μg OVA+5 mg Al(OH)3+100 μL PBS懸液),第22天起進行1% OVA霧化(30 min·d-1),每日一次,誘發哮喘。
染毒及模型制作期間每日觀察并記錄小鼠飼養情況如體重、飲食飲水量、體征、精神狀態及活動等。實驗過程如圖1所示。
1.3 樣本收集和臟器系數計算
胸腺、腎臟、肝臟、脾臟和肺臟采集:對小鼠進行體重稱量并記錄后,對小鼠進行頸椎脫臼處死,分離出完整的肝臟、脾臟、腎臟、肺臟及胸腺處理后,計算各臟器的臟器系數。
1.4 肺泡灌洗液(BALF)收集及有核細胞和嗜酸性粒細胞計數
(1)有核細胞總數計數:收集小鼠BALF,離心后分離細胞及上清液,上清液置于-80 ℃冰箱保存待用。細胞沉淀重懸于紅細胞裂解液中去除紅細胞,離心后重懸于200 μL PBS,細胞計數板鏡下計細胞總數。
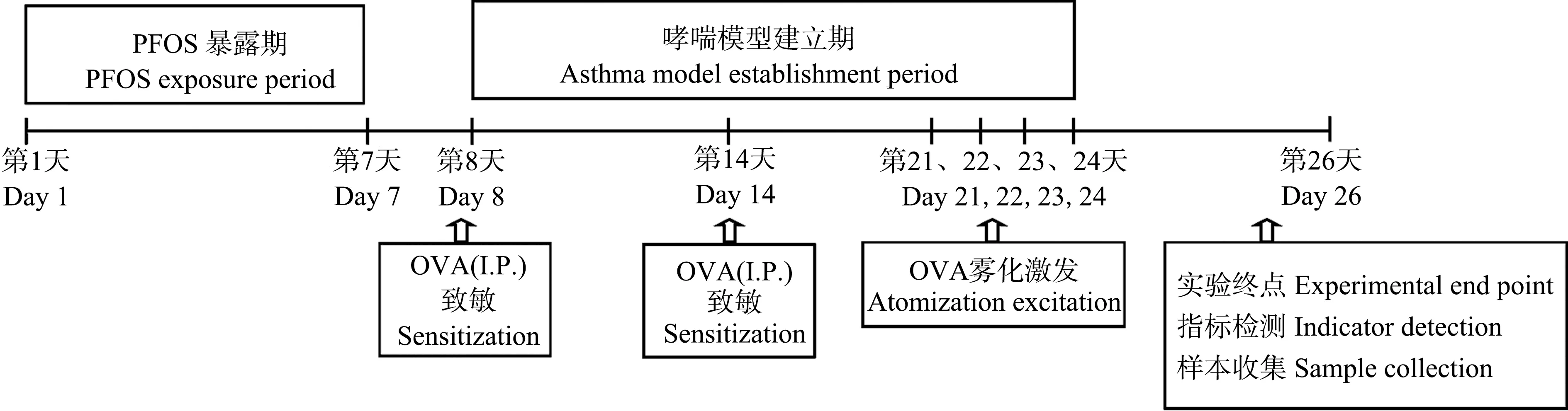
圖1 實驗流程圖注:PFOS表示全氟辛烷磺酸,OVA表示卵清蛋白,I.P.表示腹腔注射。Fig. 1 Experimental flow chart Note: PFOS stands for perfluorooctane sulfonate; OVA stands for ovalbumin; I.P. stands for intraperitoneal injection.
(2)嗜酸性粒細胞計數:將上述重懸于PBS中的細胞進行涂片,多聚甲醛固定,吉姆薩染液染色后,鏡下計數嗜酸性粒細胞,每張涂片上計數200個細胞以上,并計數嗜酸性粒細胞所占百分比。
1.5 肺組織切片及HE和PAS染色
1.6 BALF中細胞因子IL-5、IL-4和IFN-γ測定
用Luminex技術測定BALF中Th1細胞分泌的主要細胞因子IFN-γ和Th2細胞分泌的主要細胞因子IL-4、IL-5的水平。試劑盒來源于美國eBioscience公司,按照試劑盒說明書進行操作。
1.7 統計學分析
采用SAS 9.2統計軟件進行數據分析。結果用均數和標準差表示。多組間均數比較經方差齊性檢驗后采用單因素方差分析,各實驗組與對照組用Dunnett's法比較,并做整體的趨勢檢驗。
2 結果(Results)
2.1 各組小鼠體重變化和臟器系數
各組小鼠體重變化和臟器系數如表1所示,各組間體重變化、脾臟系數、肺臟系數及胸腺系數均無明顯差異。肝臟系數在10 mg·kg-1·d-1PFOS+OVA組顯著高于OVA單獨組(P<0.05),并且肝臟系數隨PFOS暴露濃度增加而上升,腎臟系數隨PFOS濃度增加而降低,上升及下降趨勢均具有統計學意義(P<0.05)。
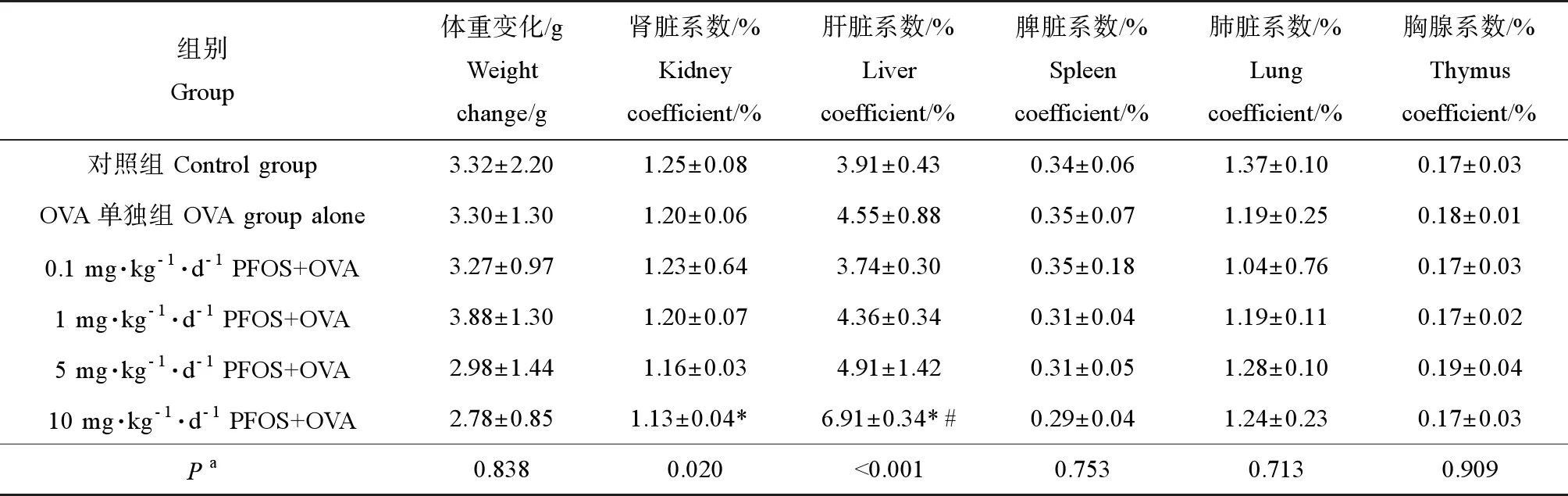
表1 各組小鼠體重變化和臟器系數Table 1 Weight change and organ coefficient of mice in each group
注:*與對照組比較(P<0.05),# 與OVA單獨組比較(P<0.05);a不同處理組間的趨勢檢驗。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.
2.2 各組小鼠BALF中的白細胞總數和嗜酸性粒細胞計數
如表2所示,10 mg·kg-1·d-1PFOS+OVA組BALF中的白細胞總數顯著高于OVA單獨組(P<0.05),其余組與OVA單獨組相比無明顯差異。隨PFOS暴露濃度的增加,嗜酸粒細胞總數呈上升趨勢,且該趨勢具有統計學意義(P<0.05)。
2.3 各組小鼠的細胞因子水平
如表3所示,10 mg·kg-1·d-1PFOS+OVA組的IL-4水平顯著高于OVA單獨組(P<0.05);10 mg·kg-1·d-1PFOS+OVA組的IL-4/IFN-γ比值顯著高于OVA單獨組;IL-4、IL-5水平和IL-4/IFN-γ、IL-5/IFN-γ比值均隨PFOS濃度的增加而增加(P<0.05),且趨勢具有統計學意義;IFN-γ水平隨PFOS濃度變化的趨勢并無統計學意義。
2.4 各組小鼠肺組織病理形態學改變
如圖2所示,與對照組相比(圖2-A),各哮喘組小鼠均可見支氣管管壁增厚,氣道粘膜、粘膜下和小血管周圍可見大量炎癥細胞浸潤,肺泡結構紊亂(圖2-B~F)。隨著PFOS染毒劑量的增加,小鼠支氣管壁明顯增厚。與單獨OVA組相比,10 mg·kg-1·d-1PFOS+OVA組小鼠氣道粘膜及粘膜下層厚度更厚,且炎癥細胞浸潤更明顯(見圖F);在圖2-G~L中可以看到,對照組小鼠氣道未見杯狀細胞增生、無明顯的黏液分泌(圖2-G),而在各模型組中小鼠氣道黏液層增厚明顯、杯狀細胞顯著增生,并且與OVA單獨組相比,氣道黏液層厚度、杯狀細胞增生情況隨染毒劑量的增加而加重(圖2-H~L)。
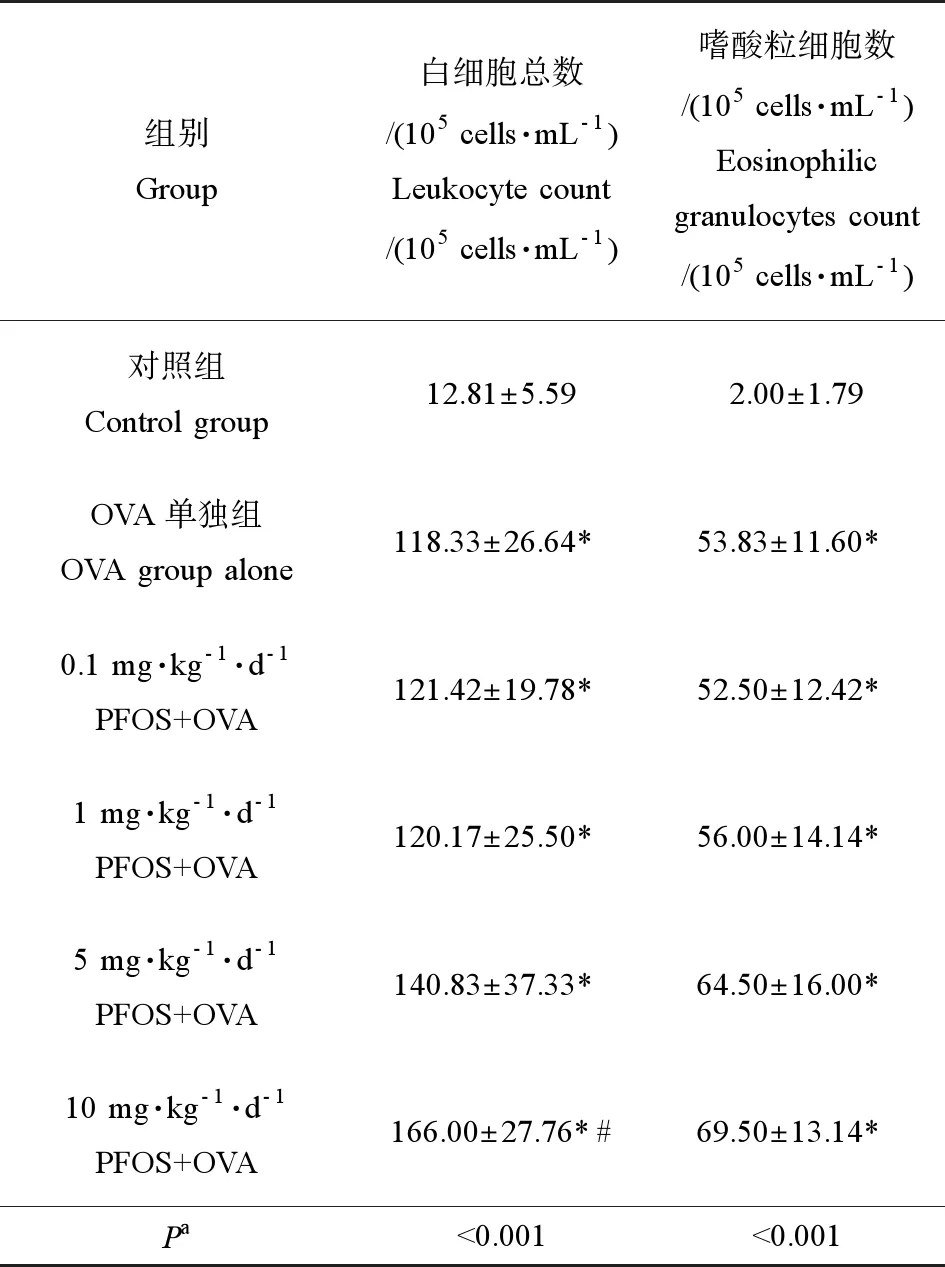
表2 各組小鼠肺泡灌洗液(BALF)中的有核細胞 總數和嗜酸性粒細胞數Table 2 The total number of nucleated cells and eosinophilic granulocytes in bronchoalveolar lavage fluid (BALF) of mice from each group
注:* 與對照組比較(P<0.05),# 與OVA單獨組比較(P<0.05);a不同處理組間的趨勢檢驗。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.
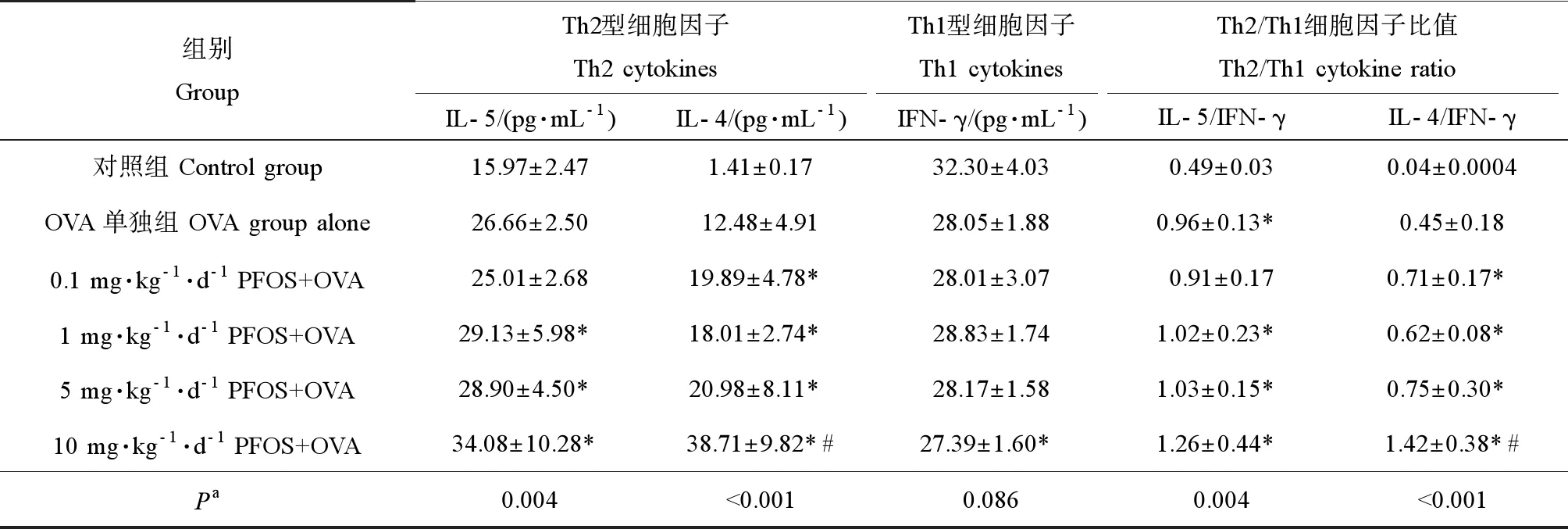
表3 各組小鼠BALF中細胞因子水平Table 3 The level of cytokines in BALF of mice from each group
注:* 與對照組比較(P<0.05),# 與OVA單獨組比較(P<0.05);a不同處理組間的趨勢檢驗。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.
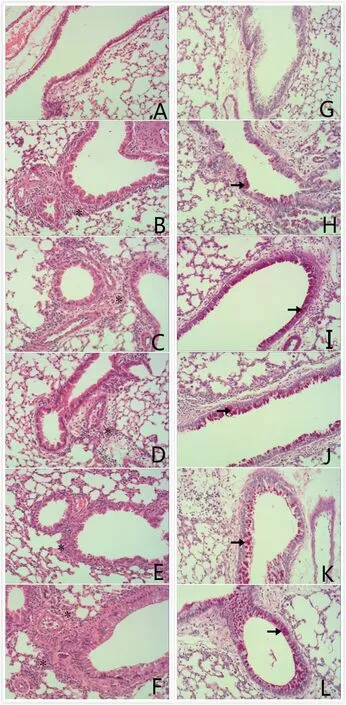
圖2 小鼠肺組織病理切片HE染色(A~F) (100×)和PAS染色(G~L)(100×)注:A、G為對照組,B、H為單獨OVA組,C、I為OVA+0.1 mg·kg-1·d-1 PFOS組,D、J為OVA+1 mg·kg-1·d-1 PFOS組,E、K為OVA+ 5 mg·kg-1·d-1 PFOS組,F、L為OVA+10 mg·kg-1·d-1 PFOS組。* 炎癥細胞,→ 杯狀上皮細胞。Fig. 2 HE staining (A-F) (100×) and PAS staining (G-L) (100×) in lung tissue pathology sections of mice Note: A, G are control group; B, H are OVA group alone; C, I are OVA +0.1 mg·kg-1·d-1 PFOS; D, J are OVA+1 mg·kg-1·d-1 PFOS; E, K are OVA+5 mg·kg-1·d-1 PFOS; F, L are OVA+10 mg·kg-1·d-1 PFOS. * inflammatory cells; → goblet epithelial cells.
3 討論(Discussion)
雖然國際上許多國家和組織如美國、加拿大和歐盟等已限制了PFOS的生產和使用,但在中國目前仍未有關于限制PFOS生產和使用的法律條文,仍在大量生產和使用PFOS,是全球主要的PFOS生產國之一[12-13]。PFOS在人體內半衰期長達5.4年,容易在人體內蓄積引起健康有害效應[14],而根據文獻報道,PFOS在我國人體內的含量仍處于較高水平[15]。已有流行病學研究報道全氟化合物暴露與哮喘患病風險具有關聯,但結論和機制并不完全一致[4-5]。Dong等[4]對臺灣哮喘兒童進行病例對照研究(哮喘組n=231,對照組n=225),結果顯示,兒童血清PFOS濃度與哮喘發生顯著正相關,血清PFOS濃度最高四分位數組的哮喘比例比最低四分位數組高163%(95%Confidence Interval (CI): 48%~369%)。哮喘兒童的哮喘相關血清生物標志物免疫球蛋白E(IgE)和嗜酸性粒細胞陽離子蛋白水平與PFOS濃度呈正相關,且隨血清PFOS濃度的增加而增高。Humblet等[5]對美國12~19歲的兒童開展了全氟化學物暴露和哮喘相關性的橫斷面研究(n=1 877),結果顯示,血清PFOS濃度與哮喘有負關聯性(odds ratios (ORs): 0.88, 95%CI: 0.74~1.04),而血清PFOA濃度與哮喘發生呈正相關(ORs: 1.18, 95%CI: 1.01~1.39)。
哮喘發生的重要免疫學機制之一是Th1/Th2細胞免疫平衡失調,以Th2細胞免疫占優勢的免疫反應在哮喘發病的整個炎癥過程以及氣道重構過程中都起著重要的作用[16]。本研究成功建立了小鼠哮喘模型,實驗結果表明,PFOS可加重哮喘小鼠肺部支氣管重塑和炎癥細胞浸潤。
細胞因子分泌水平是反映免疫細胞活化程度的重要指標之一。本實驗發現,小鼠肺泡灌洗液的IL4、IL5水平和IL5/IFN-γ、IL4/IFN-γ比值隨PFOS濃度的增加而增加,提示PFOS的暴露與機體偏向Th2型免疫應答的程度存在劑量-反應關系。在高劑量10 mg·kg-1·d-1PFOS+OVA組,小鼠肺泡灌洗液的IL4、IL4/IFN-γ顯著高于單獨OVA組,提示短期、較高劑量的PFOS暴露加劇了Th2型細胞因子的分泌,機體免疫應答可能更偏向以Th2型為主,即體液免疫,這與部分已有動物體內實驗研究結果相似[17-18]。臧珍等[17]關于全氟辛烷磺酸對4T1荷瘤小鼠免疫狀態影響的研究顯示,IFN-γ和IL4 mRNA表達水平隨PFOS濃度升高而升高,PFOS染毒可使小鼠免疫狀態向Th2型傾斜。Zhong等[18]開展了PFOS暴露影響小鼠子代內分泌功能和Th1/Th2型細胞因子平衡的研究,結果顯示,PFOS產前暴露顯著增加了雄性子代小鼠IL-4的水平,而這種Th1/Th2型細胞因子的變化可能與睪酮介導的內分泌功能有關。但本實驗結果與一些體外實驗結果不一致[19-20]。董光輝等[19]開展PFOS暴露對小鼠淋巴細胞增殖功能和細胞因子分泌水平影響的體外研究,結果表明,PFOS對體外培養小鼠脾細胞的IFN-γ、IL4細胞因子分泌水平并沒有顯著影響,可能是因為該研究為體外實驗且檢測的靶部位不同,不能反映出PFOS在體內誘導細胞因子分泌的整個過程。Soloff等[20]開展PFOS暴露對寬吻海豚T細胞活化的體外實驗研究發現,PFOS能夠誘導T細胞產生更多IFN-γ,明顯多于IL4,這可能與物種特異性以及研究對象種群的封閉性有關。因此,PFOS對機體Th1/Th2型細胞因子平衡失調的影響機制,以及在哮喘發展進程的作用通路還需更深入的研究。
此外,本研究還觀察到PFOS暴露對小鼠肝臟的影響,發現肝臟系數與PFOS染毒濃度呈正相關,提示PFOS暴露可能引起肝組織結構的異常。肝臟組織作為機體重要的免疫器官之一,有研究顯示PFOS具有肝毒性,主要通過細胞的氧化應激、線粒體依賴的細胞凋亡通路造成肝功能損傷,引起肝腫大、肝細胞空泡變性以及炎癥細胞的浸潤[21]。同時,腎臟指數與PFOS濃度呈負相關,提示PFOS也存在腎臟毒性,可引起腎損傷[22-23]。
綜上所述,本研究表明PFOS能加重哮喘小鼠肺部的炎癥反應,誘導Th2型細胞因子的表達,研究結果為進一步探討PFOS的機體免疫毒性提供初步理論依據。

