不同繁育方式對果桑光合特性和糖代謝的影響
周建華 李勇 于翠 莫榮利 朱志賢 董朝霞 胡興明 鄧文
摘要:為研究不同繁育方式對果桑光合特性和糖積累及相關酶活代謝特征的影響,選擇扦插(QC)和嫁接(JJ)2種繁育方式盆栽果桑大10,測定葉片氣體交換參數(shù)的日變化、動態(tài)變化及桑椹不同發(fā)育時期的可溶性糖含量、蔗糖代謝相關酶活性變化。結(jié)果顯示,2種繁育方式果桑凈光合速率(Pn)日變化曲線均呈雙峰曲線,有明顯光合“午休”現(xiàn)象,但QC果桑第二個峰值高于JJ果桑,蒸騰速率(Tr)日變化曲線中均為雙峰曲線,Tr最大峰值QC>JJ;表觀光能利用效率(LUE)和瞬時水分利用效率(WUE)均為QC>JJ,表觀CO2利用效率(CUE)為JJ>QC。2種繁育方式桑椹不同發(fā)育時期糖分含量存在差異,可溶性糖(Tss)含量從紅果期呈上升趨勢,糖分積累以果糖(Fru)和葡萄糖(Glc)為主,桑椹為蔗糖(Can)和己糖共同積累型果實。SS和SPS活性隨發(fā)育過程的變化類似。不同繁育方式桑椹NI活性在果實發(fā)育后期較前期活躍,光合生理參數(shù)與桑椹糖積累及蔗糖代謝相關酶活相關性分析表明,Tss、Fru、Glc均與Pn、LUE、CUE、WUE呈正相關,QC和JJ桑椹糖含量差異表明,不同繁育方式對桑椹光合同化物運輸與分配有影響。
關鍵詞:繁育;果桑;光合特性;糖代謝
中圖分類號:S663.9? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2019)16-0089-07
DOI:10.14088/j.cnki.issn0439-8114.2019.16.020? ? ? ? ? ?開放科學(資源服務)標識碼(OSID):
Abstract: In order to study the effects of different breeding methods on photosynthetic characteristics, sugar accumulation and related enzyme activities, the cuttings (QC) and grafting (JJ) were selected to breeding fruit mulberry DA10, and the gas exchange parameters of mulberry leaves were determined. Diurnal changes, dynamic changes, and soluble sugar content and sucrose metabolism-related enzyme activities in different developmental stages of mulberry. The results showed that the daily variation curves of net photosynthetic rate(Pn) in the two breeding methods showed a double-peak curve with obvious photosynthetic “noon break” phenomenon, but the second peak of QC fruit mulberry was higher than the JJ fruit mulberry peak, and the transpiration rate(Tr) daily variation curve for the bimodal curve, the maximum peak value of Tr was QC>JJ. The utilization efficiency(LUE) and the instantaneous water use efficiency(WUE) were QC>JJ, and the apparent CO2 utilization efficiency (CUE) was JJ>QC. There were differences in the content of sugar components in different developmental stages of mulberry. The content of soluble sugar(Tss) increased linearly from red fruit stage. The accumulation of sugar was mainly fructose(Fru) and glucose(Glc), which was the fruit of sucrose(Can) and hexose accumulation. SS and SPS activities were similar as changes in developmental processes. The activity of mulberry NI in different breeding methods was more active in the whole development stage than in the early stage. The correlation between photosynthetic physiological parameters and mulberry sugar accumulation and sucrose metabolism related enzyme activities showed that Tss, Fruand,Glc were were in positive correlation with Pn,LUE,CUE and WUE. The differences in the content of QC and JJ sugar indicated that different breeding methods had an impact on the transportation and distribution of mulberry light contract compound.
Key words: breeding; fruit mulberry; photosynthetic characteristics; sugar metabolism
果桑(Morus spp.)是多年生落葉果樹,喬木或灌木,為桑科桑屬植物中家桑的大果變種群。果桑果實(桑椹、桑果)為復果或多花果,果肉柔嫩多汁,營養(yǎng)豐富,是加工食品、保健品和藥品的良好原料,已被衛(wèi)生部列入“既是食品又是藥品”的名單。目前,全國果桑種植面積近6.67萬hm2,桑果產(chǎn)量超100萬t,產(chǎn)值超500億元,產(chǎn)業(yè)發(fā)展迅速。遺傳特性對植物生理生長起決定性作用,但植物種苗繁育方式有多種,有些繁育方式在后代易出現(xiàn)變異,而不能保持其品種本來的優(yōu)良特性,研究表明,不同繁育方式對植物抗性、光合、重金屬積累能力等生長特性有影響。糖是光合作用的產(chǎn)物,又是呼吸作用的底物,它為植物的生長發(fā)育提供碳骨架和能量,并能增強植物抗逆性[1]。糖的種類、含量直接影響著果實的營養(yǎng)價值、風味口感、色澤等品質(zhì)性狀,其組成成分及其含量是決定果實風味的關鍵[2]。針對不同繁育方式果桑光合特性和桑椹糖代謝的研究鮮見報道,研究不同桑苗繁育技術(shù)對果桑光合特性及糖代謝等生長特性的影響對果桑品質(zhì)調(diào)控有積極意義。
為此,選擇扦插(QC)和嫁接(JJ)2種繁育的果桑,采用LI-6400型便攜式光合系統(tǒng)對2種繁育方式果桑葉片氣體交換參數(shù)的日變化、動態(tài)變化以及不同發(fā)育時期桑椹可溶性糖(Tss)、果糖(Fru)、葡萄糖(Glc)、蔗糖(Can)、乳糖(Lac)、麥芽糖(Mal)的含量變化特征及蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)、可溶性酸性轉(zhuǎn)化酶(S-AI)和中性轉(zhuǎn)化酶(NI)活性的變化動態(tài)進行測定,研究分析不同繁育方式對果桑光合特性和桑椹糖代謝的影響,旨在為調(diào)控桑椹發(fā)育與品質(zhì)提供理論依據(jù)。
1? 材料與方法
1.1? 材料
試驗所用果桑為扦插和嫁接的無核大10。栽植方式為盆栽,基質(zhì)組成為泥炭50%、珍珠巖20%、蛭石20%和黃土10%混勻后添加緩釋肥2.5 kg/m3。每種繁育方式選樹勢和掛果量相近的9株樹,每3株作為1次重復,每一次采樣重復3次。在青果期、色變期、紅果期、初熟期和成熟期采樣。樣品采集后當日置于加冰的保鮮箱中,運回實驗室進行酶活性分析,其余經(jīng)液氮處理保存于-70 ℃冰箱內(nèi)用于其他指標測定。
1.2? 方法
1.2.1? 光合生理參數(shù)測定? 利用美國LI-COR公司生產(chǎn)的LI-6400便攜式光合測定儀測定桑樹葉片的凈光合速率(Pn)、氣孔導度(Gs)、胞間二氧化碳濃度(Ci)、蒸騰速率(Tr)。光合日變化測定時間在4月25日,葉位選擇生長勢一致的3株桑樹樣株中3個光照良好的頂部新梢,每新梢選1片功能正常葉片(5~7位葉片),測定時間為6:00~18:00,每隔2 h測定1次,每個時段重復測定3次,最后求平均值[3];光合季節(jié)變化測定時間在4月10、15、20、25、30日,5月4、9日,于8:30~10:30進行,測定葉片選擇同上;根據(jù)Penuelas等[3]的方法計算瞬時水分利用效率(WUE)、表觀CO2利用效率(CUE)、表觀光能利用效率(LUE)。
1.2.2? 糖含量測定? 分別稱取經(jīng)過(96±2) ℃干燥2 h的果糖、葡萄糖、蔗糖、麥芽糖和乳糖各1 g,加水定容至50 mL。分別移取上述溶液0.1、0.5、1.0、2.0、4.0、8.0、16.0 mL于50 mL容量瓶中并定容,建立標準曲線并得出相關系數(shù)。
樣品打碎混勻,稱取2 g于100 mL容量瓶中,加水約50 mL溶解,緩慢加入乙酸鋅溶液和亞鐵氰化鉀溶液各5 mL,加水定容至刻度,超聲30 min,用干燥濾紙過濾,棄去初濾液,后續(xù)濾液用0.45 μm微孔濾膜過濾至樣品瓶,供液相色譜(HPLC)分析。色譜條件:色譜柱為氨基柱,250.0 mm×4.6 mm,5 μm;流動相,乙腈∶水=70∶30(體積比);流速1.0 mL/min;進樣量20 μL;柱溫40 ℃;檢測器為示差折光檢測器,溫度40 ℃。采用蒽酮硫酸比色法測定果實可溶性總糖含量[4]。
1.2.3? 糖代謝相關酶活性檢測? 采用Solarbio公司生產(chǎn)的蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)、蔗糖合成酶(Sucrose synthase,SS)、中性轉(zhuǎn)化酶(Neutral invertase,NI)、可溶性酸性轉(zhuǎn)化酶(Soluble acid invertase,S-AI)試劑盒測試SPS、SS、NI、S-AI酶活性。
1.3? 數(shù)據(jù)分析
所有數(shù)據(jù)均取平均值,通過 Excel 2007軟件進行整理,其他統(tǒng)計分析均采用SPSS 19.0軟件。
2? 結(jié)果與分析
2.1? 不同繁育方式對果桑光合特性的影響
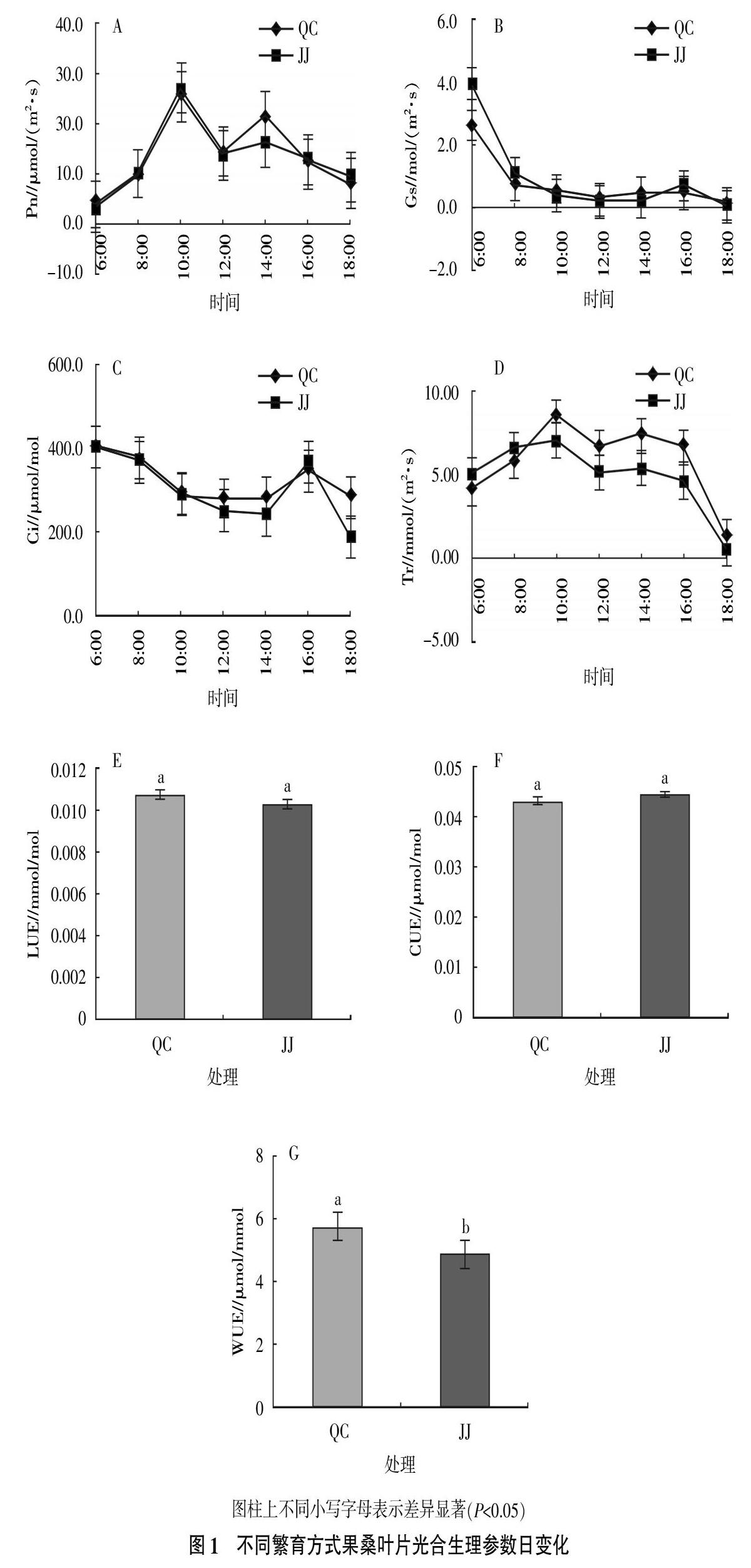
2.1.1? 不同繁育方式果桑葉片光合生理參數(shù)? 日變化凈光合速率是植物氣體交換特征中最重要的參數(shù)之一,反映植物同化CO2的能力[5]。不同繁育方式對果桑葉片光合特性的影響見圖1。在4月25日的光合日變化測定中,圖1-A表明,2種繁育方式果桑Pn日變化均呈雙峰曲線,有明顯的光合“午休”現(xiàn)象,第一個峰值均出現(xiàn)在10:00,而后隨光照度和氣溫的持續(xù)升高,大氣CO2濃度開始下降,Pn均逐漸下降,在12:00時降至低谷,而后均在14:00時出現(xiàn)第二個峰值。之后隨著光照度的逐漸減弱,Pn均逐漸下降。Pn最大峰值JJ>QC,JJ為27.17 μmol/(m2·s),QC為25.66 μmol/(m2·s),差異不顯著;Pn第二個峰值QC>JJ,JJ為16.44 μmol/(m2·s),QC為21.46 μmol/(m2·s),差異顯著。
氣孔是植物進行氣體交換的通道,氣孔導度的變化將會影響植物的光合作用和蒸騰作用[6]。2種繁育方式果桑的Gs日變化呈逐漸下降趨勢(圖1-B)。植物的光合作用與胞間CO2濃度(Ci)有直接關系。2種繁育方式果桑Ci變化趨勢類似,呈先下降后上升再下降的趨勢(圖1-C),在16:00有峰值出現(xiàn)。蒸騰作用是植物對水分吸收和運輸?shù)闹饕獎恿Γ彩侵参镂盏V質(zhì)鹽類和在體內(nèi)運輸?shù)膭恿Γ^強的蒸騰作用也會造成植物出現(xiàn)水分供應不足的情況,影響植物的生長,甚至危及生存[7]。2種繁育方式果桑Tr日變化(圖1-D)均為雙峰曲線,峰值分別出現(xiàn)在10:00和14:00。Tr最大峰值QC>JJ,QC為8.46 mmol/(m2·s),JJ為7.04 mmol/(m2·s),差異不顯著。
2種繁育方式果桑表觀光能利用效率(LUE)(圖1-E)為QC>JJ,表觀CO2利用效率(CUE)(圖1-F)為JJ>QC,但差異均不顯著。瞬時水分利用效率(WUE)(圖1-G)為QC>JJ,差異顯著。
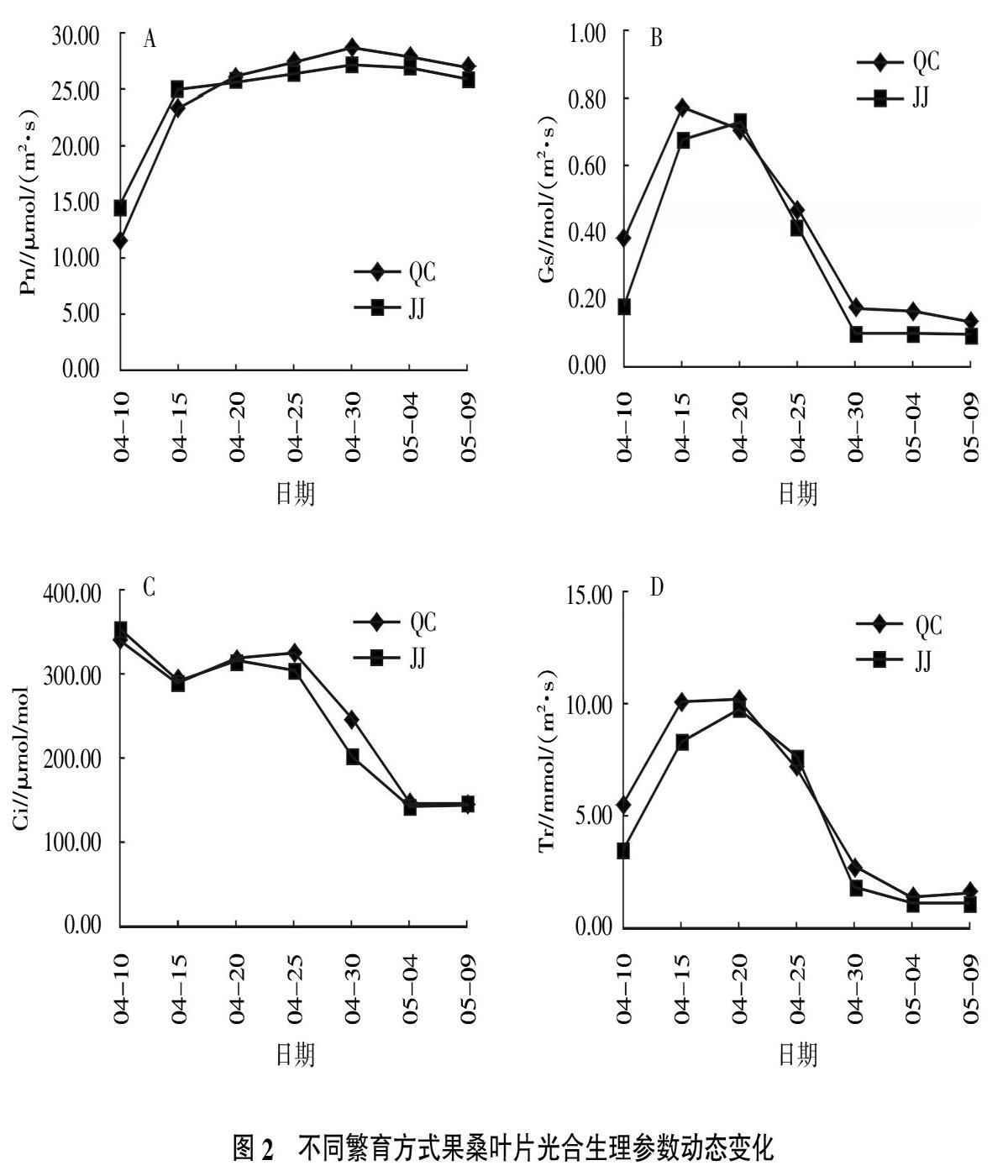
2.1.2? 不同繁育方式果桑葉片光合生理參數(shù)動態(tài)變化? 2種繁育方式果桑的光合生理參數(shù)見圖2。由圖2可知,2種繁育方式果桑的Pn、Gs、Ci、Tr季節(jié)變化趨勢基本一致,在4月25、30日,5月4、9日,QC果桑的Pn、Gs、Ci、Tr大于JJ,而4月10、15日,JJ果桑的Pn、Ci值大于QC。
2.2? 不同繁育方式對果桑桑椹糖積累的影響
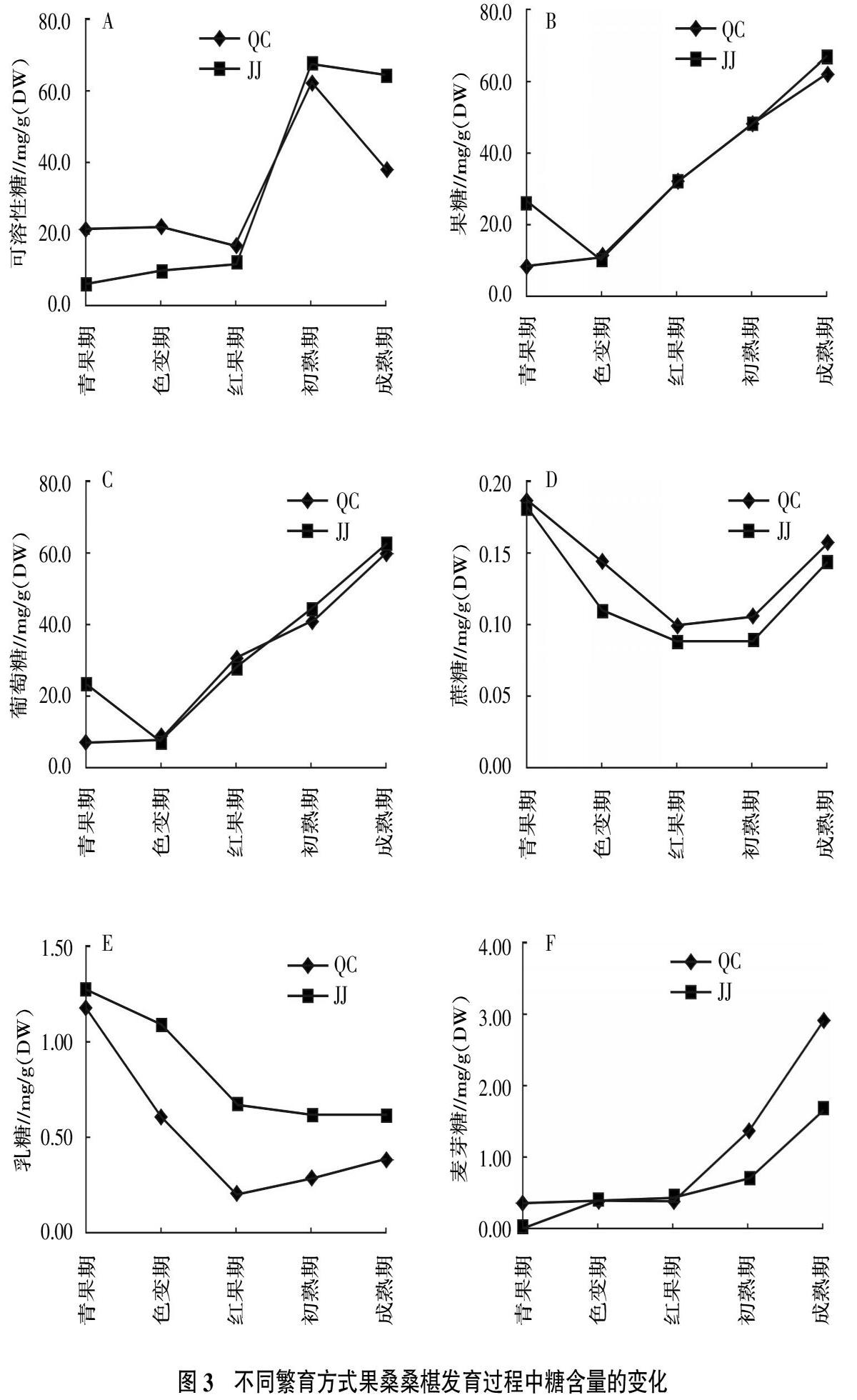
結(jié)果顯示,2種繁育方式果桑桑椹不同發(fā)育時期糖分含量存在差異,可溶性糖含量從紅果期呈上升趨勢,初熟期至成熟期有不同程度下降(圖3-A)。糖分含量中果糖和葡萄糖含量始終較高,糖分積累均以果糖和葡萄糖為主,即以積累己糖為主。由紅果期至成熟期呈快速升高趨勢,在桑椹成熟期,2種繁育方式桑椹果糖和葡萄糖含量達到最高,QC分別為62、60 mg/g(DW),JJ分別為67、63 mg/g(DW)(圖3-B、圖3-C)。2種繁育方式桑椹蔗糖變化趨勢類似,均呈“倒拋物線”變化特征(圖3-D),其中QC桑椹蔗糖含量變化始終高于JJ桑椹。2種繁育方式桑椹的乳糖在整個發(fā)育過程中均呈逐漸降低的趨勢(圖3-E),QC和JJ桑椹青果期乳糖含量分別為1.166、1.267 mg/g(DW)。隨著桑椹果實的發(fā)育,2種繁育方式桑椹的麥芽糖含量呈逐漸升高的趨勢(圖3-F),在桑椹成熟期,2種繁育方式桑椹麥芽糖含量達到最高時,QC的2.896 mg/g(DW)顯著大于JJ的1.66 mg/g(DW)。
2.3? 不同繁育方式對果桑桑椹蔗糖代謝相關酶活性的影響
隨著果桑桑椹的生長發(fā)育,QC和JJ桑椹SS活性呈逐漸升高的趨勢,于成熟期出現(xiàn)峰值,且JJ顯著大于QC,分別為10 437.5、8 781.25 U/g(FW)(圖4-A);QC和JJ桑椹SPS活性變化趨勢與SS類似,在成熟期達到峰值,分別為11 333.3、11 481.5 U/g(FW)(圖4-B),可見不同繁育方式桑椹SS和SPS活性隨發(fā)育過程的變化類似。QC和JJ桑椹S-AI活性變化趨勢各異,其中QC桑椹由紅果期上升至初熟期達到峰值1 549.6 U/g(FW),而JJ桑椹在成熟期達到峰值967.2 U/g(FW),二者峰值差異顯著(圖3-C)。QC和JJ桑椹NI活性變化各異,QC桑椹NI活性在青果期最高為393.12 U/g(FW),而JJ桑椹在成熟期達到最高為312 U/g(FW),差異顯著。由圖4-D可見,不同繁育方式桑椹NI活性變化在果實整個發(fā)育后期較前期更為活躍,這與S-AI活性表現(xiàn)相一致,可以推測在桑椹發(fā)育的后期轉(zhuǎn)化酶可能參與多條代謝途徑調(diào)控果實生長發(fā)育,從而表現(xiàn)出較高的酶活性[8-12]。
2.4? 不同繁育方式果桑光合生理參數(shù)、桑椹糖積累及蔗糖代謝相關酶活相關性分析
不同繁育方式桑椹發(fā)育過程中光合生理參數(shù)、糖積累及其蔗糖代謝酶活性之間相關性分析如表1所示。其中,桑椹Tss與SS、SPS呈顯著正相關;Fru與Glc、SS、SPS呈顯著或極顯著正相關;Glc與SS、SPS呈顯著、極顯著正相關;Can與Lac、S-AI、NI、Pn、LUE、CUE、WUE呈正相關;Lac與Ci呈正相關,與其他參數(shù)均呈負相關;Mal與SS、SPS、S-AI、NI、WUE呈顯著或極顯著正相關。以上相關性分析結(jié)果表明,桑椹發(fā)育過程中,己糖(果糖和葡萄糖)含量逐漸升高,主要原因是運輸?shù)焦麑嵵械恼崽潜晦D(zhuǎn)化酶(S-AI和NI)分解為果糖和葡萄糖。Tss、Fru、Glc均與Pn、LUE、CUE、WUE呈正相關,糖作為植物光合同化物與植物光能利用息息相關,但光合同化物的運輸分配是由若干個相互有關的生理生化過程所控制,在經(jīng)濟庫器官如果實、種子間的分配和運輸受到諸多生理過程的調(diào)節(jié),如光合效率、同化物在源葉的裝載、韌皮部長距離轉(zhuǎn)運、庫器官韌皮部的卸載及韌皮部后運輸?shù)萚13-15]。大量研究表明,在生理、分子和信號轉(zhuǎn)導水平上,光合同化物的運輸與代謝對果實糖積累發(fā)揮著越來越重要的作用[16-20]。QC和JJ桑椹糖含量差異表明,不同繁育方式對桑椹光合同化物運輸與分配有影響。
3? 討論
糖是果實品質(zhì)和風味物質(zhì)形成及其他營養(yǎng)成分合成的基礎原料[21]。研究結(jié)果表明,2種繁育方式果桑Pn日變化曲線均呈雙峰曲線,有明顯的光合“午休”現(xiàn)象,但QC果桑第2個峰值均明顯高于JJ果桑峰值,Tr日變化均為雙峰曲線,Tr最大峰值QC>JJ。2種繁育方式果桑表觀光能利用效率(LUE)和瞬時水分利用效率(WUE)均為QC>JJ,表觀CO2利用效率(CUE)為JJ>QC,表明不同繁育方式對桑樹光合特性有影響。2種繁育方式桑椹不同發(fā)育時期糖分含量存在差異,可溶性糖含量從紅果期呈直線上升趨勢,初熟期至成熟期有不同程度下降。糖分含量中果糖和葡萄糖含量始終較高,糖分積累均以果糖和葡萄糖為主,推測桑椹為蔗糖和己糖共同積累型果實。不同繁育方式桑椹SS和SPS活性隨發(fā)育過程的變化類似。不同繁育方式桑椹NI活性變化在果實整個發(fā)育后期較前期更為活躍,這與S-AI活性表現(xiàn)相一致,可以推測在桑椹發(fā)育后期轉(zhuǎn)化酶可能參與多條代謝途徑調(diào)控果實生長發(fā)育,從而表現(xiàn)出較高酶活性。在桑椹發(fā)育過程中,推測正是由于S-AI、NI活性的不斷升高,導致果桑的光合產(chǎn)物-蔗糖被不斷分解為果糖和葡萄糖。在果實發(fā)育不同階段,參與糖代謝的酶活性各異,其果實品質(zhì)的形成可能為各種酶協(xié)同作用的結(jié)果[22,23]。
光合生理參數(shù)與桑椹糖積累及蔗糖代謝相關酶活相關性分析表明,Tss、Fru、Glc均與Pn、LUE、CUE、WUE呈正相關,糖作為植物光合同化物與植物光能利用相關,但光合同化物的運輸分配是由若干個相互有關的生理生化過程所控制,在經(jīng)濟庫器官如果實、種子間的分配和運輸受到諸多生理過程的調(diào)節(jié),如光合效率、同化物在源葉的裝載、韌皮部長距離轉(zhuǎn)運、庫器官韌皮部的卸載及韌皮部后運輸?shù)萚13]。近年來,大量研究表明,在生理、分子和信號轉(zhuǎn)導水平上光合同化物的運輸與代謝對果實糖積累發(fā)揮著越來越重要的作用[16]。QC和JJ桑椹糖含量差異表明,不同繁育方式對桑椹光合同化物運輸與分配有影響。但果實中光合同化物——糖代謝是個復雜的生理生化過程,受多種因素的調(diào)控與影響[24,25]。因此,繁育方式對果桑光合同化物的運輸分配及代謝的內(nèi)在機理與調(diào)控都需要進一步研究。
參考文獻:
[1] 張上隆,陳昆松.果實品質(zhì)形成與調(diào)控的分子生理[M].北京:中國農(nóng)業(yè)出版社,2007.
[2] 鄭麗靜,聶繼云,閆? 霞.糖酸組分及其對水果風味影響研究進展[J].果樹學報,2015,32(2):1017-1023.
[3] PENUELAS J,F(xiàn)ILELLA I,LLUSIA J,et al. Comparative field study of spring and summer leaf gas exchange and photobiology of the Mediterranean trees Quercusilex and Phillyrea latifolia[J].Journal of experiment botany,1998,49(319):229-238.
[4] PRIECINA L,KARKLINA D.Composition of major organic acids in vegetables and spices[C].Czech Republic: Prague, CBU International Conference on Innovation, Technology Transfer and Education,2015.25-27.
[5] 許大全.光合作用效率[M].上海:上海科學技術(shù)出版社,2002.
[6] SAITH K,KIKUIRL M,ISHIHARA K. Relationship between leaf movement of trifoliolate compound leaf and environmental factors in the soybean canopy[J].Japanese journal crop science,1995,64:259-265.
[7] 齊書香,李清芳,馬成倉,等.6種常見綠化樹種氣體交換特征比較研究[J].天津師范大學學報,2010,30(4):50-55.
[8] ISLAM M Z,HU X M,JIN L F,et al.Genome-wide identification and expression profile analysis of citrus sucrose synthase genes:Investigation of possible roles in the regulation of sugar accumulation[J].PLoS One,2014,9(11):e113623.
[9] WORRELL A C,BRUNEAU J M,SUMMERFALT K.Expression of a marzesucrose phosphate synthase in tomato leaf carbohydrate partitiorring[J].Plant cell,1991(3):1121-1130.
[10] YU X,WANG X,F(xiàn)AN J,et al.Cloning and characterization of a sucrose phosphate synthase-encoding gene from muskmelon[J].J Amer Soc Hort,2007,132(4):557-562.
[11] COLEMAN H D,JIMMY Y,MANSFIELD S D.Sucrose synthase affects carbon partitioning to increase cellulose production and altered cell wall ultrastructure[J].PANS,2009,106(31):13118-13123.
[12] GIBSON S I.Sugar and phytohormone response pathways:Navigating a signaling network[J].Journal of experimental botany,2004,55(395):253-264.
[13] 趙智中,張上隆,徐昌杰,等.蔗糖代謝相關酶在溫州蜜柑果實糖積累中的作用[J].園藝學報,2001,28(2):112-118.
[14] ZANOR M I,OSORIO S,NUNES-NESI A,et al.RNA interference of LIN5 in tomato confirms its role in controlling brix content,uncovers the influence of sugars on the levels of fruit hormones,and demonstrates the importance of sucrose cleavage for normal fruit development and fertility[J].Plant Physiol,2009,150(3):1204-1218.
[15] 安新民,張上隆,徐昌杰,等.甜橙液泡轉(zhuǎn)化酶基因(CSVI)的分離及全序列分析[J].林業(yè)科學,2004,40(5):99-104.
[16] 秦巧平,張上隆,陳俊偉,等.溫州蜜柑果實發(fā)育期間果糖激酶與糖積累的關系[J].植物生理與分子生物學學報,2004,30(4):435-440.
[17] 張春梅.棗糖酸代謝及其馴化的分子機制研究[D].陜西楊凌:西北農(nóng)林科技大學,2016.
[18] LI M,F(xiàn)ENG F,CHENG L.Expression patterns of genes involved in sugar metabolism and accumulation during apple fruit development[J].PLoS One,2012,7(3):e33055.
[19] HACKEL A,SCHAUER N,CARRARI F,et al.Sucrose transporter LeSUT1 andLeSUT2 inhibition affects tomato fruit development in different ways[J].Plant J,2006,45(2):180-192.
[20] EOM J S,CHO J I,REINDERS A,et al.Impaired function of the tonoplast-localized sucrose transporter in rice,OsSUT2,limits the transport of vacuolar reserve sucrose and affects plant growth[J].Plant Physiol,2011,157:109-119.
[21] LI J M,ZHENG D M,LI L T,et al.Genome-wide function,evolutionary characterization and expression analysis of sugar transporter family genes in pear(Pyrusbretschneideri Rehd)[J].Plant Cell Physiol,2015,56(9):1721-1737.
[22] WEI X Y,LIU F L,CHEN C,et al.The Malus domestica sugar transporter gene family:Identifications based on genome and expression prof ling related to the accumulation of fruit sugars[J].Front Plant Sci,2014,5:569.
[23] ZHENG Q M,TANG Z,XU Q,et al.Isolation,phylogenetic relationship and expression profiling of sugar transporter genes in sweet orange(Citrus sinensis)[J].Plant Cell Tiss Org,2014, 119(3):609-624.
[24] POMPER K W,BREEN P J. Levels of apoplastic solutes in developing strawberry fruit[J].Journal of experimental botany,1995,46(288):743-752.
[25] VIOLA R,ROBERTS A G,HAUPT S,et al. Tuberization in potato involves a switch from apoplastic to symplastic phloem unloading[J].Plant cell,2001,13(2):385-398.

