淺談對硝酸銀性質認識的幾個誤區
李才猛 薛蕓蓉

摘要:硝酸銀是一種常見的中學化學試劑,但中學化學教師對硝酸銀是否溶于濃硝酸、其穩定性及對應膠體等性質的認識存在誤區。文章系統介紹和探究了硝酸銀在不同濃度硝酸溶液中的溶解性規律及一種制備硝酸銀膠體的簡便方法,從而提升對硝酸銀性質的認識。
關鍵詞:硝酸銀;溶解性;膠體;穩定性
文章編號:1008-0546(2019)08-0038-02
中圖分類號:G633.8
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2019.08.012
硝酸銀是一種無色晶體,易溶于水,氨水,微溶于無水乙醇。硝酸銀水溶液呈弱酸性,由于其含有大量銀離子,故氧化性較強,并有一定腐蝕性,醫學上用于腐蝕增生的肉芽組織,其稀溶液用于眼部感染的殺菌劑,工業上廣泛用于照相乳劑、鍍銀、制鏡、印刷、電子等工業。在中學化學中,硝酸銀溶液常被用作Cl-的檢驗試劑。然而,硝酸銀一些特殊的性質并不被中學生和中學化學教師所熟知,本文將重點介紹硝酸銀在不同濃度硝酸溶液中的溶解性規律、穩定性及一種制備硝酸銀膠體的簡便方法,從而提升對硝酸銀性質的認識。
一、硝酸銀性質誤區之一:溶解性
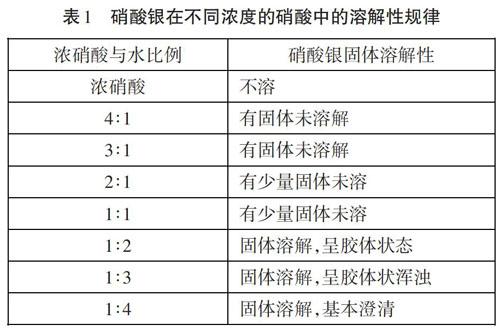
談起硝酸銀的溶解性,大家所熟悉的是易溶于水和氨水[1],但很少有人知道硝酸銀不溶于濃硝酸,為了探究硝酸銀在不同濃度的硝酸中的溶解性規律,筆者做了幾組對比實驗,其結果如下:
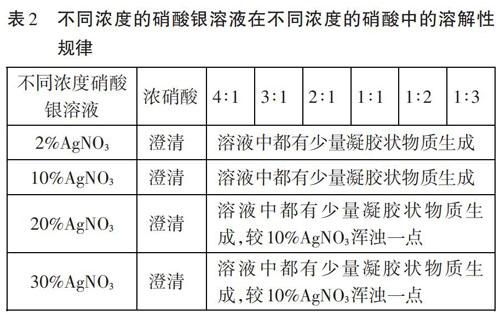
通過實驗結果發現,硝酸銀固體在濃度不同的硝酸溶液中溶解度是不同的,在濃硝酸中基本不溶,隨著硝酸濃度的減小,硝酸銀的溶解度逐漸增大。同時筆者又對比了不同濃度的硝酸銀溶液在不同濃度硝酸中的溶解性規律,實驗結果如下: 通過實驗發現一個有趣現象,不同濃度的硝酸銀溶液在濃硝酸中都是澄清的,而在其他濃度的硝酸中都呈現了不同膠狀渾濁現象[2]。根據實驗結果,筆者認為對于中學階段氯離子的檢驗實驗,檢驗試劑硝酸和硝酸銀加入的順序最好是先加硝酸銀,再加硝酸酸化,這樣可以防止硝酸銀在不同濃度硝酸中的溶解性干擾實驗,而目前很多資料書中并沒有明確區分該問題,認為兩者先后順序對氯離子的檢驗不會產生影響。
二、硝酸銀性質誤區之二:穩定性
在中學化學中,提起硝酸銀的穩定性,大家熟知的就是硝酸銀見光易分解,應保存在棕色試劑瓶中。然而,純凈的硝酸銀見光卻是穩定的[2],之所以通常硝酸銀見光不穩定是因為硝酸銀固體中混有少量雜質硝酸銅[3]。怎樣制備純凈的硝酸銀固體?筆者介紹兩種方法供大家參考,以便于在教學中及時和學生分享。硝酸銀的制法是將銀溶于硝酸,蒸發并結晶制得。因原料中含有雜質銅,從而產品中將含有硝酸銅,根據硝酸鹽熱分解溫度的差別:
2AgNO2=2Ag+2NO2↑+O2↑(713K)
2Cu(N03)2=2Cu0+4N02↑ +02↑(473K)
因此可將產品加熱到473-673K,此時Cu(N03)2分解為黑色不溶于水的Cu0。將混合物中的硝酸銀溶解后過濾除去Cu0并重結晶便可得到純的AgNO2。另一種提純方法是向含Cu2+的硝酸銀溶液中加入新沉淀純的Ag20,于是有下列兩個平衡:
Ag20(S)+H20=2AgOH=2Ag++20H-;
Cu2++20H=Cu(OH)2。
由于Cu(OH)2的溶度積比AgOH小,Cu2+大部分沉淀下來,隨著Cu(OH):的沉淀,Ag20逐漸溶解,平衡向右移動,過濾除去Cu(OH)2并重結晶,便可獲得純凈的硝酸銀。在做有關硝酸銀性質的實驗過程中,很多操作者不小心將硝酸銀粘在皮膚上,一段時間后就變黑了,這又是什么原因?其實固體硝酸銀或其溶液都是氧化劑(電極電勢(Ag+/Ag) =0.799V),即使在室溫下,許多有機物都能將它還原成黑色銀粉,這就是硝酸銀粘在皮膚上變黑的原因。
三、硝酸銀性質誤區之三:膠體狀態的硝酸銀
硝酸銀通常是以固體或溶液形式作為中學化學中的常用試劑,硝酸銀可以形成膠體嗎?筆者通過實驗找到一種制備硝酸銀膠體的簡便方法。在硝酸鋅的溶液中,滴加質量分數為2%的硝酸銀溶液,溶液很快就會形成白色膠狀物質,用激光筆照射該體系,會形成一條光亮的通路,形成明顯的丁達爾效應。實驗結果如圖1所示。
筆者也嘗試了將硝酸銀溶液加入到其它硝酸鹽溶液中,如硝酸鎂、硝酸鈣等溶液,同樣可以制得硝酸銀膠體。硝酸銀膠體為什么會在硝酸鹽的溶液中易于形成,其形成機理筆者將作為下一步探討研究內容。
參考文獻
[1]張雪芹,黃玲,張春啟,硝酸銀溶液中不溶物的定性分析[J]石化技術,2003(12):45-49
[2]孫美瓊,硝酸銀標準溶液的標定及穩定性探討[J].廣州化工,2014(4):701-703
[3]王仲均,超高純度硝酸銀制備工藝原理探討[J].影像技術,2003(1):23-26(上接第59頁)因此,我們在書寫NaBH4或LiAIH4還原醛、酮成醇的反應式時,水解或酸解一步也不可省去。高考試卷具有很高的權威性,最好能在條件中加上水解或酸解。
綜上所述,我們可以得出以下結論。(1)氫氣作為還原劑可以還原碳碳雙鍵、碳碳叁鍵、苯環、硝基、羰基及醛基,氫氣參加的有機反應必須使用催化劑。溫度、壓強、載體的不同,催化劑表現出不同的選擇性,使氫氣分別與不同的基團發生反應。(2)NaBH4或Li-AIH4主要還原含羰基的酮、醛、羧酸及酯,使它們還原為醇,但需水解或酸解,高考試卷中未出現,如添加則更科學合理。
參考文獻
[1]王祖浩.有機化學基礎[M].南京:江蘇鳳凰教育出版社,2014
[2]王祖浩.普通高中課程標準實驗教科書·化學2[M].南京:江蘇鳳凰教育出版社,2014
[3]趙海麗,姚開勝,催化還原硝基芳烴的研究現狀及發展[J].化工進展,2008:1887-1991
[4] 蔣達榮.關于氫化鋁鋰和硼氫化鈉還原醛酮成醇的反應式[J].大學化學,1997:53-54
[5]戴利,活化硼氫化鈉在有機合成中的應用[J].山東化工,2012,41(1):65-67
[6] 劉茜毓,李之俊,硼氫化鈉還原酯實驗的探討[J].山東輕工業學院學報,1996:62-63

