基于問題驅動的主題教學設計
——以“鐵的重要化合物”為例
楊創文
廣東省佛山市順德李兆基中學,廣東佛山 528300
主題教學生動,活潑,更能體現教師對課程認識的深度,知識的廣度。好的主題應當是和課程知識點緊密耦合的,主題完成同時也完成了知識點的教學,同時也推動了主題的深入。在佛山市新課標教研活動之主題教學活動期間,筆者開展了“鐵的重要化合物”主題研討課,并取得很好的教學效果。
一、主題內容分析
本節課“鐵的重要化合物”是第二節“幾種重要的金屬化合物”中的一部分。鐵是中學階段需要重點學習的唯一變價金屬元素,其化合物種類較多,實驗易于開展且現象豐富,既可以增強學生的學習興趣,又可以體現化學的思維方法——分類法,價態觀和轉化觀的運用。本節課是培養學生從宏觀和微觀相結合的視角分析與解決實際問題的能力,培養學生科學探究精神,證據推理揭示現象本質等化學學科素養的好載體。
《2017 年新版化學課程標準》在主題2 常見的無機物及其應用“內容要求”中的2.4“金屬及其化合物”提到“結合真實情境中的應用實例或通過實驗探究,了解鐵及其重要化合物的主要性質,了解這些物持在生產、生活中的應用”。“教學策略”提出“緊密聯系生產和生活實際,創設豐富多樣的真實問題情境”。同時“情境素材建議”中提到“補血劑;實驗室中硫酸亞鐵的保存與使用”。
受此啟發,本節課從“補鐵劑”進行教學情境創設,結合所學對鐵鹽進行分類,通過實驗掌握Fe3+檢驗方法。由久置FeSO4溶液與KSCN 反應產生紅色實驗現象引發認知沖突。對于異常相象,學會設計實驗進行初步驗證,并能分析、解釋有關實驗現象。從微粒觀、氧化還原觀分析實驗現象,層層設問,以掌握“Fe2+與Fe3+相互轉化關系”。采用點滴板制備Fe(OH)2微型實驗,讓學生進一步體會Fe2+的還原性,進而有利于開展制備相對較純的Fe(OH)2實驗的設計。在實驗探究過程中,進一步落實對學生“宏觀辨識與微觀探析”“變化觀念”、“證據推理”、“科學探究”等核心素養的培養。
二、學生情況分析
在知識上,學生已經有了物質的分類、氧化還原反應原理等相關知識,對于鐵及其化合的了初步的認識,特別是學習完了鐵的化學性質,掌握了鐵與弱氧化劑(S)反應得到+2 價化合物(FeS),鐵與強氧化劑(Cl2)反應得到+3 價的化合物(FeCl3);在能力上,初步具備觀察、實驗、思維能力。但由于學生剛剛開始元素化合物的學習,對氧化還原知識尚不能熟練運用,對常見的氧化劑和還原劑并不熟悉,加上實驗能力有限,導致他們在實驗探究Fe2+與Fe3+的相互轉化時會遇到困難,需要在教師的引導下開展探究活動。
三、教學目標
1.通過實驗了解Fe3+的檢驗方法,探究Fe2+與Fe3+轉化方法,初步形成物質及其轉化思路的認識水平。
2.通過探究Fe2+與Fe3+轉化深化對氧化還原的理解及運用,發展學生對物質性質與物質用途的關聯。
3.了解補鐵劑使用,感受生活中的化學,體會化學與生活的密切聯系。初步形成解決實際問題的能力及其對化學價值的認識水平。
4.通過調節溶液酸堿性實現同價態鐵元素各類物質的轉化,初步學會從微粒觀的角度分析化學現象。
四、教學重難點分析
1.從氧化還原維度分析Fe2+與Fe3+相互轉化關系,掌握不同價態含鐵元素微粒的轉化
2.從溶液酸堿性維度分析Fe2+與Fe(OH)2、Fe3+與Fe(OH)3相互轉化關系,掌握同價態含鐵元素微粒的轉化
五、教學流程
環節1:情境引入
【引入】小視頻創設問題情境:貧血是怎么回事?缺鐵性貧血要補的是什么形態的鐵?
【過渡】FeSO4是常見的補鐵劑
【提出新問題】除了FeSO4你還認識哪些鐵鹽?
展示常見鐵鹽溶液圖片。面對眾多鐵鹽,我們能否將其進行分類研究?

【學生活動】
從溶液顏色進行分類:Fe2+淺綠色、Fe3+黃色
從化合價進行分類:+2 價亞鐵鹽、+3 價鐵鹽
學生分組實驗1:
分別取2ml 含Fe2+、Fe3+溶液于試管中,觀察溶液顏色。
【追問】有沒有更具針對性區分這兩種溶液的方法呢?
學生分組實驗2:分別取2ml 含Fe2+、Fe3+溶液于試管中,分別向試管中滴加2-3 滴KSCN 溶液,觀察并匯報實驗現象。
板書:一、Fe3+檢驗
Fe3+遇到KSCN 溶液顯紅色,Fe2+遇到KSCN 溶液無明顯現象
環節2 由實驗異常現象引發探究,突破Fe2+與Fe3+相互轉化
【演示實驗】向久置FeSO4 溶液滴加幾滴KSCN,發現溶液顏色變紅。

【教學設計意圖】層層設問,引導思考,在問題解決過程中形成自己解題的思維模型。
板書:二、Fe2+與Fe3+相互轉化
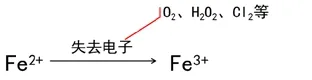
【逆向提問】變質了的FeSO4溶液還能用嗎?有沒有辦法讓它復原?

【教學設計意圖】學生應用剛建立的思維模型解決相似問題,再次應用,學生體會更深刻。
板書:二、Fe2+與Fe3+相互轉化

【能力提升】展示緩釋FeSO4片使用說明書,讓學生解釋:
1.補鐵藥片包衣膜的作用
2.補鐵藥片與Vc 同服有利鐵的吸收,Vc 的作用?
【學以致用】運用所學解決日常生活中的化學問題
環節3Fe(OH)3、Fe(OH)2制備與性質
【過渡】除了用KSCN可以區分Fe3+和Fe2+外,還有沒有其他方法?可能會出現什么現象?寫出相關反應方程。
【學生活動】
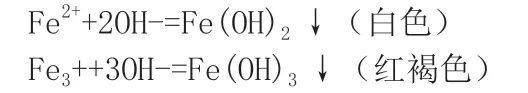
分組實驗3
(1)取6 滴Fe2(SO4)3 于點滴板上,滴加3 滴NaOH 溶液,觀察并記錄現象。
(2)取6 滴FeSO4 于點滴板上,滴加3 滴NaOH 溶液,觀察并記錄現象。
【異常現象引發新思考】對于實驗2,為什么點滴板上得到的是灰綠色的沉淀,該沉淀是什么?如何證明?
【教學設計意圖】異象現象引發認知識新沖突。利用剛學知識解決新問題。
【拓展1】得到純凈的Fe(OH)2要注意哪些問題?請設計實驗驗證你的猜想。
【拓展2】Fe3O4溶于稀鹽酸,請設計實驗驗證溶液中存在Fe3+和Fe2+
【歸納總結】
板書:

【教學設計意圖】通過價類二維圖把所學知識系統化,有助于學生形成科學的研究方法。
六、教后反思
1.整個教學圍繞著“宏觀辨析與微觀探析”、“證據推理與模型認知”兩個核心素養設計,圍繞FeSO4展開,教學過程沒刻意講解FeSO4知識,而是結合預設的問題展開,這樣做更能激發學生不斷探究的意愿。如,導入小視頻介紹的FeSO4 用途,結合實驗,解決久置的FeSO4溶液存在Fe3+離子原因,提出如何保存FeSO4溶液,通過問題串,學生的積極性很快就被調動起來,體現了“宏觀辨析與微觀探析”核心素養。在解決問題的過程中自然就掌握了相關知識。所以主題與核心知識的貫穿關鍵在于問題串的設計。
2.動手實驗是培養學生科學精神的重要手段,有目的、有引導地觀察實驗現象,并思考實驗所帶來的種種問題,才能培養“證據推理與模型認知”素養,突顯教師主導學生主體作用。關于Fe2+與Fe3+相互轉化,設計實驗和動手實驗,幫助學生建構轉化模型認知。運用實驗,驗證設想,成功的體驗結人成就感。
巧妙設計實驗異常現象激發學生實驗探究欲。久置的FeSO4溶液滴加KSCN 出現血紅色,新制FeSO4溶液滴加NaOH 得到白色沉淀很快變成灰綠色,最后變成紅褐色,利用這些與預想的不一樣的實驗現象,引發深度思考,及時進行實驗驗證,實驗中體會化學的魅力。
3.知識生活化,把所學轉化為解決問題的工具。例如,掌握了Fe2+容易被氧化成Fe3+知識后,就可解決補鐵劑在使用和保存中的事項。

