2016~2018年鮑曼不動桿菌臨床分離株的分布特征及耐藥性變遷
常琪 魏韻佳 穆琪 余建華
摘要:目的? 了解鮑曼不動桿菌在我院的分布特征及耐藥性變遷,為臨床合理選用抗菌藥物提供依據。方法? 采用珠海迪爾DL-96Ⅱ微生物分析儀進行細菌鑒定與藥敏試驗,對我院2016年1月~2018年12月臨床各類標本中分離出的鮑曼不動桿菌的分布特征及耐藥情況進行分析。結果? 分離出551株鮑曼不動桿菌,年分離率相對穩定,但多重耐藥鮑曼不動桿菌構成比上升明顯,從67.28%上升到了82.21%。鮑曼不動桿菌主要分離自痰及咽拭子標本,占67.69%;感染主要發生在ICU病房、呼吸科和神經內科,其次為內分泌科和老干科。臨床常用13種抗菌藥物的耐藥率與2016年比較,多種抗菌藥物耐藥率上升顯著;2018年與2017年比較,耐藥情況控制較好,其中米諾環素和多粘菌素B耐藥率最低,分別為14.90%和16.35%;其余耐藥率均大于55%。結論? 鮑曼不動桿菌在我院耐藥情況比較嚴重,對多種抗菌藥物耐藥率都達到了較高水平,臨床應根據藥敏結果和臨床實際合理選用抗菌藥物。
關鍵詞:鮑曼不動桿菌;抗菌藥物;耐藥率
中圖分類號:R446.5? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? DOI:10.3969/j.issn.1006-1959.2019.16.038
文章編號:1006-1959(2019)16-0119-03
Abstract:Objective? To understand the distribution characteristics and drug resistance changes of Acinetobacter baumannii in our hospital, and to provide a basis for clinical rational selection of antimicrobial agents.Methods? The Zhuhai Deere DL-96Ⅱ microbiological analyzer was used for bacterial identification and drug susceptibility test. Analyzing the distribution characteristics and drug resistance of Acinetobacter baumannii isolated from various clinical specimens from January 2016 to December 2018 in our hospital.Results? A total of 551 strains of Acinetobacter baumannii were isolated. The annual isolation rate was relatively stable, but the composition ratio of multi-drug resistant Acinetobacter baumannii increased significantly from 67.28% to 82.21%. Acinetobacter baumannii is mainly isolated from sputum and throat swab specimens, accounting for 67.69%; infection mainly occurs in ICU wards, respiratory and neurology, followed by endocrinology and cadaver. Compared with 2016, the resistance rate of 13 kinds of antibiotics commonly used in clinical practice increased significantly. The resistance rate of various antibiotics increased significantly. Compared with 2017, resistance was better controlled, among which minocycline and polymyxin B The drug resistance rate was the lowest, 14.90% and 16.35%, respectively; the remaining drug resistance rates were all greater than 55%.Conclusion? The resistance of Acinetobacter baumannii in our hospital is quite serious, and the resistance rate to various antibiotics has reached a high level. The clinical application of antibiotics should be based on the results of drug susceptibility and clinical practice.
Key words:Acinetobacter baumannii;Antibacterial drugs;Drug resistance rate
鮑曼不動桿菌(Acinetobacter baumannii,AB)廣泛存在于自然界、醫院環境及人體皮膚表面,是引起院內感染最重要的條件致病菌之一。該菌常引起醫院獲得性肺炎、中樞神經系統感染、泌尿系統感染、血流感染及腹腔感染等[1],對危重患者和免疫力低下患者威脅很大,極易造成流行。隨著廣譜抗生素的廣泛使用,其耐藥性也日益提高,多重耐藥甚至是泛耐藥鮑曼不動桿菌已在世界各地出現和流行,其臨床感染預防和治療十分棘手。為此對我院2016年1月~2018年12月臨床各類標本中分離出的鮑曼不動桿菌的分布與耐藥情況進行分析,為臨床科學合理選用抗菌藥物提供參考。
1材料與方法
1.1菌株來源? 551株鮑曼不動桿菌(除外同一患者同類標本1周內重復結果)來自2016年1月~2018年12月東部戰區空軍醫院臨床送檢的各類標本。
1.2方法? 采用珠海迪爾DL-96Ⅱ微生物分析儀進行細菌鑒定和藥敏試驗,按照臨床實驗室標準化協會(CLSI)2010年版推薦的標準判斷藥敏試驗結果。
1.3質控菌株? 大腸桿菌(ATCC 25922),銅綠假單胞菌(ATCC 27853)購自江蘇省臨檢中心。
1.4統計學處理? 采用SPSS 22.0統計軟件對所收集的數據進行統計學分析,計數資料以(%)表示,行?字2檢驗,以P<0.05為差異有統計學意義。
2結果
2.1鮑曼不動桿菌分離情況? 本院鮑曼不動桿菌的年分離率保持相對穩定,呈緩慢上升趨勢,但多重耐藥鮑曼不動桿菌的構成比上升明顯,見表1。
2.2鮑曼不動桿菌的標本分布? 分離出551株鮑曼不動桿菌,其中痰及咽拭子標本分布率最高,有373株,占67.69%;其次為分泌物標本,有101株,占18.33%;其余標本所占比例較小,見表2。
2.3鮑曼不動桿菌的病區分布? 分離出的551株鮑曼不動桿菌在病區主要分布情況:ICU病房141株、呼吸科140株、神經內科104株、內分泌科和老干科分別為64株和37株,其他科室合計65株,見表3。
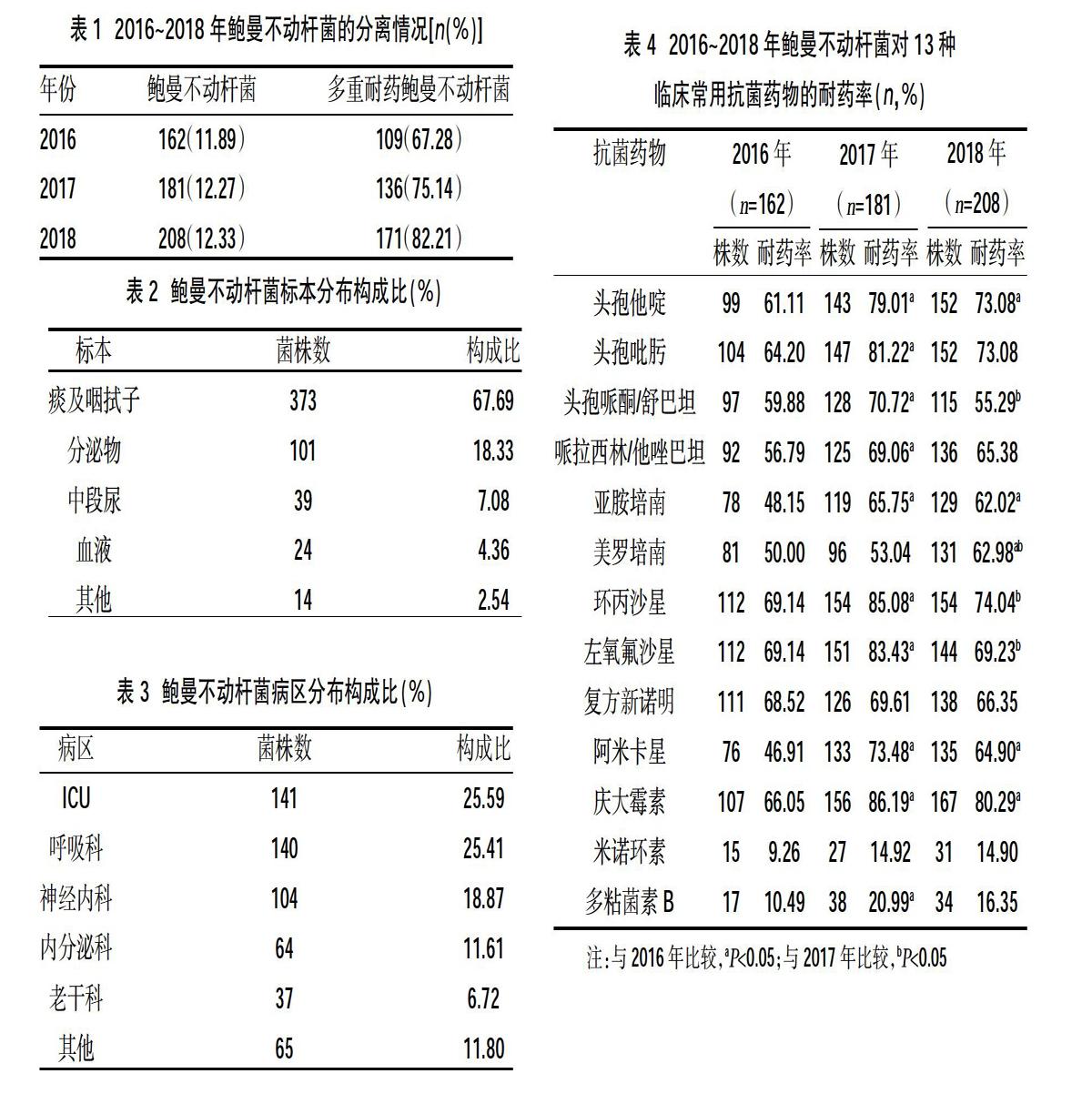
2.4鮑曼不動桿菌對13種臨床常用抗菌藥物的耐藥情況? 臨床常用13種抗菌藥物的耐藥率與2016年比較,多種抗菌藥物耐藥率上升顯著;2018年與2017年比較,耐藥情況控制較好,其中米諾環素和多粘菌素B耐藥率最低,分別為14.90%和16.35%;其余耐藥率均大于55%,見表4。
3討論
鮑曼不動桿菌具有在體外長期存活的能力,已成為臨床重要致病菌[2],可引起多部位多器官的感染性疾病,臨床感染頻繁。鮑曼不動桿菌基因組研究發現其具有強大的獲得耐藥性和克隆傳播的能力,多重耐藥、廣泛耐藥、全耐藥鮑曼不動桿菌已成為全球抗感染領域的挑戰,更是目前我國最重要的“超級細菌”[3],臨床上可供選擇的有效抗菌藥物甚少。加強鮑曼不動桿菌的耐藥性監測,了解其耐藥性變化趨勢對有效治療和預防該菌感染非常重要。
本院2016~2018年各類標本中分離出的鮑曼不動桿菌共有551株,年分離率保持相對穩定,呈緩慢上升趨勢,但是多重耐藥鮑曼不動桿菌的構成比卻上升顯著,從67.28%上升到了82.21%,這提示該菌引起的感染治療難度不斷增加,臨床在經驗用藥時要慎重考慮,不斷探索和積累臨床治療經驗。鮑曼不動桿菌主要從痰及咽拭子和傷口分泌物標本中分離出來,分別占67.69%和18.33%,表明呼吸道、外傷和手術傷口為醫院感染的高發部位,應注意預防與控制以上部位發生醫院感染。鮑曼不動桿菌感染的高發病區為ICU、呼吸科和神經內科,這些病區患者多為危重患者,普遍存在長期住院、接受機械通氣、侵入性操作、免疫力低下、嚴重基礎疾病以及長期大量使用廣譜抗菌藥物等情況;我院內分泌科為軍區糖尿病足中心,收治多為糖尿病足三級以上患者,該科標本中鮑曼不動桿菌的檢出率也較高;這些病區患者均應視為醫院感染的高危人群。當然該菌存在于呼吸道中可以是寄居菌,也可以是感染病原,應注意區別。一旦確定為感染,應迅速采取措施,嚴格消毒隔離,采取有效的抗感染措施加以控制,否則病原一旦擴散,極易造成醫院感染的暴發流行,給臨床感染的治療帶來嚴峻挑戰。
本研究顯示,2016年鮑曼不動桿菌對臨床常用13種抗菌藥物除米諾環素和多粘菌素B外,耐藥率均達到了較高水平,臨床可用的抗菌藥物選擇已非常有限。與2016年相比,2017年多種抗菌藥物耐藥率上升顯著(P<0.05)。2018年與2017年比較,耐藥情況控制有好轉,頭孢哌酮/舒巴坦、環丙沙星和左氧氟沙星耐藥率下降明顯(P<0.05),這與臨床用藥選擇有關,也與醫院加強臨床合理用藥的管理和指導密不可分;其中米諾環素和多粘菌素B這兩種藥物體外抗菌活性強,同時在我院使用率不高,抗生素選擇壓力相對較低,耐藥率也低,分別為14.90%和16.35%,但高于國內相關文獻報道[4,5],這可能與各地醫院用藥習慣不同有關;其余抗菌藥物耐藥率均大于55%。臨床常用抗菌藥物的耐藥率普遍超過50%與鮑曼不動桿菌存在復雜多樣的耐藥機制有關,目前已經報道的主要耐藥機制[6,7]有產β-內酰胺酶、產氨基糖苷修飾酶、下調青霉素結合蛋白(β-內酰胺類耐藥)、DNA回旋酶和拓撲異構酶Ⅳ(氟喹諾酮類耐藥)、滲透性缺陷、多藥外排系統、四環素類核糖體保護蛋白(TetM)、二氫葉酸還原酶(folA)、雙組分調節器 (pmrA/B)的突變(多粘菌素類耐藥)等。
本研究中,臨床最常用的頭孢哌酮/舒巴坦、亞胺培南和美羅培南目前耐藥率分別高達55.29%、62.02%和62.98%。鮑曼不動桿菌針對這類藥物的耐藥機制主要是產生內酰胺酶水解或破壞內酰胺環失活藥物。耐碳青霉烯類的鮑曼不動桿菌(carbapenem-resistant AB,CRAB)是國際社會討論的熱點話題之一[8],因為一旦對亞胺培南耐藥,就意味著對現有多種抗菌藥物耐藥。碳青霉烯類耐藥最常見的酶模式就是D類酶中blaOXA-23、blaOXA-40和blaOXA-58-like基因譜系編碼的OXA類產物,它們可能位于質粒或染色體,克拉維酸并不能抑制酶的活性[9]。另外,D類碳青霉烯酶對碳青霉烯類抗生素的水解活性較低,對其耐藥性的介導常合并外膜通透性的降低和(或)外排泵的激活。在鮑曼不動桿菌中還發現了B類金屬碳青霉烯酶中的VIM、IMP和SIM型,多見于拉丁美洲和亞洲太平洋地區[10]。這些酶使得菌株對碳青霉烯類和除氨曲南之外的其他β-內酰胺類抗生素高水平耐藥,且發現與復雜的Ⅰ類整合子有關。此外,大范圍的A類超廣譜β-內酰胺酶,包括TEM、SHV、CTX-M、GES、SCO、PER和VEB家族,都在研究鮑曼不動桿菌的過程中發現過,并且已經確定對超廣譜頭孢菌素類的耐藥是由于這些酶的產生,而非AmpC的上調作用[11]。
鮑曼不動桿菌為多重耐藥菌的典型代表,臨床上對于敏感的鮑曼不動桿菌,根據藥敏試驗結果選擇單一有效的抗生素治療就足夠,但對于多重耐藥株常需要聯合治療,國內目前多采用以頭孢哌酮/舒巴坦為基礎的聯合方案如頭孢哌酮/舒巴坦+多西環素(靜滴)/米諾環素(口服);另外含碳青霉烯類抗生素的聯合方案主要用于同時合并多重耐藥腸桿菌科細菌感染的患者[12]。聯合治療應考慮影響抗生素治療效果的各種因素,綜合確定治療方案,既要保證有效的抗感染治療,又要阻止多重耐藥的進一步發展,減少抗菌藥物引起的不良反應。
綜上所述,鮑曼不動桿菌耐藥機制十分復雜,常為多種耐藥機制并存,在我院耐藥情況比較嚴重,對多種抗菌藥物耐藥率都達到了較高水平,臨床上應重視藥敏試驗結果,充分考慮其耐藥機制,結合臨床實際合理選用抗菌藥物。同時,加強鮑曼不動桿菌的耐藥性監測,積極開展耐藥鮑曼不動桿菌的流行病學調查,嚴格遵守無菌操作和感染控制規范,加強抗菌藥物臨床管理,是延緩和減少多重耐藥鮑曼不動桿菌的產生和傳播,以及預防與控制該菌引起醫院感染的關鍵。
參考文獻:
[1]周華,周建英,俞云松.中國鮑曼不動桿菌感染診治與防控專家共識解讀[J].中國循證醫學雜志,2016,16(1):26-29.
[2]Perez F,Hujer AM,Hujer KM,et al.Global challenge of multidrug-resistant Acinetobacter baumannii[J].Antimicrob Agents Chemother,2007,51(10):3471-3484.
[3]俞云松.多重耐藥鮑曼不動桿菌——21世紀革蘭陰性菌的“mrsa”[J].中華臨床感染病雜志,2009,2(2):65-68.
[4]賀毅,吳偉元,陸堅,等.替加環素、米諾環素、多黏菌素B對碳青霉烯類敏感性降低和不敏感鮑曼不動桿菌體外抗菌活性[J].中國感染與化療雜志,2014,14(1):42-46.
[5]劉東華,胡艷華,王少敏.285例鮑曼不動桿菌對米諾環素體外藥敏分析[J].國際檢驗醫學雜志,2015,36(13):1954-1955.
[6]周玉,叢玉隆,曲芬.鮑曼不動桿菌耐藥機制及治療策略研究進展[J].傳染病信息,2014,27(3):184-188.
[7]Gordon NC,Wareham DW.Multidrug-resistant Acinetobacter baumannii:mechanisms of virulence and resistance[J].Intern J Antimicrob Agents,2010,35(3):219-226.
[8]Mammina C,Palma DM,Bonura C.Epidemiology and clonality of carbapenem-resistant Acinetobacter baumannii from an intensive care unit in Palermo,Italy[J].BMC Research Notes,2012(5):365.
[9]Poirel L,Nordmann P.Carbapenem resistance in Acinetobacter baumannii:mechanisms and epidemiology[J].Clin Microbiol Infect,2006,12(9):826-836.
[10]Fritsche TR,Sader HS,Toleman MA,et al.Emerging metallo-beta-lactamase-mediated resistances:a summary report from the worldwide SENTRY antimicrobial surveillance program[J].Clin Infect Dis,2005,41(Suppl 4):S276-S278.
[11]Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[12]陳佰義,何禮賢,胡必杰,等.中國鮑曼不動桿菌感染診治與防控專家共識[J].中國醫藥科學,2012,2(8):3-8.
收稿日期:2019-4-2;修回日期:2019-4-19
編輯/楊倩

