電針抑制大鼠脊髓損傷后小膠質細胞活化介導炎癥的機制研究
范筱,劉宇,鄭鵬,張英羽
(1.青島市市立醫院,青島 266011;2.福建中醫藥大學,福州 350122;3.青島市西海岸新區中醫醫院,青島266500)
脊髓損傷(spinal cord injury, SCI)是醫學領域的世界性難題,其病理過程主要包括原發性脊髓損傷階段和繼發性脊髓損傷階段[1]。炎癥在 SCI 的病理反應中扮演重要角色。持續高水平炎癥導致損傷處組織發生炎性浸潤、血管通透性改變、損傷區域擴大、血小板凝集能力改變等引起組織水腫、缺血、細胞壞死和凋亡等不利于損傷修復的結果。小膠質細胞(microglia, MG)是神經系統固有免疫細胞,被認為是損傷后炎癥的發動者和調控者。在生理狀態下,MG 處于靜止狀態[2],對神經系統有重要的支持和營養作用。一旦損傷發生,受損組織和細胞會釋放大量三磷酸腺苷(adenosine triphosphate, ATP)。ATP 作為 MG 的天然激動劑,可使MG 活化而發生極化,MG 的形態及功能發生改變而參與介導炎癥。隨著損傷持續和加劇,MG被過度激化,引起白細胞介素 1β(Interleukin-1β,IL-1β)和白細胞介素 18(Interleukin-18, IL-18)等大量炎性因子釋放,高濃度的炎性因子進一步加重損傷,形成惡性循環[3]。臨床實踐中,電針已廣泛應用于治療脊髓損傷,對脊髓損傷引起的運動功能障礙、感覺功能障礙以及尿潴留等并發癥均具有良好的治療效果,可有效緩解SCI 后出現的中樞性疼痛、腸道功能障礙以及肌肉痙攣等情況[4];并且電針可有效降低SCI大鼠脊髓損傷處促炎性因子表達水平,抑制炎癥[5]。但是,電針抑制SCI 后炎癥的深入作用機制尚不明確。本研究旨在研究電針是否通過抑制 MG 活化介導的炎癥而有利于 SCI 后神經元修復,進一步明確電針治療 SCI的作用機制,為其臨床應用提供理論依據和基礎。
1 材料與方法
1.1 實驗動物及分組
36 只 2 月齡 SPF 級 Sprague-Dawley 大鼠(雌雄各半),體重(220±20)g,購于上海斯萊克實驗動物責任有限公司,許可證號[SCXK(滬)2014-0006],飼養于福建中醫藥大學實驗動物中心。實驗過程及方法符合福建中醫藥大學實驗動物倫理委員會要求。采用隨機數字表法將上述大鼠隨機分為假手術組、模型組和電針組,每組12 只。
1.2 主要試劑及儀器
一抗,山羊抗 IBA-1 抗體(Abcam,美國)、小鼠抗ED-1 抗體(Abcam,美國)、兔抗 Caspase1(p20)抗體;二抗,驢抗山羊 Alexa Fluor 568 熒光二抗(Thermo Fisher,美國),驢抗小鼠 Alexa Fluor 488 熒光二抗(Thermo Fisher,美國);DAPI 染色液(博士德,武漢);尼氏染色液(索萊寶,北京);Triton-100(Sigma,美國);IL-1βElisa 試劑盒、IL-18 Elisa 試劑盒(西塘生物,上海)。
不銹鋼毫針(0.30 mm×25 mm,蘇州醫療用品廠有限公司);電針儀(G6805,蘇州醫療用品廠有限公司);NYU 脊髓打擊器(W.M.Keck 神經科學協作中心,美國);熒光顯微鏡(Leica DMI 4000B/DFC425C,德國);Imagelab、Image-Pro 圖像分析系統(BIORADHERCULES,美國)。
1.3 制備脊髓損傷模型
根據參考文獻[6]制備SCI 模型。具體操作為,將7%水合氯醛腹腔注射,注射劑量為5 mL/kg;麻醉成功后,將大鼠背部 T9-11部位備皮,消毒;沿背部 T9-11部位中線作長約 3 cm 切口,去除棘突及橫突兩側附著的肌肉,咬骨鉗去除椎板,暴露脊髓;調整 NYU 打擊器,保證打擊桿對準脊髓,固定大鼠,釋放打擊桿,使質量為 10 g的打擊桿自12.5 mm 高度自由下落,撞擊脊髓,見大鼠后肢回縮抽搐及尾部痙攣性擺動則提示造模成功;沖洗傷口,逐層縫合。大鼠術后單籠飼養,注意保暖,每日人工按摩膀胱2 次。
1.4 各組大鼠處理方法
電針組和模型組采用上述方法制備SCI 模型。電針組大鼠自術后第 1 天開始給予電針干預,取穴為脊髓損傷節段上下兩對夾脊穴[7],具體定位參考《實驗針灸學》[8]。進針角度均為斜刺,深度約為 2 mm;使用 2根電線,1 號出口線正負極分別連接左側上下夾脊穴,2 號出口線正負極分別連接右側上下夾脊穴;電針儀參數為連續波,頻率為 2 Hz,電流強度為 1~3 mA,以大鼠安靜耐受、后肢及針體輕輕抖動為宜,每日 1次,每次 20 min。假手術組和模型組每日同一時間同等條件下抓取20 min 后回籠飼養,不予任何治療。
1.5 取材
干預3 d 后進行取材。麻醉成功后,每只大鼠采集靜脈血;每組6 只大鼠采用4%多聚甲醛灌注固定,取損傷處脊髓段約 2 cm,放入 4%多聚甲醛固定 48 h;另 6只大鼠采用直接取材,取損傷處脊髓段約 2 cm,-80℃保存備用。
1.6 檢測方法
1.6.1 尼氏染色
將5 μm 厚石蠟組織切片采用梯度乙醇依次復溫,放入二甲苯溶液中脫蠟,梯度乙醇浸泡至水,將切片浸入尼氏染色液在60℃溫箱中染色50 min,磷酸鹽緩沖液漂洗 3 次,分色液分色 2 min,晾干,中性樹膠封片,鏡下觀察并拍片。
1.6.2 Elisa 檢測
將采集的大鼠靜脈血離心后,取血清,按照 Elisa試劑盒說明進行操作,主要步驟依次為加樣,洗板,加入一抗工作液并反應20 min,洗板,加入酶標抗體工作液,洗板,加入底物工作液,加入終止液,酶標儀450 nm檢測吸光度值,依次檢測大鼠靜脈血清中 IL-1β和IL-18 含量。
1.6.3 免疫熒光染色
將5 μm 厚石蠟組織切片采用梯度乙醇依次復溫,放入二甲苯溶液中脫蠟,梯度乙醇浸泡,漂洗后用枸櫞酸鹽緩沖液高壓修復,血清封閉1 h,甩掉封閉液不洗,滴加 IBA-1 一抗(1:200)和 ED-1 一抗(1:200)混合液4℃過夜;次日復溫后,磷酸鹽緩沖溶液漂洗,避光滴加Alexa Fluor 568(1:200)和 Alexa Fluor 488 (1:200)熒光二抗混合液,室溫孵育2 h,磷酸鹽緩沖溶液漂洗,避光滴加DAPI 染色液,室溫孵育3 min,磷酸鹽緩沖漂洗,抗熒光淬滅封片劑封片,激光共聚焦掃描顯微鏡觀察并拍片。
1.6.4 Western Blot
將保存備用的脊髓組織加入裂解液,冰浴60 min。提取組織中的蛋白質,離心后 BCA 法定量蛋白,100℃加熱5 min 使蛋白質變性。蛋白變性后,將樣品于相應濃度的SDS-PAGE 凝膠電泳分離,電壓為80 V 持續20 min,調整電壓為120 V 持續90 min。轉膜,封閉,加入Caspase1(p20) 一 抗 (1:1000)4 ℃ 過 夜 ,加 入 二 抗(1:1000)孵育 2 h。漂洗掉二抗后開始顯影。將膜置于化學發光試劑中反應 1 min,在避光條件下顯影,凝膠掃描成像系統進行分析。
1.7 統計學方法
采用SPSS18.0 軟件進行統計分析。符合正態分布的計量資料以均數±標準差表示,采用t檢驗;計數資料采用卡方檢驗。以P<0.05 表示差異有統計學意義。
2 結果
2.1 電針對神經元形態的影響
假手術組神經元形態規則,結構完整,細胞內可見豐富的虎斑樣尼氏體;模型組神經元形態不規則,部分神經元水腫明顯,可見神經元溶解、液化后形成的空泡樣結構,尼氏體碎裂;電針組神經元形態較模型組改善,雖然可見少量神經元水腫以及空泡樣結構形成,但程度較模型組輕,尼氏體較飽滿。詳見圖1。

圖1 各組神經元形態(×200)
2.2 電針對炎性因子表達的影響
Elisa 結果見表 1,假手術組血清中炎性因子IL-1β和 IL-18 含量較低,模型組血清中 IL-1β和IL-18 含量較高;與假手術組相比,模型組和電針組血清中IL-1β和IL-18 含量顯著增高,差異具有統計學意義(P<0.01);與模型組比較,電針組血清中 IL-1β和IL-18 含量顯著降低,差異具有統計學意義(P<0.01)。
表1 各組血清中lL-1β和lL-18 含量比較 (±s,pg/mL)

表1 各組血清中lL-1β和lL-18 含量比較 (±s,pg/mL)
注:與假手術組比較1)P<0.01;與模型組比較2)P<0.01
組別n IL-1β IL-18假手術組 6 2.26±0.18 1.74±0.21模型組 6 29.88±0.751) 19.39±0.971)電針組 6 14.37±0.561)2) 12.76±0.631)2)
2.3 電針對MG 活化的影響
由圖2 可見,IBA-1 陽性細胞呈紅色,為小膠質細胞;ED-1 陽性細胞呈綠色,為被激活的小膠質/巨噬細胞;IBA1/ED1 雙陽性細胞呈黃色,為活化的小膠質細胞。陽性反應細胞均呈樹椏狀,散在分布于脊髓中。
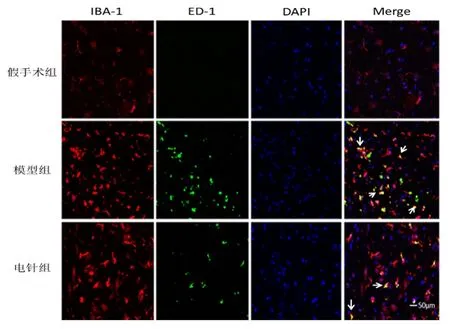
圖2 各組lBA1/ED1 雙陽性細胞表達情況
由表 2 可見,與假手術組比較,模型組和電針組IBA1/ED1 雙陽性細胞數顯著增多,差異有統計學意義(P<0.01);與模型組比較,電針組IBA1/ED1 雙陽性細胞數顯著增多,差異有統計學意義(P<0.01)。
表2 3組免疫熒光陽性細胞計數比較 (±s)

表2 3組免疫熒光陽性細胞計數比較 (±s)
注:與假手術組比較1)P<0.01;與模型組比較2)P<0.01
組別n IBA1/ED1假手術組 6 2.83±0.83模型組 6 14.83±2.241)電針組 6 9.50±1.381)2)
2.4 電針對 cleaved-Caspase1(p20)蛋白表達的影響
由圖3 可見,假手術組cleaved-Caspase1(p20)蛋白表達量較低,模型組p20 蛋白表達量較高。
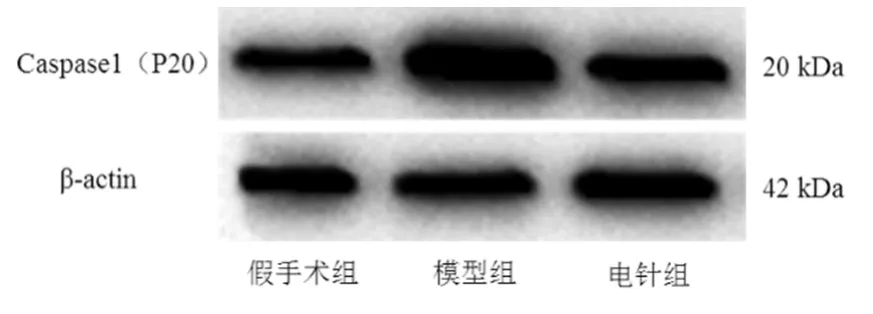
圖3 各組Caspase1(p20)蛋白表達情況
表3 各組cleaved-Caspase1(p20)蛋白相對表達量比較(±s)
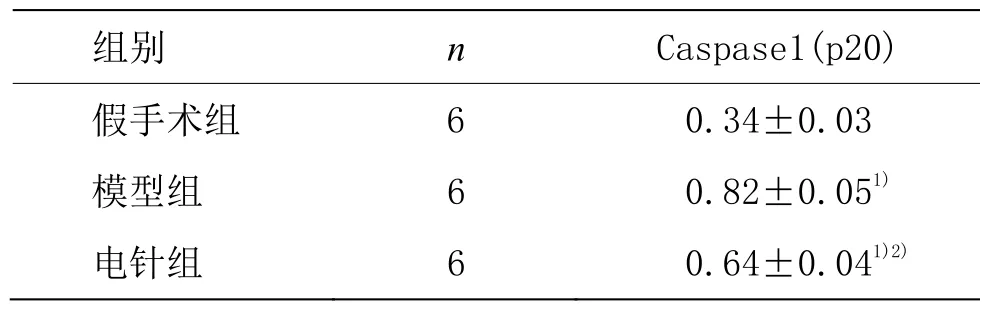
表3 各組cleaved-Caspase1(p20)蛋白相對表達量比較(±s)
注:與假手術組比較1)P<0.01;與模型組比較2)P<0.01
組別n Caspase1(p20)假手術組 6 0.34±0.03模型組 6 0.82±0.051)電針組 6 0.64±0.041)2)
由表 3 可見,與假手術組比較,模型組和電針組cleaved-Caspase1(p20)蛋白表達量顯著增高,差異具有統計學意義(P<0.01);與模型組比較,電針組cleaved-Caspase1(p20)蛋白表達量顯著降低,差異具有統計學意義(P<0.01)。
3 討論
炎癥是 SCI 發生后重要的病理反應之一,炎癥釋放的大量炎性因子以及炎性細胞浸潤、聚集是導致神經元壞死、凋亡、自噬,軸突脫髓鞘,血管通透性改變和水腫等病理變化的重要原因[9-10]。MG 作為中樞神經系統中的固有免疫細胞,在 SCI 發生后的炎癥反應中發揮重要作用。急性脊髓損傷發生后,脊髓中的固有MG 是損傷后大量炎性因子包括IL-1β、IL-6 和TNF-α的主要來源,從而介導炎癥。SCI 發生后活化小膠質細胞/巨噬細胞群迅速向損傷區域聚集,在損傷后3 d 左右即可達到高峰,發揮浸潤和吞噬作用[11-12]。因此,本研究選擇損傷后3 d 作為時間點進行觀察。SCI 發生后,破裂的細胞和損傷的組織釋放的ATP激活MG后,MG極化為M1 狀態和M2 狀態。M1 狀態的MG 主要促進炎性介質特別是炎性因子的釋放,而M2狀態的MG主要發揮抑制炎性介質的作用。但是,在SCI 持續損傷的狀態下,大部分MG向M1狀態發生極化而導致炎癥加劇并形成惡性循環。同時,MG 活化介導炎癥的主要機制與MG活化后細胞膜通透性發生改變有關。在 ATP 的作用下,MG 細胞膜通透性改變,導致細胞內外鈉離子、鉀離子和鈣離子失衡,進一步活化 Caspase1,使其被剪切為具有酶切活性的 Caspase1(p20),Caspase1(p20)對IL-1β前體和IL-18 前體進去剪切,使其成熟為具有促炎作用的炎性因子并釋放到細胞外[13]。SCI 發生后,活化 MG 參與的炎癥反應對神經系統修復來說是一把雙刃劍。一方面,損傷早期輕度MG 活化和炎癥反應有利于清除壞死細胞和組織碎片,保護未損傷組織,促進組織修復[15];另一方面,隨著損傷持續及損傷-炎癥惡性循環,過度MG 活化和持續高水平炎癥反應產生大量炎性介質及細胞毒性物質,導致細胞壞死、凋亡、神經退行性變等阻礙組織修復的病理結果[16]。由此可見,SCI后如何有效針對MG活化進行干預,通過降低MG活化程度進而維持低水平炎癥是治療SCI 的新思路和切入點。
SCI 中醫學的病因病機為跌仆損傷致經脈受損,氣血瘀阻,氣血運行不暢,下肢失養所致。治療當以益氣活血、通督復髓為原則[17]。電針刺激具有活血通經、調暢督脈上下的功效,因此電針治療脊髓損傷符合中醫學基礎理論。夾脊穴是腰背部的重要穴位,走行于督脈和足太陽膀胱經之間。中醫學理論認為,夾脊穴與上下、左右和前后經脈之氣借助氣街路徑而相互聯系溝通,成為聯絡溝通督脈和足太陽膀胱經脈氣的傳輸點。同時,從人體生理解剖方面來說,夾脊穴與脊神經節段分布有密切關系。刺激夾脊穴可有效刺激脊神經的前支和后支,從而影響交感神經而調節人體臟腑功能活動與氣血運行[18]。臨床實踐中,對SCI 患者施以電針夾脊穴治療,對于改善SCI 患者肢體運動功能、感覺功能以及膀胱功能等均有一定作用。本研究發現,電針組SCI 大鼠脊髓組織中神經元形態可見較明顯改善,同時血清中促炎性因子 IL-1β和 IL-18 含量顯著減少,這進一步證實電針夾脊穴確能通過抑制炎癥而有利于損傷后神經元修復。但是,關于電針抑制炎癥的機制研究尚少,電針是如何抑制SCI 后炎癥尚不十分清楚。本研究進一步發現,電針抑制SCI后MG活化程度,同時降低具有酶切作用的 Caspase1(p20)蛋白的表達;同時電針干預可有效降低SCI 大鼠血清中炎性因子IL-1β和IL-18 含量。因此,鑒于MG 活化對炎癥的重要介導作用以及Caspase1(p20)在MG 活化介導炎癥過程中對無活性IL-1β和IL-18 的重要酶切作用,推測SCI 發生后,電針干預可抑制MG 活化并抑制 Caspase1(p20)蛋白表達,從而使具有促炎效應的IL-1β和IL-18 生成較少,這可能是電針降低SCI 后IL-1β和IL-18 含量抑制炎癥的主要原因之一。因此,本研究說明電針抑制SCI后炎癥而有利于神經元形態改善的機制與其抑制 SCI后MG 活化介導的炎癥有關。

