常規陽離子存在時Mg-Al-CO3LDH對土壤中Cd吸附遷移的影響
王玉環,林 青,徐紹輝
(青島大學環境科學與工程學院,山東 青島 266071)
隨著化學工業的迅猛發展,大量重金屬通過各種途徑進入到土壤環境中,造成土壤的重金屬污染[1]。重金屬易在植物、動物及人體內富集,對生態環境及人體健康產生嚴重威脅[2-3]。近年來,有關土壤Cd污染的研究越來越深入,宋偉等[4]依托收集的我國重金屬污染案例資料,通過建立數據庫分析得出Cd元素是當前我國耕地土壤重金屬污染的最主要元素,污染發生概率為25.20%;Zhou等[5]研究了中國4個礦區中土壤與作物的Cd污染情況,指出礦區對土壤及作物Cd污染有重要影響;Naidu等[6]研究了離子強度與pH不同時土壤對Cd的吸附特征,表明離子強度與pH通過改變土壤表面電荷強度影響土壤對Cd的吸附。
土壤成分復雜,各組分勢必對污染物的吸附解吸產生不同影響。很多學者[7-10]從土壤組分入手,研究土壤組分對污染物的吸附機理。層狀雙氫氧化物(Layered double hydroxide,LDH)是一種陰離子黏土礦物。LDH的化學組成為[M2+(1-x)M3+x(OH)2](An-x/2)y·H2O,其中,M2+表示二價金屬陽離子,M3+表示三價金屬陽離子,An-為層間可交換的陰離子,x為M3+與M2++M3+的物質的量比。一定條件下,土壤中重金屬可原位反應生成LDH[11]。有關LDH的研究多集中在污水處理[12-16]、土壤修復[17-20]、醫學藥物載體[21-22]等方面。隨著LDH的廣泛應用,通過污水處理、土壤修復等方式進入土壤的LDH越來越多,LDH具有特殊的結構及性質,其對土壤環境的改變使土壤污染物的吸附遷移活動變得更為復雜。梁學峰等[23-24]詳細介紹了LDH對金屬離子的吸附機理及影響因素,表明LDH對金屬離子的吸附機理主要有:金屬與LDH表面的羥基發生表面絡合反應生成絡合物;重金屬與LDH表面氫氧化物反應形成沉淀;重金屬與LDH層間陰離子發生螯合反應生成螯合物;重金屬與層上金屬離子發生同構置換反應形成新的LDH。
本文通過將自然界常見的LDH定量加入到土壤中,與原土壤作對照,研究不同陽離子類型下LDH的存在對重金屬Cd在土壤中吸附遷移的影響,并通過純物質實驗對LDH及其吸附重金屬后的樣品進行紅外光譜掃描及X射線衍射分析,探討LDH對Cd的吸附機理。這對于深入了解Cd在土壤中的吸附遷移過程、防治地下水污染具有重要意義。
1 材料與方法
1.1 供試材料
實驗土壤取自青島市南村實驗田,去除表層植物根系,取0~20 cm深處的土壤,置于陰暗處自然風干,過10目篩備用。土壤理化性質如表1所示。
實驗用藥品 NaCl、KCl、CaCl2、MgCl2、Cd(NO3)2·4H2O均為分析純。實驗用LDH購自北京泰克萊爾科技有限公司,分子式Mg4Al2(OH)12CO3·mH2O,pH(20 g·L-1懸浮液)約為8,平均粒徑D90=0.4 μm。
1.2 實驗方法
1.2.1 Mg-Al-CO3LDH土壤的制備
稱取一定量的Mg-Al-CO3LDH,加入到過10目篩的土壤中,再加入適量的蒸餾水濕潤土壤,充分攪拌混勻,得到Mg-Al-CO3LDH含量為300、500、1000、1200 mg·kg-1的土壤。將各濃度土壤置于陰暗處風干,過10目篩后放置老化2個月以使其與土壤充分接觸反應,備用。以下稱L土。

表1 土壤理化性質Table 1 Physical and chemical properties of the soil
1.2.2 動力學吸附實驗
以0.01 mol·L-1的KCl為背景溶液,配制濃度為500 mg·L-1的Cd溶液,調節pH至5.5。分別稱取2 g自然土壤及L土于50 mL聚丙烯離心管中,按水土比10∶1加入20 mL背景溶液為KCl的Cd溶液,在25℃、250 r·min-1振蕩器中振蕩。分別在10、20、30 min和1、2、3、4、12、24、48 h后取出樣品,以4000 r·min-1的速度離心5 min,過濾,測上清液中Cd2+濃度。
1.2.3 不同Mg-Al-CO3LDH濃度的批量靜態吸附實驗
以0.01 mol·L-1的KCl為背景溶液,配制濃度為0、50、100、200、250、300、400 mg·L-1的Cd溶液,調節pH 為 5.5。分別稱取 2 g LDH 含量為 0、300、500、1000、1200 mg·kg-1的土壤于50 mL離心管中,按水土比10∶1加入20 mL Cd溶液,于250 r·min-1下振蕩24 h,4000 r·min-1離心5 min,過濾,測上清液中Cd2+濃度。
1.2.4 不同陽離子類型的批量靜態吸附實驗
分別以 0.01 mol·L-1的 KCl、NaCl、CaCl2、MgCl2為背景溶液,配制濃度為0、50、100、200、300、400 mg·L-1的Cd溶液,調節pH至5.5。稱取2 g自然土壤及L土于50 mL聚丙烯離心管中,按水土比10∶1加入20 mL背景溶液為 KCl、NaCl、CaCl2和 MgCl2的 Cd 溶液,在25 ℃、250 r·min-1振蕩器中振蕩24 h,以4000 r·min-1的速度離心5 min,過濾,測上清液中Cd2+濃度和pH。
上述實驗處理均做3個重復。
1.2.5 純物質實驗
配制Cd2+濃度為 50、100、200、300、400、500 mg·L-1的溶液,調節pH至5.5。準確稱取0.03 g Mg-Al-CO3LDH于50 mL聚丙烯離心管中,加入10 mL Cd溶液,振蕩、離心、過濾,測上清液Cd2+濃度。取吸附率較高的樣品粉末,室溫下晾干后,進行紅外光譜掃描和X射線衍射分析。
1.2.6 室內土柱遷移實驗
分別取350 g土壤(自然土壤與L土),分6次均勻填裝到直徑為4.5 cm、高20 cm的土柱中,土柱由有機玻璃加工而成。為了使土柱填裝均勻,避免大孔隙出現,每次使用壓實器壓實后再填裝下一層;在土柱兩端的接口處均放置適量脫脂棉,以防止土壤顆粒隨溶液流出,堵塞出液口;在柱子兩端分別加入一張與土柱直徑相當的濾紙,并填裝約2.5 cm的石英砂,以保證供液時,溶液可以均勻滲入到土壤中。啟動蠕動泵,先用 0.01 mol·L-1的 KCl/NaCl/CaCl2/MgCl2溶液自下而上飽和土柱,待土柱飽和并出流穩定后,調節流速為8.6 cm·h-1,自上而下輸入20 PV(Pore Volume)的pH為5.5、濃度為500 mg·L-1的Cd溶液,其后用0.01 mol·L-1的 KCl/NaCl/CaCl2/MgCl2溶液沖洗。收集出流液,測定Cd2+濃度,并測其pH。實驗裝置示意圖如圖1所示。
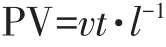
式中:PV為孔隙體積,無量綱,故也可表示時間;v為孔隙水流速,cm·h-1;t為時間,h;l為土體長度,cm。
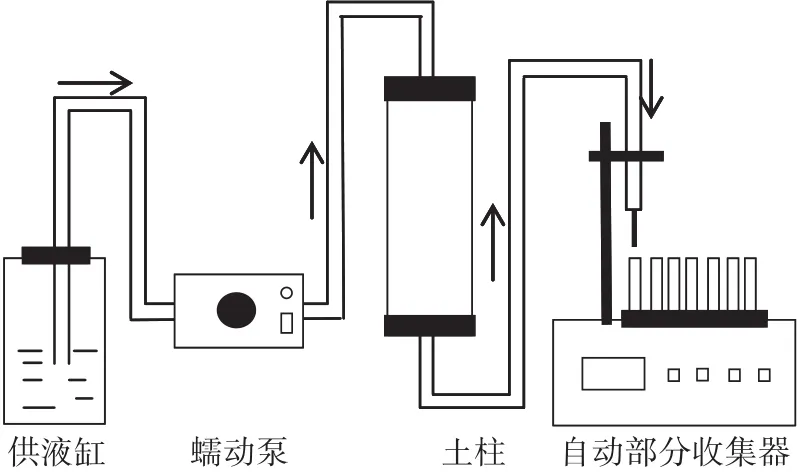
圖1 土柱實驗示意圖Figure 1 Schematic diagram of the soil column experiment
1.3 試劑及分析方法
用ICP-OES(Optima 8000)測定重金屬濃度;用pH計(PHS-3C)測定pH;用電導率儀(DDB-303A)測定電導率。
樣品的X射線衍射分析于X射線衍射儀(DX 2700)上進行,掃描速率(2θ)為2 °·min-1,掃描范圍為5°~90°,Cu靶,Kα(λ=1.541 8 ?),加速電壓40 kV,電流30 mA。
樣品的紅外分析測試于傅里葉變換紅外光譜儀(Nicolet iS50)上進行,波數為400~4000 cm-1。
吸附量計算公式及吸附動力學模型如下:
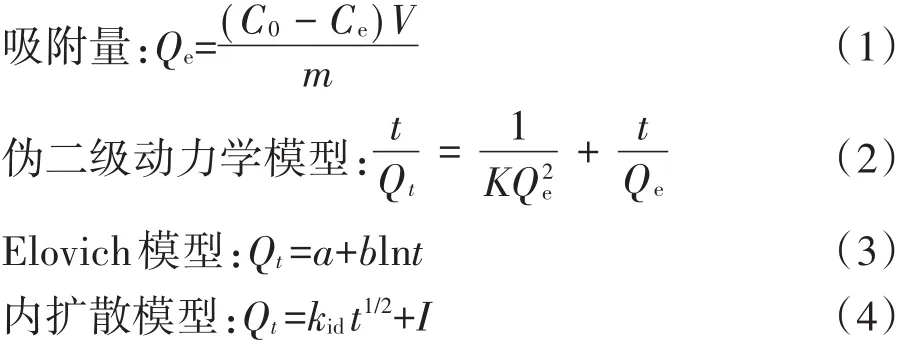
式中:Qe為達吸附平衡時Cd2+在土壤中的吸附量,mg·kg-1;C0為 Cd2+的初始濃度,mg·L-1;Ce為達到平衡后Cd2+的濃度,mg·L-1;V為溶液體積,L;m為土壤質量,kg;Qt為t時刻的吸附量,mg·kg-1;K為偽二級吸附速率常數,kg·mg-1·h-1;a、b為Elovich常數;kid為顆粒間擴散速率常數,mg·kg-1·h-1/2;I為與邊界層厚度有關的常數。
2 結果與討論
2.1 Cd在自然土壤和L土中的動力學吸附
如圖2所示,Cd在兩種土壤中的吸附過程均可分為3個階段:第一階段為快速吸附階段,Cd2+進入土壤后,由于此時土壤表面含有大量的吸附位點,使Cd2+被迅速吸附,該階段在30 min內即可完成;第二階段為動態平衡階段,Cd2+在土壤中的吸附出現了一定的波動,在此階段內,Cd2+開始向土壤顆粒內部或Mg-Al-CO3LDH層間擴散,因此吸附速率有所減慢;第三階段為吸附平衡階段,此時吸附解吸逐漸達到平衡,吸附量變化很小。在吸附平衡階段,L土中的吸附量仍有一定程度的增大,這是由于Mg-Al-CO3LDH提供的大量CO2-3仍可與Cd2+結合以完成吸附。
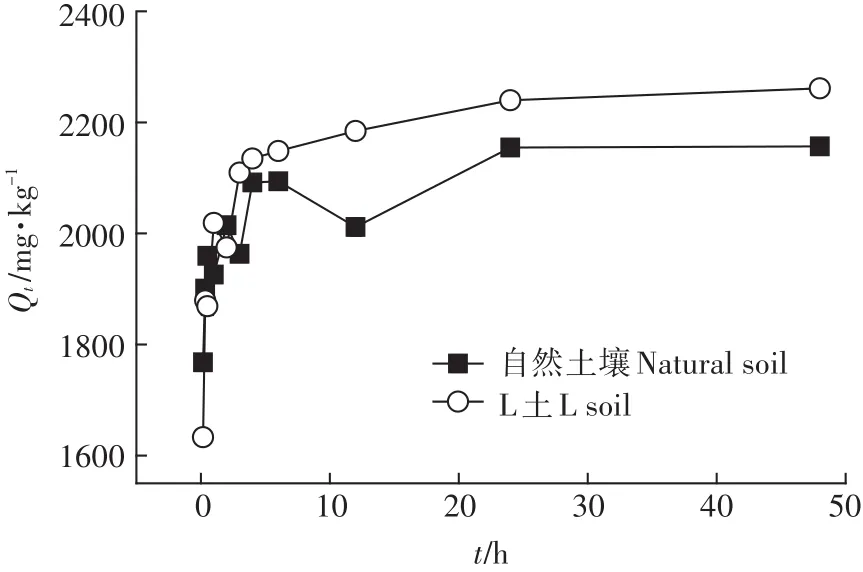
圖2 Cd在兩種土壤中的吸附動力學曲線Figure 2 Kinetic adsorption curves of the adsorption of Cd in two soils
表2為利用偽二級動力學模型及Elovich模型擬合所得參數。偽二級動力學模型是基于假定吸附速率受化學反應或通過電子共享或電子得失的化學吸附的控制[25],從表中可看出,R2均接近于1,擬合效果非常好,且其擬合得到的平衡吸附量與實際測定值很接近,說明土壤對Cd2+的吸附能力與吸附位點有關,吸附速率受控于化學吸附。Elovich模型可描述吸附體系的動力學機制,更適用于吸附體系中活化能變化較大,即吸附劑化學組分較為復雜的過程[26]。L土中Elovich模型擬合R2相對較高,說明Mg-Al-CO3LDH的存在增加了土壤化學組分的復雜性,使Cd2+在土壤中的非均相擴散過程更為明顯。
通過內擴散模型可以判斷顆粒間擴散是否為控制步驟[27-28]。若t1/2-Qt呈線性關系,且過原點,則說明顆粒間擴散是唯一控速步驟[26]。從圖2可以看出,在自然土壤與L土中t1/2與Qt之間線性關系不明顯,說明吸附速率受多步驟控制。曲線開始出現的快速上升階段代表液膜擴散或高速率的表面吸附,隨后是顆粒間擴散,最后平臺期表示吸附平衡狀態。因此,土壤對Cd2+的吸附速率受液膜擴散、顆粒間擴散以及化學反應等綜合作用的影響,顆粒間擴散并不是唯一的控速步驟。
2.2 不同Mg-Al-CO3LDH含量時Cd在土壤中的等溫吸附
圖3為不同Mg-Al-CO3LDH含量時Cd2+在土壤中的吸附等溫線,可以看出隨Mg-Al-CO3LDH含量的升高,吸附量逐漸增大,說明Mg-Al-CO3LDH的存在可促進土壤對Cd2+的吸附。Mg-Al-CO3LDH表面含有大量羥基,增加了土壤對Cd2+的吸附位點,其次,LDH中的CO2-3可與Cd2+反應,增大吸附量。
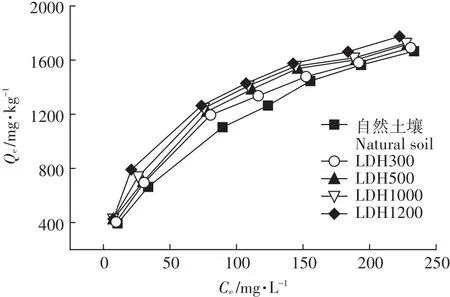
圖3 Cd2+在不同Mg-Al-CO3LDH含量時的吸附等溫線Figure 3 Adsorption isotherms for Cd2+at different LDH contents
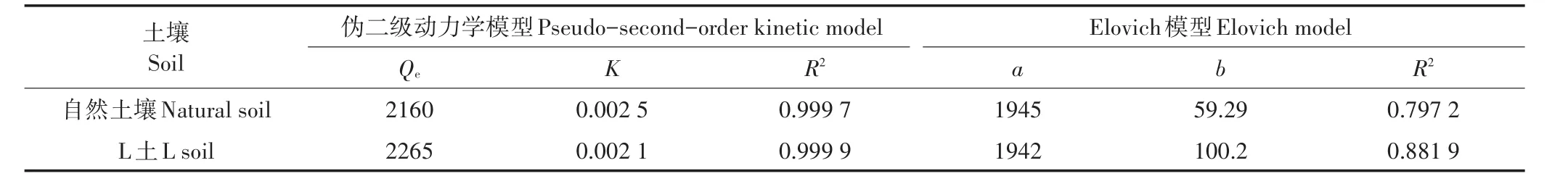
表2 動力學吸附擬合參數Table 2 Parameters for kinetic models
2.3 不同離子類型時Cd在土壤中的等溫吸附
土壤溶液中的陽離子會與重金屬離子競爭土壤表面的吸附位點,從而影響土壤對重金屬的吸附。如圖4所示,不同離子類型時L土對Cd2+的吸附量均大于自然土壤,即Mg-Al-CO3LDH起促進吸附的作用。這主要是因為Mg-Al-CO3LDH表面含有的大量OH-使土壤pH升高,促使金屬氫氧化物的形成[29],增大吸附量。另外,Mg-Al-CO3LDH含有的大量CO2-3也可與Cd2+反應形成CdCO3沉淀,對Cd2+的運移起到阻滯作用。陽離子類型不同時,土壤對Cd2+的吸附能力不同,兩種土壤中吸附量大小均為Na+>K+>Mg2+>Ca2+,即隨著陽離子價態的升高,吸附量下降。這是因為陽離子價態越高,其與土壤膠體顆粒的親和力越強,從而與Cd2+競爭吸附位點,影響吸附量。土壤膠體對同價陽離子吸附的選擇性與陽離子的水合半徑或水化能有關。水合離子半徑越小,單位體積的電荷密度越大;同時,離子與膠體表面的距離也越近,庫侖力增大,因此其吸附性越強[30]。4種陽離子水合半徑大小順序為 K+<Na+,Ca2+<Mg2+,則土壤對陽離子吸附性為K+>Na+,Ca2+>Mg2+,即 K+、Ca2+更易與 Cd2+競爭吸附位點,從而使土壤對Cd2+的吸附量相對較低。
圖5為平衡溶液中pH的變化曲線,可以看出,L土的pH明顯大于自然土壤,這是因為Mg-Al-CO3LDH為堿性物質,表面帶有大量的OH-。Cd2+進入土壤后,與土壤表面及土壤溶液中的羥基反應,消耗OH-,同時置換出H+,使pH下降。Cd2+濃度越高,置換出的H+也就越多,因此隨初始Cd2+濃度的升高,pH逐漸下降。NaCl為背景溶液時,其pH明顯大于其他背景溶液。有研究表明[31-32],Na+的存在會改變土壤的理化性質,引起土壤顆粒的膨脹和分散,且當Na+/Ca2+>4時,土壤易發生堿化,pH升高。本研究土壤溶液中Na+/Ca2+遠大于4,表明土壤已經發生堿化,導致pH升高。
2.4 不同離子類型時Cd在土壤中的遷移
從圖6可以看出Cd2+在L土的出流時間均大于自然土壤,說明Mg-Al-CO3LDH的存在對Cd2+的遷移起抑制作用。用Cd溶液淋洗土柱時,土壤中的Mg-Al-CO3LDH可以與Cd2+發生表面絡合反應,或Cd2+與Mg-Al-CO3LDH表面及邊緣的CO2-3反應生成CdCO3沉淀[33],因此,Mg-Al-CO3LDH的存在可促進Cd2+的吸附,使穿透時間延長。輸入20 PV Cd2+后,用相應背景離子進行反沖洗。反沖洗階段,所有土柱中Cd2+的相對濃度并不是緩慢下降,而是先急劇下降,然后出流濃度相對穩定或有小的突起而后再緩慢下降,有明顯的“拖尾”現象。反沖洗初始階段,隨著背景離子的進入,吸附在土壤表面的Cd2+逐漸被背景溶液中的陽離子置換下來,從而出現了一段相對穩定的出流濃度;不同離子類型時Cd穿透曲線的“拖尾”現象說明存在化學非平衡吸附,即吸附解吸過程并不是迅速完成,而是依賴于時間。從圖中可以看出,離子類型為CaCl2、MgCl2時,反沖洗階段L土中Cd2+的出流濃度高于自然土壤,這可能是因為與CO2-3結合的Cd2+逐漸被背景離子置換下來,使出流濃度升高。
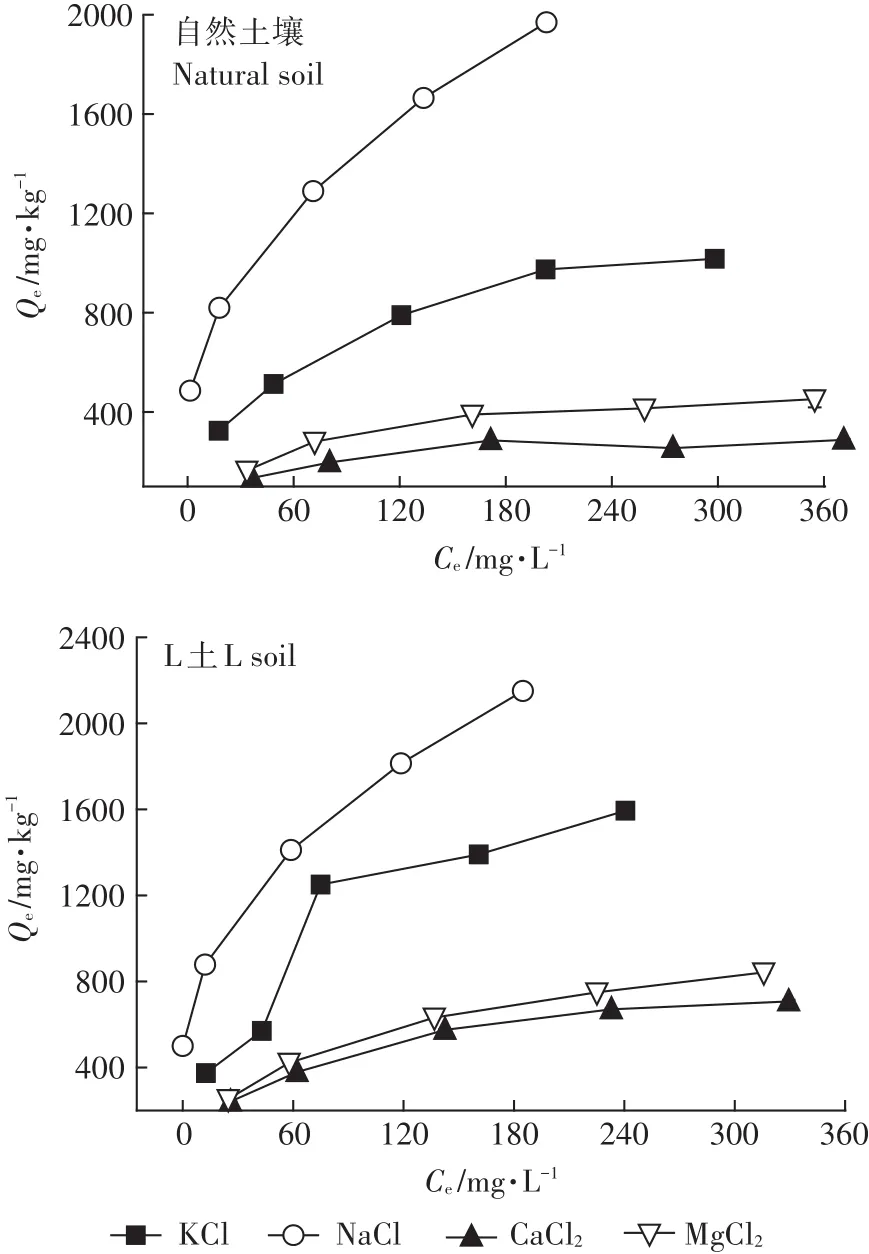
圖4 Cd2+在不同陽離子類型下的吸附等溫線Figure 4 Adsorption isotherms for Cd2+in the presence of different cationic species
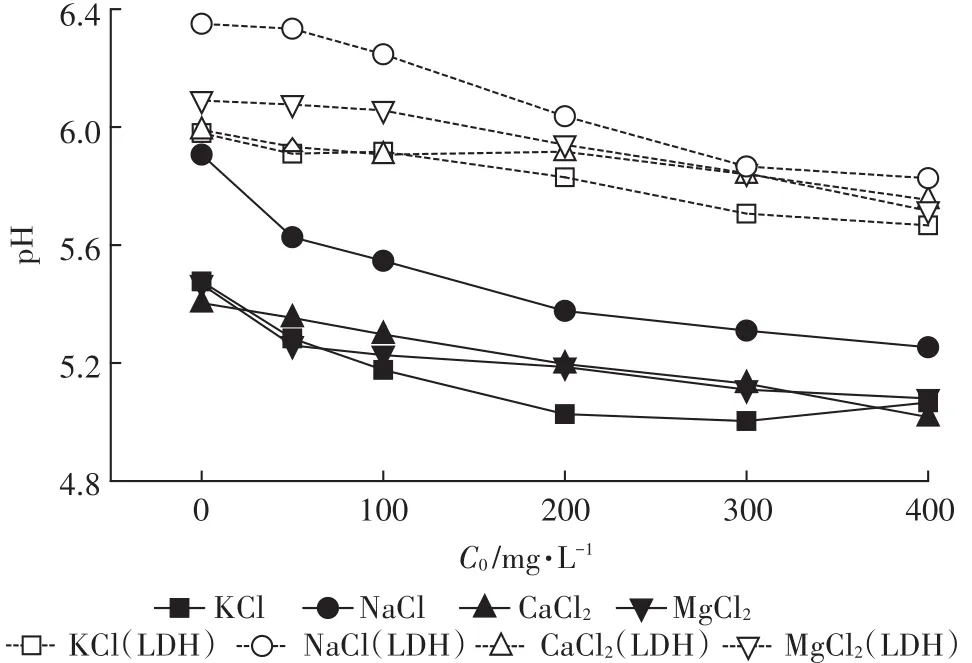
圖5 平衡溶液中pH變化曲線Figure 5 Breakthrough curves of pH in the equilibrium solution
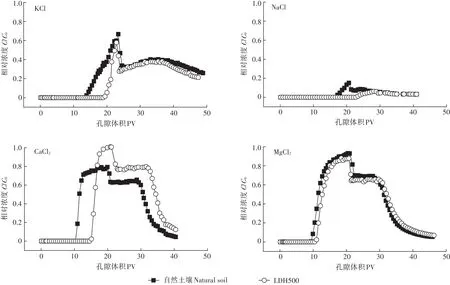
圖6 不同離子類型時Cd2+在兩種土壤中的穿透曲線Figure 6 Breakthrough curves of Cd2+in two soils under different cation species
如圖7所示,不同離子類型時Cd2+在土壤中的遷移能力各不相同。無論有無Mg-Al-CO3LDH,Cd2+的出流順序均依次為 Mg2+、Ca2+、K+、Na+,即高價態陽離子更易與Cd2+競爭吸附位點,促進Cd在土壤中的遷移。然而,不同離子類型時,在兩種土壤中Cd2+的出流峰值有所差異,自然土壤中當背景離子為Mg2+時峰值最高,而在L土中,背景離子為Ca2+時其峰值最高,這是因為土壤對金屬離子的吸附過程分為兩個階段。金屬離子進入土壤后,首先與土壤及Mg-Al-CO3LDH表面的羥基發生表面絡合反應,這一過程相對較快。已知 KspCa(OH)2為 5.5×10-6,KspMg(OH)2為1.8×10-11,即Mg2+更易與Cd2+競爭吸附位點產生沉淀,則Mg2+存在時可促進Cd2+的遷移,所以背景溶液為MgCl2時Cd2+最先出流。隨著時間的推移,由于Mg-Al-CO3LDH的存在,金屬離子逐漸與Mg-Al-CO3LDH表面或邊緣的CO2-3反應,生成沉淀。已知Ksp-CaCO3為 3.36×10-9,KspMgCO3為 6.82×10-6,即 Ca2+更易與Cd2+競爭吸附位點產生沉淀,所以離子類型為Ca2+時會促進Cd2+的遷移,所以L土中背景離子為CaCl2時其峰值最高。
離子類型為NaCl時,出流液中Cd2+濃度很低,即大部分Cd2+均被吸附,僅在反沖洗階段,有微量的Cd2+出流,并表現出“拖尾”現象。這可能是因為Na+的土壤非專性吸附屬性很難將專性吸附的Cd2+交換下來,也可能是由于背景離子Na+的大量存在使土壤發生堿化,pH升高,Cd2+與土壤溶液中的OH-反應生成Cd(OH)2沉淀的幾率增大,從而抑制遷移。
圖8為4種離子類型時出流液的pH隨時間的變化曲線圖。自然土壤中出流液pH變化大體呈先下降后緩慢上升的趨勢;L土中出流液pH變化呈先降后升的趨勢,且上升速率更快。Cd2+進入土壤后被土壤所吸附,同時置換出土壤表面的H+,使土壤溶液pH下降。反沖洗階段,出流液pH趨于土壤pH,逐漸升高。由于Mg-Al-CO3LDH表面有大量的OH-,輸入Cd2+時可以中和部分被置換下來的H+,反沖洗時又可釋放少量OH-,使L土出流液pH明顯高于自然土壤。從圖中可以看出,以NaCl為背景溶液時其出流液pH明顯高于其他背景溶液,同樣地,這可能與Na+對吸附態Cd2+的弱置換能力有關。
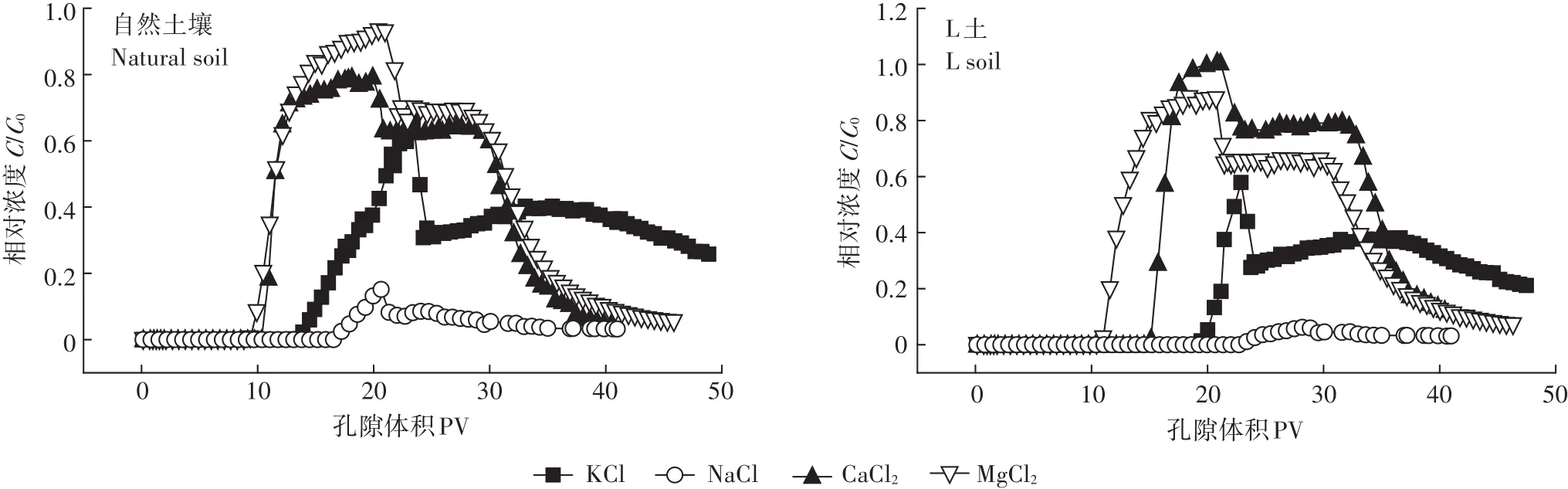
圖7 不同離子類型時Cd2+的穿透曲線Figure 7 Breakthrough curves of Cd2+under different cation species

圖8 不同離子類型時出流液pH隨時間的變化Figure 8 pH change in the outflow solution under different cation species
2.5 光譜分析
對Mg-Al-CO3LDH及其吸附Cd2+后的樣品進行光譜分析,以探究其吸附機理。圖9為Mg-Al-CO3LDH及其吸附Cd2+后的紅外光譜分析圖,3 358.88 cm-1為Mg-Al-CO3LDH層間的羥基或水分子引起的對稱伸縮振動峰;959.93 cm-1為羥基的彎曲振動峰;2 915.44、2 848.38 cm-1為-CH的伸縮振動峰;1 575.25、1 539.84、1 470.92 cm-1對應于-C=O的不對稱伸縮振動峰;400~800 cm-1則為Mg/Al-O的變形振動峰。吸附Cd后,3 358.88、664.74 cm-1處峰強減弱,這可能是由吸附反應后Mg-Al-CO3LDH層間-OH及CO23-減少引起。859.17 cm-1處出現一個新的特征峰,對應于Cd-C伸縮振動峰,說明Cd與Mg-Al-CO3LDH邊緣的CO23-反應并產生了CdCO3沉淀。整體來看,吸附反應前后Mg-Al-CO3LDH的峰形并未發生較大變化,但其峰強均有所減弱,這可能是由CdCO3沉淀覆蓋層效應所致[24]。
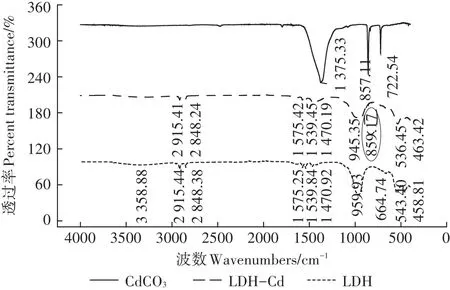
圖9 LDH及其吸附Cd2+后的紅外光譜圖Figure 9 Infrared spectra of LDH before and after Cd2+adsorption
如圖10所示,分別在2θ為11.38、23.42、34.32附近出現3個衍射強度相對較大的特征衍射峰,歸屬于003、006、012衍射晶面,與標準卡的結果基本一致,具有Mg-Al-CO3LDH的典型特征峰。吸附Cd后的LDH出峰沒有發生明顯變化,但峰強減弱。另外,對照標準卡,在LDH-Cd譜圖中出現了CdCO3的峰,進一步說明Cd2+進入Mg-Al-CO3LDH層間,與CO2-3反應生成了CdCO3沉淀,并伴隨有Mg-Al-CO3LDH結構的輕微破壞。圖中出現少量雜峰,這可能是在Mg-Al-CO3LDH制備過程中摻入少許雜質引起。由光譜分析可知,Mg-Al-CO3LDH對Cd2+的吸附機理主要為沉淀反應。
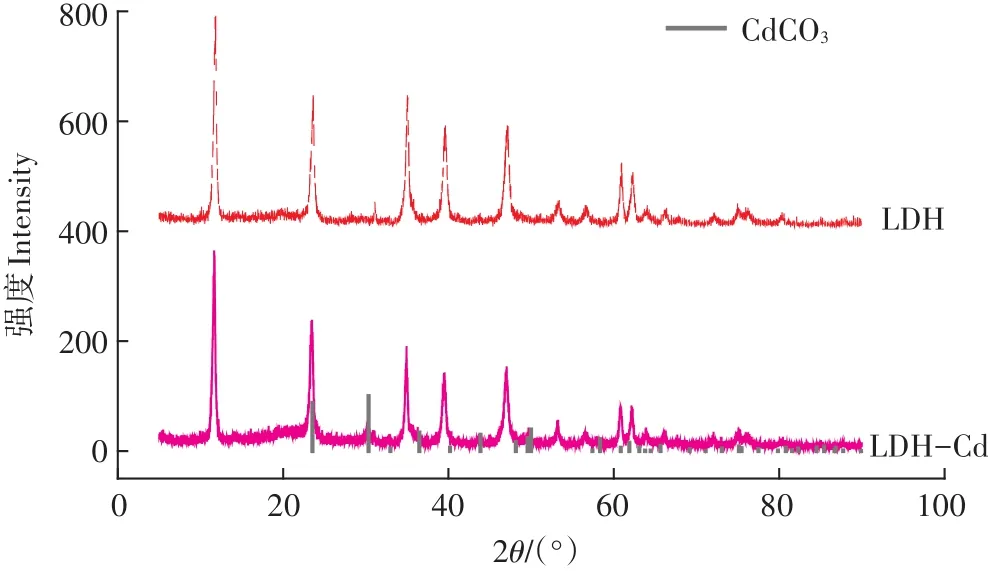
圖10 LDH及吸附Cd2+后的X射線衍射圖Figure 10 X-ray diffraction patterns of LDH before and after Cd2+adsorption
3 結論
(1)偽二級動力學模型擬合效果較好,說明土壤對Cd2+的吸附過程主要為物理化學吸附;在L土中,Elovich模型擬合效果相對較好,表明Mg-Al-CO3LDH的存在增加了Cd2+在土壤中的非均相擴散過程。t1/2與Qt之間線性關系并不明顯,即吸附速率受多步驟影響,顆粒間擴散并不是唯一控速步驟。
(2)批量靜態吸附實驗結果表明,陽離子價態越高,吸附量越小。Mg-Al-CO3LDH的存在使土壤pH升高,促使表面沉淀反應的發生;且大量CO2-3的存在,使得Mg-Al-CO3LDH起到促進吸附的作用。
(3)在自然土壤與L土中,不同離子類型下Cd2+的出流順序均依次為Mg2+、Ca2+、K+、Na+。即高陽離子價態可促進Cd2+的遷移,同價陽離子類型時,陽離子水合半徑越小,越有利于Cd的遷移。Mg-Al-CO3LDH存在時可抑制Cd的遷移。兩種土壤不同離子類型時Cd穿透曲線均存在明顯的“拖尾”現象,說明土壤對Cd2+的吸附存在非平衡吸附現象。
(4)光譜分析結果表明,Mg-Al-CO3LDH對Cd2+的吸附機制主要為沉淀反應。

