去腎神經術(RD)對比藥物治療急性心梗(AMI)后心衰(HF)大鼠的療效及機制
唐敏娜 胡嘉祿 顏 彥
(復旦大學附屬中山醫院心內科 上海 200032)
隨著經皮冠狀動脈介入治療技術在臨床應用的普及,急性心肌梗死(acute myocardial infarction,AMI)患者的院內死亡率已顯著下降[1],但AMI后伴隨心力衰竭(heart failure,HF)及左室功能下降的患者預后仍然較差[2-3]。研究顯示,AMI患者住院期間HF發生率約37.5%[3],AMI后HF的住院患者年死亡率高達45.5%[4],這使得HF的預防及治療成為AMI后治療的重點之一。目前認為心室重構、神經內分泌系統激活以及炎性因子的作用在AMI后HF的發生與進展過程發揮重要作用[5-6],這也是目前AMI后HF的主要治療靶點。
近年來,隨著射頻消融去腎臟神經術(renal denervation,RD)的興起,越來越多的研究證實了RD在HF治療方面的療效及安全性。Hu等[7]發現RD能顯著改善AMI后HF大鼠的心功能。Liu等[8]報道RD能夠有效地減少心肌纖維化和左室重構。臨床研究方面,Fukuta等[9]進行的一項Meta分析納入了101例慢性心力衰竭患者,結果顯示RD能顯著提高患者的左心室射血分數(left ventricular enjection fraction,LVEF),并且均未發生低血壓或暈厥等嚴重不良事件。
RD治療HF的作用與其抑制激活的交感神經系統(sympathetic nervous system,SNS)及腎素-血管緊張素-醛固酮系統(renin-angiotensin-aldosterone system,RAAS)活性相關。血管緊張素轉化酶抑制劑(angiotensin converting enzyme inhibitors,ACEI)和β受體阻滯劑(β-blocker)作為RAAS及SNS抑制劑,是目前臨床上改善HF預后的主要治療藥物[10]。但是,RD相較于β-blocker+ ACEI藥物聯合治療AMI后HF的療效對比、RD治療的最佳時機以及RD對AMI后心臟自主神經(cardiac autonomic nerve system,CANS)的調控作用研究較少。
本研究將對比分析AMI后1天及4周后分別行RD、β-blocker+ ACEI藥物聯合治療對AMI大鼠模型的心功能、血漿腦鈉尿肽(brain natriuretic peptide,BNP)、腎素、血管緊張素Ⅱ(Ang Ⅱ)、醛固酮(aldosterone,ALD)、去甲腎上腺素(norepinephrine,NE)水平,梗死心肌NE含量,心率(heart rate,HR)和5 min內NN間期標準差(standard deviation of NN interval,SDNN)的影響,以探究RD與抗HF藥物的療效差異、最佳治療時機以及療效機制。
資料和方法
實驗動物及分組SPF級雄性Wistar大鼠140只,體重為280~320 g,隨機分為對照組、AMI組、RD組、MI-1d+RD組(AMI后1天行RD)、MI-1d+Drugs組(AMI后1天予以藥物治療)、MI-4w+RD組(AMI后4周行RD)和MI-4w+Drugs組(AMI后4周予以藥物治療),每組各20只。所有動物均由復旦大學附屬中山醫院動物實驗研究中心提供。
心肌梗死模型制備Wistar大鼠禁食8 h,腹腔麻醉后,氣管插管,接大鼠呼吸機,呼吸頻率90次/分,潮氣量8~10 mL,記錄I、II、III、aVF、aVL、aVR、V1導聯心電圖。備皮消毒,沿左側第三肋間開胸,暴露左心耳,于左心耳下緣約1~2 mm處鄰近肺動脈圓錐的左冠主干附近的室間溝縫扎左冠狀動脈前降支。觀察到結扎后前降支供血區域心臟表面變白、心臟搏動減弱且心電圖顯示ST段抬高,以確認結扎成功。30 min后復測心電圖,ST段仍抬高者確認為模型成功。對照組及RD組僅縫線而不打結,其余各組同模型組。大鼠蘇醒后,杜冷丁鎮痛1次,肌肉注射青霉素2×105U/只,每日1次,連續注射3天[11]。
腎臟去神經模型制備大鼠麻醉后,腹部正中切口,分離雙側腎動脈,暴露出腎動脈主干,切除所有可見的與腎臟相關的腎神經束,并剝離腎臟動脈、靜脈血管外膜1~2 cm,將血管再浸潤在95%乙醇+10%苯酚的苯酚乙醇溶液中。對照組、AMI組、MI-1d+Drugs組及MI-4w+Drugs組僅暴露腎動脈。去神經效果檢驗:在RD前后,分別以Grass S48神經刺激器,15 V,0.2 ms,10 Hz刺激近腹主動脈端腎動脈腎神經10~30 s,觀察血壓、心率和腎臟組織顏色改變來確認去神經效果[11]。
給藥方案MI-1d+Drugs組及MI-4w+Drugs組大鼠分別在心梗后1天和4周開始予以酒石酸美托洛爾20 mg/kg,每天2次;培哚普利3 mg/kg,每天1次。藥物磨成粉狀后溶于生理鹽水中,以灌胃的方式給藥至干預后8周。余各組僅以生理鹽水2 mL/d灌胃至術后8周。
HR和SDNN測定AMI后2周及8周時分別記錄各組大鼠心電圖,通過計算機軟件獲得HR及SDNN。
左心功能檢測大鼠AMI后8周時麻醉后行心臟超聲檢查,獲得LVEF、左室內徑縮短率(left ventricular fraction shortening,LVFS)、左室舒張末期容積(left ventricular end-diastolic volume,LVEDV)及左室收縮末期容積(left ventricular end-systolic volume,LVESV)等指標,測量連續3個心動周期并取其平均值。
血漿BNP、腎素、血管緊張素Ⅱ、醛固酮、去甲腎上腺素水平檢測心臟超聲測定完成后,開胸直接心臟取血,以放射免疫法測定血漿BNP、腎素、Ang Ⅱ、ALD水平,以高效液相-電化學法測定血漿NE[11-13]。
心臟標本獲取及組織NE測定取血后立即取出心臟,生理鹽水洗凈,濾紙吸干,取左心室梗死區心肌液氮凍存后,-80 ℃冰箱儲存。心肌NE含量采用高效液相-電化學法測定。
結 果
一般情況共95只大鼠完成實驗,大鼠AMI模型制模成功率為58%。AMI組中11只、MI-1d+RD組中6只、MI-1d+Drugs組中7只、MI-4w+RD組中8只、MI-4w+Drugs組中10只大鼠在左前降支結扎后出現心臟驟停死亡,RD組中2只大鼠死于麻醉意外,1只大鼠因腎動脈破裂死于失血性休克。
RD及藥物治療對AMI后HF大鼠心功能影響心肌梗死8周時,AMI組大鼠的LVEF為36%、LVFS為17%、LVEDV為2.05 mL、LVESV為1.15 mL,血漿BNP為483 pg/mL,左心功能顯著下降。RD組大鼠的LVEF、LVFS、LVEDV、LVESV及血漿BNP較對照組無顯著差異(P>0.05),說明RD不影響健康大鼠的心功能。MI-1d+RD組大鼠較MI、MI-1d+Drugs及MI-4w+RD組LVEF均顯著增加(P<0.05,圖1),血漿BNP均顯著下降(P<0.05,表1)。大鼠M型心臟彩超顯示,在AMI后8周時,MI-1d+RD組大鼠較AMI組的左室收縮末期內徑和舒張末期內徑均明顯縮小(圖1)。提示:(1)AMI后早期RD改善心功能的作用強于β-blocker+ACEI藥物聯合治療;(2)大鼠AMI后1天進行RD治療對其心功能改善作用強于AMI后4周。

LVEF:Left ventricular ejection fraction;LVFS:Left ventricular fraction shortening;LVEDV:Left ventricular end-diastolic volume;LVESV:Left ventricular end-systolic volume.(1)vs. control group;(2)vs.AMI group,(3)vs. MI-1d+RD group,P<0.05.A:LVEF of all groups;B:LVFS of all groups;C:LVEDV of all groups;D:LVESVof all groups;E:M-mode echocardiography of the AMI group;F:M-mode echocardiography of the MI-1d+RD group;E shows increase of left ventricular end-systolic and end-diastolic diameter in AMI group,F shows decrease of left ventricular end-systolic and end-diastolic diameter in MI-1d+RD group.AMI:Acute myocardial infarction group;RD:Renal denervation;MI-1d+RD:RD one day after AMI;MI-1d+Drugs:drug therapy one day after AMI;MI-4W+RD:RD four weeks after AMI;MI-4W+Drugs:drug therapy four weeks after AMI.
圖1 心梗后8周時施行RD與藥物治療對AMI后HF大鼠心功能的影響
Fig 1 Effects of RD and drug therapy given to rats eight weeks post-AMI on cardiac function
RD及藥物治療對AMI后HF大鼠血漿腎素、Ang Ⅱ及ALD的影響AMI組大鼠的血漿腎素、Ang Ⅱ及ALD水平較對照組均顯著增加(P<0.05),RAAS系統激活;MI-1d+RD及MI-4w+RD組大鼠較AMI組血漿腎素、Ang Ⅱ及ALD水平均顯著下降(P<0.05);MI-1d+Drugs及MI-4w+Drugs組大鼠較AMI組僅血漿Ang Ⅱ及ALD水平顯著下降(P<0.05),腎素水平無顯著差異(P>0.05);其中MI-1d+RD組大鼠的血漿Ang Ⅱ、ALD水平較MI-1d+Drug組顯著下降(P<0.05,表1)。提示RD對AMI大鼠RAAS的抑制作用強于藥物。
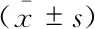
表1 心梗后8周時施行RD與藥物治療對AMI后HF大鼠血漿BNP、腎素、Ang Ⅱ及醛固酮的影響Tab 1 Effects of RD and drug therapy on plasma BNP,renin,Ang Ⅱ and ALD in rats eight weeks post-AMI
(1)vs. control group,(2)vs.AMI group,(3)vs. MI-1d+RD group,P<0.05.BNP:Brain natriuretic peptide.Other abbreviations in the table are the same as in figure 1.*The actual number of samples.
RD及藥物治療對AMI后HF大鼠血漿NE、梗死心肌NE及HR和SDNN的影響心肌梗死后8周時,AMI組大鼠較對照組大鼠血漿NE顯著增加[(1.96±0.3) ng/mLvs.(0.61±0.08) ng/mL,P<0.05],梗死心肌NE含量顯著減少[ (255±50) ng/gvs.(580±45) ng/g,P<0.05]。MI-1d+RD組、MI-1d+Drugs組大鼠較AMI組血漿NE顯著下降(P<0.05),梗死心肌NE含量、HR均顯著增加(P<0.05),SDNN顯著下降(P<0.05);較對照組大鼠,HR及SDNN差異無統計學意義。MI-4w+RD組、MI-4w+Drugs組大鼠較AMI組血漿NE顯著下降(P<0.05),梗死心肌NE、HR及SDNN均無顯著差異。圖2、圖3提示:心肌梗死后8周時,縫扎前降支方法制作的AMI大鼠模型,其SNS活性增加,但梗死區域心肌的交感神經活性減少,心臟呈現迷走神經過度興奮優勢;RD及藥物治療均能降低AMI大鼠SNS活性,大鼠AMI后1天進行RD或藥物治療能增加梗死區域心肌交感神經活性,并促進心臟交感-迷走神經功能平衡。

(1)vs. control group;(2)vs.AMI group,(3)vs. MI-1d+RD group,P<0.05.NE:Norepinephrine.Other abbreviations in the figure are the same as in figure 1.
圖2 心梗后8周時施行RD與藥物治療對AMI后HF大鼠血漿NE及梗死心肌NE的影響
Fig 2 Effects of RD and drug therapy given to rats eight weeks post-AMI on plasma and infarcted myocardium NE

(1)vs. control group;(2)vs.AMI group,(3)vs. MI-1d+RD group,P<0.05.A:Heart rate of all groups;B:SDNN of all groups;C:Electrocardiogram of AMI group;D:Electrocardiogram of MI-1d+RD group;HR:Heart rate;SDNN:Standard deviation of NN interval within 5 minutes.Other abbreviations are the same as in figure 1.
圖3 心梗后8周時RD與藥物治療對AMI后HF大鼠HR及SDNN的影響
Fig 3 Effects of RD and drug therapy given to rats eight weeks post-AMI on HR and SDNN
討 論
抑制AMI后過度激活的SNS及RAAS活性、改善心室重構是預防及治療AMI后HF的重要途徑。研究顯示,RD能延緩甚至逆轉HF的進展,改善心功能,并且無嚴重不良事件發生[7,9]。為探究RD與抗心力衰竭藥物改善AMI后HF療效的差異、對AMI的最佳治療時機以及療效機制,本研究通過對比RD與β-blocker+ ACEI藥物聯合治療對AMI后HF大鼠的心功能、RAAS、SNS和CANS功能的影響,觀察到RD糾正HF的作用強于β-blocker+ ACEI藥物聯合治療,并且RD同時具有抑制AMI大鼠RAAS、SNS及調節心臟交感-迷走神經功能平衡的作用。
RD對AMI后HF大鼠RAAS的影響腎動脈周圍分布有腎臟傳入神經與腎臟傳出神經[14],其中腎交感傳出神經遠端分布至腎動脈壁、腎小球旁顆粒細胞及腎小管,具有調控腎動脈的舒縮、腎素的分泌及腎小管水鈉重吸收等作用[15]。腎交感傳出神經興奮時,可導致腎素分泌增加[15],因此被認為與RAAS激活相關。本研究結果顯示RD治療能顯著抑制MI大鼠的RAAS活性,導致大鼠血漿腎素、Ang Ⅱ及ALD水平同步下降,其可能機制為:RD通過阻斷腎交感傳出神經,進一步抑制RAAS的激活。
阻斷腎交感傳出神經能夠抑制腎動脈的收縮和RAAS的激活,以及減少水鈉潴留,具有提高腎灌注、改善腎功能的作用。統計分析顯示,約50%的嚴重心力衰竭患者存在腎功能損害[16],因此探討RD在心功能不全合并腎功能不全患者中的應用指征及價值具有重要意義。研究證實,RD能夠延緩慢性腎臟病患者腎功能的惡化速度[17],合并腎功能不全的頑固性高血壓患者在實施RD治療后,腎小球濾過率得到改善,尿白蛋白含量和腎動脈阻力指數均下降[18-19]。Hopper等[20]進一步觀察了RD對HF合并腎功能不全患者的影響,在術后1年時,患者的血漿BNP顯著下降,而腎小球濾過率較術前無顯著變化,該研究初步驗證了RD治療HF合并腎功能不全患者的安全性及有效性。由于該臨床研究規模較小、無假手術對照組,因此未來仍需開展更大規模臨床試驗明確RD在慢性心力衰竭合并腎功能不全患者中的應用指征及價值。
RD對AMI后HF大鼠SNS及CANS的影響AMI后全身交感神經系統處于持續激活狀態[5],而心臟自主神經功能活性受心肌梗死區域與時段的影響[21-22]。心肌梗死后梗死區域自主神經早期過度刺激、后期出現神經壞死以及神經不均勻性重構,表現為梗死周邊區域交感神經過度再生,而梗死心肌交感神經再生稀少[23-24]。循環持續的高濃度兒茶酚胺導致心肌耗氧增加、促進心室重塑以及產生直接的心臟毒性作用,而心肌的不均勻神經再生支配使得心臟收縮功能不協調,這些因素均可導致心功能進行性惡化。
本研究顯示,RD對全身交感神經的抑制作用較藥物更為顯著。其原因可能為RD對交感神經中樞的直接調控作用。Zheng等[25]證實通過選擇性阻斷腎臟傳入神經可以恢復HF大鼠下丘腦室旁核中nNOS蛋白表達,從而減弱中樞交感神經興奮性。因此RD可能通過阻斷腎臟傳入神經、抑制中樞交感神經激活,繼而削弱全身交感神經系統的活性。
本研究觀察到,通過縫扎左前降支制作的AMI后HF大鼠模型在心肌梗死后8周時表現為心臟迷走神經激活優勢。可能原因為:心臟自主神經分布不均,左前降支供血區域具有豐富的心臟交感神經分布,而迷走神經相對較少[23],左前降支結扎后其供血區域心肌梗死,導致該區域豐富的交感神經壞死,因此出現心臟交感-迷走神經失衡狀態,表現為迷走神經激活優勢。本研究還觀察到,RD使梗死心肌區域的交感神經活性增加,促進了心臟交感-迷走神經的平衡。而Feng等[24]研究發現,RD能減少梗死心肌周邊區域的心肌交感神經再生。因此我們認為,RD能夠改善AMI后心臟自主神經重構的不均一性以及調節心臟交感-迷走神經功能失衡狀態,這對于改善心臟收縮功能,以及減少心律失常的發生具有重要意義。本研究顯示,AMI后1天進行RD治療,能夠改善心肌梗死大鼠心臟迷走神經過度激活優勢,而AMI后4周再進行RD治療則對心肌梗死大鼠心臟自主神經活性無顯著影響。由于心臟自主神經重構在心肌梗死后4周左右已基本完成[23],這進一步說明RD可能是通過改善心臟自主神經重構來調節心臟交感-迷走神經功能的平衡。
RD同時具有抑制AMI大鼠RAAS、SNS及調節心臟交感-迷走神經功能平衡等多方面的作用,AMI后早期進行RD治療對于預防及延緩AMI后HF發生與進展將具有重要的臨床意義。

