腹腔鏡胰管對黏膜胰腸吻合在胰腺中段切除術中的應用
徐建威,李 峰,葉乃寬,展翰翔,劉 晗,吳 棟,胡三元,王 磊
(1.山東大學齊魯醫院,山東 濟南,250012;2.山東第一醫科大學第一附屬醫院)
隨著良性與低度惡性腫瘤檢出率的提高及外科微創技術的發展,保留功能或臟器的胰腺微創手術得到快速發展,腹腔鏡腫瘤剜除術及胰體尾切除術(保脾/脾切除)已成為標準術式。但涉及到胰腺功能重建的術式,如胰腺中段切除術、保留十二指腸的胰頭切除術發展相對緩慢。自2003年Baca與Bokan首次施行腹腔鏡胰腺中段切除術(laparoscopic central pancreatectomy,LCP)以來[1],少有超過30例LCP的單中心報道[2]。一方面,由于手術適應證的局限性,單中心難以累計大宗病例;另一方面,胰腺功能重建時往往需要面對細胰管與軟胰腺,高難的腹腔鏡下吻合技術及較高的胰瘺發生率使部分外科醫生放棄,轉而尋求更為常規的術式,如胰十二指腸切除術或胰體尾切除術。針對細胰管與軟胰腺,能否完成高質量的胰腺功能重建,尤其精確的導管對黏膜胰腸吻合(pancreaticojejunostomy,PJ)仍存有爭議[3-5]。本研究回顧性分析我中心完成的20例LCP,探索腹腔鏡下細胰管與軟胰腺胰管對黏膜PJ的安全性及手術技巧。
1 資料與方法
1.1 臨床資料 收集2011年1月至2019年3月山東大學齊魯醫院普通外科完成的20例LCP患者,其中男5例(25%),女15例(75%),平均(42.5±14.4)歲。體重指數平均(24.3±4.5)kg/m2。
1.2 手術方法
1.2.1 體位及Trocar布局 患者取仰臥位,頭部抬高約30度。Trocar以臍部觀察孔為中心,呈“V”字分布,包括臍部觀察孔(10 mm Trocar)、右鎖骨中線平臍水平12 mm Trocar、右腋前線肋緣下5 mm Trocar、左鎖骨中線平臍水平5 mm Trocar,左腋前線肋緣下5 mm Trocar。
1.2.2 胰腺的顯露及游離 用超聲刀切開胃結腸韌帶,顯露胰腺,探查腫瘤。于胰頸部下緣解剖顯露腸系膜上靜脈、脾靜脈及門靜脈,貫穿胰后隧道;于胰腺上緣解剖肝總動脈,懸吊保護;距腫瘤右側約1 cm用切割閉合器或超聲刀切斷胰腺,斷端用4-0 Prolene線加強縫合。將胰腺向左上方牽拉,繼續向尾側解剖,距腫瘤左側約1 cm用超聲刀切斷胰腺。擴大臍部切口或取上腹正中切口取出標本,常規行術中冰凍切片檢查。
1.2.3 胰腺功能重建 本研究包括三種胰腺功能重建方式,分別為胰管對黏膜PJ、套入式PJ及胰胃吻合(pancreaticogastrostomy,PG)。(1)胰管對黏膜PJ:采用4-0 Prolene縫線連續縫合胰腺背側與空腸漿膜;然后胰管對側空腸打孔,行胰管對黏膜吻合,一般用5-0 PDS Ⅱ縫線連續縫合。距胰管末端2~3 mm處用縫針縫合,收緊時可外翻胰管,方便看清胰管內部,這樣的操作對于細胰管縫合是有利的;可置入胰管支撐管;完成胰管對黏膜吻合后,再用前述4-0 Prolene線連續縫合前壁。(2)套入式PJ與PG:采用4-0 Prolene縫線雙層連續縫合,完成吻合。
1.2.4 腸腸吻合及引流管 全腔鏡下或腹部小切口完成空腸側側吻合。分別于胰腺斷端、胰腸或胰胃吻合口后方放置引流管。
1.3 并發癥定義及分級 胰瘺、遲發性出血等發癥定義及分級參考《胰腺術后外科常見并發癥診治及預防的專家共識(2017)》[6]。并發癥嚴重程度分級參考Clavien-Dindo并發癥分級系統[7]。
1.4 統計學處理 采用SPSS 23.0軟件進行數據分析。計量資料以均值±標準差表示,采用Student’st檢驗或Mann-WhitneyU檢驗進行比較分析,計數資料以百分比(%)表示,采用χ2檢驗進行比較分析。
2 結 果
17例順利完成手術,3例中轉開腹。手術時間平均(338.1±88.1)min,術中出血量平均(262.5±304.7)mL,3例(15%)術中輸血。術后進食時間平均(3.2±0.8)d,平均住院(19.6±18.3)d。總體并發癥、胰瘺(B/C級)及遲發性出血發生率分別為40%(8/20)、40%(8/20)與15%(3/20)。病理診斷:實性假乳頭狀瘤6例、漿液性囊腺瘤5例、胰腺神經內分泌腫瘤3例,胰腺導管內乳頭狀黏液腫瘤2例,其他4例,其中1例患者術中冰凍病理考慮實性假乳頭狀瘤,術后石蠟切片診斷為胰腺導管腺癌,未行補充性根治手術。病理標本腫瘤直徑平均(3.7±1.6)cm。
胰腺功能重建包括胰管對黏膜PJ 12例(組1)、套入式PJ 5例及PG 3例(組2)。兩組在手術時間、術中出血及總體并發癥、胰瘺、遲發性出血發生率方面差異無統計學意義(P>0.05),見表1。但胰管對黏膜PJ術后住院時間[(10.5±5.4)min vs.(33.3±22.6)min,P=0.025]縮短,胰瘺(B/C級)及遲發性出血發生率(12% vs. 62.5%,P=0.167;0.9% vs. 25%,P=0.537)有降低的趨勢。
表1 不同胰腺功能重建方式的比較
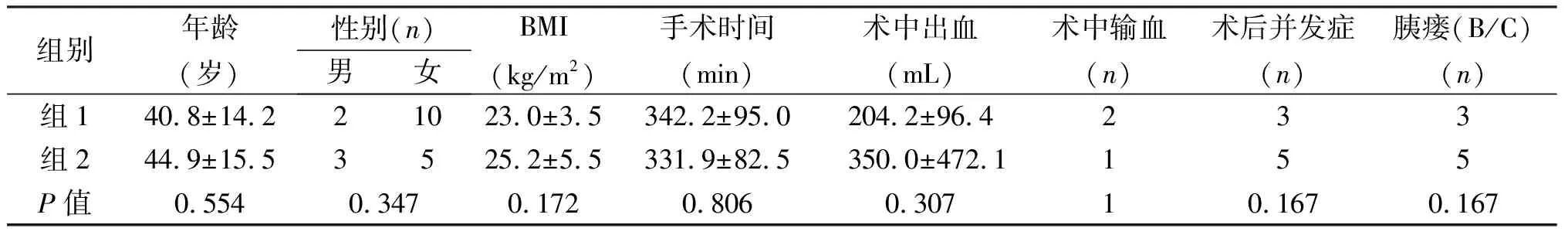
組別年齡(歲)性別(n)男女BMI(kg/m2)手術時間(min)術中出血(mL)術中輸血(n)術后并發癥(n)胰瘺(B/C)(n)組140.8±14.221023.0±3.5342.2±95.0204.2±96.4233組244.9±15.53525.2±5.5331.9±82.5350.0±472.1155P值0.5540.3470.1720.8060.30710.1670.167
續表1

組別遲發性出血(n)并發癥分級(n)2級及以下3級及以上病理標本腫瘤直徑(cm)術后進食時間(d)術后住院時間(d)組11213.7±1.72.9±0.310.5±5.4組22233.7±1.63.6±1.133.3±22.6P值0.53710.9120.1040.025
3 討 論
LCP是針對胰頸體部良性及低度惡性腫瘤保留功能的微創手術,這類腫瘤一般不引起胰管擴張,且病變遠端胰腺質地柔軟,腹腔鏡下胰腺功能重建難度大、技巧性強;尤其能否完成高質量導管對黏膜PJ,目前仍存有爭議。我們的研究結果表明,LCP術中可安全、高質量地實施胰管對黏膜PJ,并可顯著縮短術后住院時間,降低術后胰瘺及遲發性出血發生率。
胰腺中段切除術遠端胰腺功能重建主要有PJ及PG,各種吻合方式的胰瘺發生率差異無統計學意義。PJ仍是目前的主流吻合方式[8],導管對黏膜吻合及套入式吻合是主要的吻合方法。對于擴張的胰管,導管對黏膜吻合已得到廣泛接受與認可,與套入法相比,可顯著降低胰瘺發生率[9-10]。而對細胰管或軟胰腺,其價值存有爭議。部分薈萃分析及前瞻性研究發現,導管對黏膜吻合有增加胰瘺發生率的趨勢[3-5]。考慮到胰管對黏膜吻合對手術技巧要求較高,且對細胰管(<3 mm)很難做到精確吻合,從而導致吻合口狹窄或閉合,有學者不推薦腔鏡下完成此吻合。筆者認為,套入式吻合胰腺斷端暴露于腸腔且存在過度的胰腺縫合,可能增加術后出血等嚴重并發癥發生率;而充分發揮腹腔鏡高清、放大及角度優勢,并輔以合理的手術技巧,可在腔鏡下完成高質量的細胰管對黏膜吻合[11]。
筆者團隊經驗:(1)胰管準備:切斷胰腺時應明確主胰管位置,避免燒灼、閉塞主胰管,從而為胰腺功能重建增加困難。采用壓榨法切斷遠端胰腺,主動顯露主胰管與稍大的胰內血管,并在胰腺內游離主胰管((圖1A)),保證3~5 mm的胰管外露后用剪刀離斷(圖1B);也可用鈦夾夾閉后切斷,以利標記胰管位置。(2)胰腺準備:切斷胰腺后,繼續向遠端游離胰腺2 cm,以利吻合時牽拉胰腺,使胰腺斷面正對術者視野,提供合適的縫合角度,并減低吻合口張力。但應避免過度的胰腺游離導致斷端缺血。(3)吻合技巧:宜連續縫合,忌間斷縫合,盡量減少視野內縫線數量;力度適中,避免過度縫合。用4-0 Prolene線連續縫合胰腺背側與空腸漿膜(圖1C);然后胰管對側空腸打孔,行胰管對黏膜吻合,一般用5-0 PDS Ⅱ縫線連續縫合。距胰管末端2~3 mm處用縫線縫合,收緊時可外翻胰管,方便看清胰管內部(圖1D)。常規放置胰管支撐管(圖1E),既可引流胰液,也有助于顯露胰管黏膜、輔助縫合。完成胰管對黏膜吻合后,再用前述4-0 Prolene線連續縫合腹側胰腺及空腸漿膜(圖1F)。與套入法相比,該吻合法可能存在學習曲線更長、耗時更多的問題;筆者團隊也是在大量腹腔鏡胰十二指腸切除術的基礎上逐步掌握并熟練運用的,目前完成該吻合耗時20~30 min。盡管如此,胰腺功能重建還是應結合胰管直徑、胰腺質地及術者經驗,選擇最為熟悉的吻合方式。
總之,采用合理的手術技巧,LCP術中可完成高質量的細導管對黏膜PJ,顯著縮短術后住院時間,降低術后胰瘺及遲發性出血的發生率。但由于該研究為單中心、小樣本回顧性分析,研究結論仍需進一步論證。胰管對黏膜吻合方法較復雜,對手術技巧要求高,能否推廣、如何安全、快速渡過學習曲線仍是值得關注的課題。
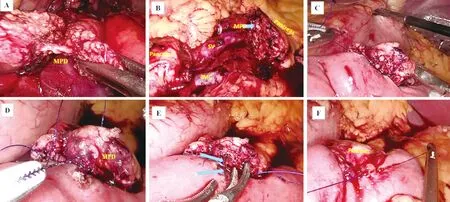
圖1 腹腔鏡胰腺切除術胰管對黏膜PJ(A:壓榨法顯露主胰管;B:保證3~5 mm的主胰管外露;C:連續縫合胰腺背側與空腸漿膜;D:胰管對黏膜吻合;E:放置胰管支撐管;F:胰腺腹側與空腸漿膜連續縫合)

