魚類III型Myosin基因家族成員的表達和功能研究*
趙呈天, 陳 哲, 馮 東
(中國海洋大學海洋生物多樣性與進化研究所,山東 青島 266003)
肌球蛋白(Myosin)是一個由多成員組成的超家族,對其最早的研究來源于骨骼肌細胞中II型肌球蛋白分子。人類細胞中存在超過40種肌球蛋白,分屬于12個不同的家族[1]。肌球蛋白家族成員之間差異較大,但都可以分成頭部、頸部和尾部三部分。肌球蛋白的頭部是與運動相關的馬達結構域,該結構在不同肌球蛋白成員間高度保守,是肌球蛋白分類的依據。肌球蛋白的頸部是連接頭部和尾部的一段α螺旋,可以結合肌球蛋白輕鏈和鈣調蛋白,來發揮其杠桿的作用。而肌球蛋白的尾部差異性較大,主要與其選擇性結合的“貨物(Cargo)”有關[1]。根據各種肌球蛋白的分子結構差異,一般將II型肌球蛋白稱為經典肌球蛋白,其它的稱為非經典肌球蛋白。其中,經典的肌球蛋白主要存在于肌細胞中,參與肌肉收縮等活動。非經典的肌球蛋白則在膜泡運輸、細胞極性建立、細胞膜突起形成等過程中發揮功能[2-3]。
研究表明,一些非經典肌球蛋白基因的突變,會導致毛細胞的功能異常以致聽力的喪失[4-8]。例如,肌球蛋白MyoXVa與包含PDZ結構域的蛋白whirlin以及肌動蛋白調節蛋白Eps8形成一個定位于聽纖毛(Stereocilia)頂端的復合體,其功能異常會導致小鼠內耳聽纖毛變短以及聽覺的異常[4-5]。而肌球蛋白MyoⅦa作為Usher I型綜合征(Usher syndrome type I, USH1)的致病基因,與USH1家族的其它成員形成復合體,共同參與內耳纖毛束的形態發生[6-8]。
脊椎動物的III型Myosin蛋白也屬于非經典的肌球蛋白,包含Myo3a和Myo3b兩個成員。研究表明,這兩個成員均在內耳耳蝸處表達[9-10],其中Myo3a基因的突變,會導致人常染色體隱形非綜合征性耳聾的發生[11-13]。小鼠中的研究表明,Myo3b基因的缺失并不會導致明顯異常,而Myo3a基因缺失會導致聽力喪失,且雙突變小鼠的耳聾表型更加嚴重[10]。進一步研究表明,上述表型的產生可能與Myo3a,Myo3b以及其所運輸的蛋白Espin-1的相互作用有關[14-16]。III型Myosin蛋白除了在耳蝸處定位以外,在眼睛的感光細胞中也有表達[17-18]。小鼠中的免疫染色結果表明,Myo3a和Myo3b在所有感光細胞的內節段均有定位[19]。同時,魚類中的研究表明,III型Myosin蛋白在視網膜中有表達,且在感光細胞中有定位[20]。這些結果均暗示III型Myosin蛋白可能在感光細胞中也發揮一定功能。
目前,對III型Myosin蛋白的研究主要集中在細胞以及小鼠中,其在魚類胚胎發育過程中的功能仍未見報導。與小鼠等哺乳動物相比,魚類雖然在進化地位上較低等,但仍然具有一定的優勢。首先,眼睛和內耳的發育在不同物種間相對保守,魚類視網膜及感光細胞的結構組成與人類有很高的相似性;其次,雖然魚類不具有哺乳動物的外耳和耳蝸等結構,但是具有類似的毛細胞和纖毛等結構,且與哺乳動物十分相似[21]。因此研究Myosin蛋白在魚類胚胎發育中的功能對研究毛細胞及感光細胞的發育及進化機制具有一定的幫助。
斑馬魚(Daniorerio)是一種典型硬骨魚類,具有飼養周期短、繁殖力強、胚胎透明等優點,同時其遺傳操作較為方便,在研究基因進化功能方面具有顯著優勢[22]。本研究中,以模式魚種斑馬魚為例,報導了III型Myosin基因家族成員在魚類胚胎早期發育過程中的表達模式及功能。首先利用整胚原位雜交技術確定斑馬魚myo3a和myo3b基因的時空表達圖譜,發現myo3a和myo3b在10體節之前均無表達。在受精后24 h的胚胎中,myo3a在腦部中表達,myo3b在神經管腹部腦脊液接觸的神經元中表達,此外二者共同在內耳中表達。其次利用CRISPR/Cas9技術對myo3a和myo3b基因進行敲除并對突變體進行分析,發現myo3a和myo3b的單獨缺失對斑馬魚胚胎發育并沒有影響。進一步,通過對雙突變進行分析,發現雙突變存在眼睛變小,魚鰾不能形成等現象,同時內耳毛細胞聽覺纖毛顯著變短,表明III型Myosin蛋白在斑馬魚發育過程中發揮功能。
1. 材料與方法
1.1 斑馬魚飼養
本研究中所使用的斑馬魚均為Tübingen品系。0~5 dpf (Days post fertilization, 受精后天數)的斑馬魚胚胎置于培養皿中培養,每天更換E3培養液(5 mmol/L NaCl, 0.17 mmol/L KCl, 0.33 mmol/L CaCl2, 0.33 mmol/L MgSO4)。5~30 dpf的幼魚放置在魚苗培養器中培養,每天喂養適量的草履蟲,并且根據幼魚的大小適量加入新鮮的豐年蝦。30 dpf以上的斑馬魚養殖在28.5 ℃恒溫水循環系統中,每天喂養適量的新鮮豐年蝦兩次,魚房保持14 h光照/10 h黑暗周期。
1.2 整胚原位雜交實驗
從斑馬魚的cDNA中擴增myo3a和myo3b基因特異的片段,基因信息獲取自NCBI網站(myo3a: AF384863.1;myo3b:XM_001920252.7),并通過Oligo 7軟件進行引物設計,序列如下:myo3a-F: 5’-TCCACCCCTGAAGAAATGAC-3’,myo3a-R: 5’-GCTTTGCCCTCCTCCTGTTG-3’;myo3b-F: 5’-TCAACATCGCTAACGAACAG-3’,myo3b-R: 5’-CGACCACCATCTTGGACAG-3’。擴增的片段連接至pEASY-T3載體(全式金,貨號:CT301),測序后根據片段插入方向選擇相應的RNA聚合酶,合成地高辛標記的反義RNA探針待用。實驗中urp1和pkd2l1探針信息參考之前的工作[23]。
整胚原位雜交采用標準流程,簡略如下:第一天,將保存在甲醇中的胚胎梯度水化至PBST,經多聚甲醛固定及蛋白酶K(Boehringer,貨號:1000144)處理后,加入HYB-雜交液(50%甲酰胺,5×SSC,0.1% Tween-20),64 ℃孵育5 min,之后用HYB+雜交液(HYB-,0.5 mg/mL酵母 tRNA, 0.05 mg/mL肝素)進行預雜交,最后加入探針64 ℃孵育過夜;第二天吸去探針,分別用50%甲酰胺/2×SSCT、2×SSCT、0.2×SSCT于64 ℃梯度洗脫,然后加入封閉液(10%山羊血清,2% Block reagent,MABT)室溫封閉1 h,最后加入偶聯堿性磷酸酶的地高辛抗體(Roche,貨號:11093274910),4 ℃孵育過夜;第三天吸去抗體,經MABT多次洗脫后,用BM purple顯色液顯色(Roche,貨號:11442074001)。
雙熒光原位雜交中,第二天抗體孵育時,加入偶聯過氧化物酶的地高辛抗體(Roche,貨號:11207733910)。第三天顯色時使用TSA放大顯色液(PerkinElmer, 貨號:NEL744E001KT)室溫顯色2 h,PBST清洗后梯度替換至甲醇中,使用1%過氧化氫/甲醇處理胚胎30 min后梯度替換至PBST中。并用PBST、MABT清洗胚胎,然后加入封閉液室溫封閉1 h后,加入偶聯過氧化物酶的熒光素抗體(Roche,貨號:11426346910)4 ℃孵育過夜。第四天吸去抗體,按照第三天的步驟洗去多余抗體后進行顯色。顯色后的胚胎保存于PBST中,使用徠卡SP8共聚焦顯微鏡拍照記錄。
1.3 基因敲除及突變體篩選
本實驗中使用CRISPR/Cas9技術對myo3a和myo3b基因進行了敲除,靶位點如下:myo3a-target: 5’-ACAGAGGTGCGGGACGCCAT-3’,myo3b-target: 5’-ATGTTTCTTCAGAAGCCCA-3’。突變體檢測引物如下:myo3a-P5: 5’-TATGCAGCACCCGCTTATC-3’,myo3a-P3: 5’-CAATAGCCCCAGCAAATAAG-3’;myo3b-P5: 5’-CATCAGTTATTTGCTCAGGGAG-3’,myo3b-P3: 5’-GCTAATCAAAAGGAGAAGTCGG-3’。
1.4 免疫組化
整胚免疫組化步驟如下:選取發育至5 dpf的斑馬魚胚胎,用4%多聚甲醛4℃固定過夜后,PBST、雙蒸水各洗2次,每次5 min。之后加入預冷的丙酮于-20 ℃通透10 min。然后用雙蒸水洗2次、PBST洗2次。用封閉液(2%山羊血清,1%BSA, 1% DMSO,PBST)室溫封閉1 h后,加入一抗,4 ℃孵育過夜。第二天吸去一抗,用PBD(1%BSA, 1%DMSO,PBST)洗4次,每次30 min,之后加入二抗,4 ℃避光孵育過夜。然后吸去二抗,用PBD洗4次,每次30 min,PBST洗2次,每次5 min。之后使用徠卡SP8共聚焦顯微鏡拍照記錄。實驗中使用的抗體比例:乙酰化微管蛋白抗體為小鼠單抗(Sigma, 貨號:T6793,1∶500),鬼筆環肽(Invitrogen, 貨號:A12379,1∶100),二抗為GAM546(ThermoFisher,貨號:A11018, 1∶500)。
2 結果
2.1 整胚原位雜交揭示myo3a和myo3b的時空表達模式
為了研究斑馬魚中myo3a和myo3b基因的表達情況,選取胚盾期(Shield)、尾芽期(Bud)、5體節,10體節以及發育24 h時的胚胎進行整胚原位雜交。結果表明,myo3a和myo3b在10體節期之前均沒有明顯表達(見圖1A、E, 部分數據未展示)。在24 hpf胚胎中,myo3a主要在腦部表達,并在端腦和間腦處高表達,同時在內耳部位可見明顯染色,在72 hpf的胚胎中,其表達仍集中在腦部(見圖1B~D)。myo3b的表達起始于14體節左右,在胚胎發育到24 hpf時,其表達主要集中在內耳以及腹部神經管區域,胚胎發育至72 hpf時內耳中仍有表達(圖1F~H, 部分數據未展示)。
為進一步研究myo3b的表達模式,分別檢測了該基因與腹部腦脊液接觸神經元相關標記基因urp1,pkd2l1的表達共定位情況[23]。雙熒光原位雜交染色結果表明,myo3b的表達與urp1有部分重合(見圖1I~K),而與pkd2l1的表達基本重合(見圖1L~N),表明myo3b可能在與腦脊液接觸的神經元中發揮功能。
2.2 myo3b的基因敲除及突變體表型分析
對myo3a和myo3b基因的表達分析表明,與人、小鼠類似,二者均在斑馬魚內耳中有表達,暗示其在內耳發育中發揮一定的功能。同時,myo3b在腦脊液接觸神經元中高表達,說明其可能參與調控了該神經元的生理活動。為進一步研究其功能,本研究利用CRISPR/Cas9技術構建了相關突變體。
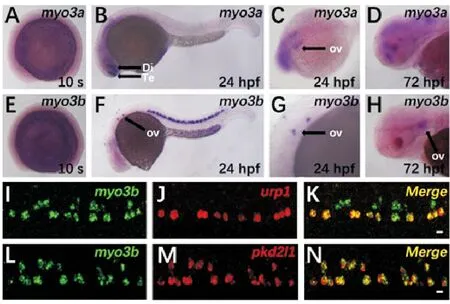
((A~H)myo3a和myo3b在10體節期(10 s)、24和72 hpf的原位雜交結果。Te: 端腦,Di:間腦,Ov: 耳泡。(I-N)24 hpf胚胎的urp1、pkd2l1和myo3b的雙熒光原位雜交結果。比例尺=10 μm。(A~H) Whole mount in situ hybridization results ofmyo3aandmyo3bat 10-somite stage (10 s), 24 hpf and 72 hpf. Te: Telencephalon, Di: Diencephalon, Ov: Otic vesicle. (I~N) Double fluorescence in situ hybridization results ofurp1,pkd2l1andmyo3bat 24 hpf. Scale bar=10 μm.)
圖1myo3a和myo3b在斑馬魚中的表達圖譜
Fig.1 Expression pattern ofmyo3aandmyo3bin zebrafish
斑馬魚myo3b基因有2個轉錄本,其中最長的轉錄本包含35個外顯子,開放閱讀框全長為3 816 bp,編碼1 272個氨基酸。myo3b基因的Cas9靶位點設計在第21個外顯子上,為兩個轉錄本共享外顯子,該區域編碼斑馬魚Myo3b蛋白的動力結構域。通過篩選,獲得了缺失2 bp的突變體,該突變破壞了原基因組的NcoI酶切位點(見圖2A~D),對兩種轉錄本均造成閱讀框移碼以及翻譯的提前終止。同時,qPCR和原位雜交結果顯示,突變體中myo3b的表達量明顯下調(見圖2E、F),表明在突變體中發生了無義mRNA導致的降解現象[24-25]。
接著,對突變體胚胎早期的發育過程進行分析。首先,熒光原位雜交結果顯示,myo3b突變體中腦脊液接觸神經元的標記基因urp1和pkd2l1的表達無明顯變化,表明myo3b的缺失不影響該神經元的形成(見圖2F)。之后,利用抗乙酰化微管蛋白的抗體對內耳毛細胞的動纖毛(Kinocilia)進行染色。結果顯示,myo3b突變體中內耳Crista和Macula的動纖毛無明顯異常(見圖3A、B)。同時,利用鬼筆環肽對內耳Crista和Macula中肌動蛋白組成的聽纖毛(Stereocilia)進行染色,也沒有發現明顯異常(見圖3A、B)。此外,純合突變體成魚可以存活并正常傳代,表明myo3b基因的單獨缺失不影響斑馬魚胚胎的發育。
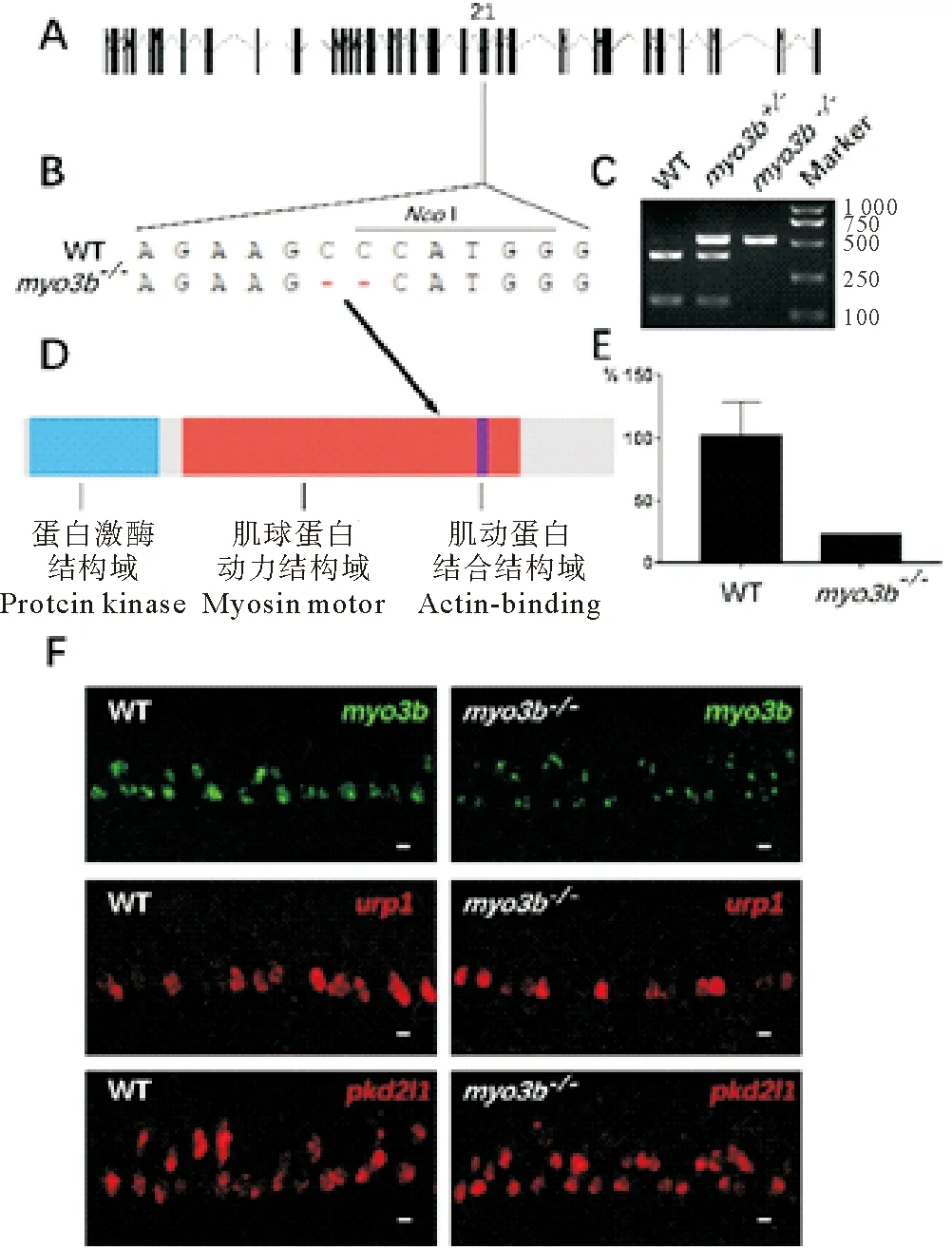
((A)myo3b的基因組結構。(B)野生型及突變體基因序列信息及突變位點導致的NcoI酶切位點變化。(C)野生型,雜合體以及純合突變體NcoI酶切的電泳結果,野生型的PCR產物(525 bp)可以被切成385和140 bp兩個片段,而純合突變體無法切開。(D)Myo3b蛋白的結構示意圖,箭頭指示突變位點在蛋白上對應的位置。(E)qPCR結果顯示24 hpf野生型及myo3b突變體胚胎中myo3b基因的相對表達量。(F)24 h野生型和myo3b突變體中myo3b、urp1和pkd2l1熒光原位雜交結果。比例尺=10 μm。WT:野生型。(A) Genomic structure ofmyo3b. (B) Sequences of wild type (WT) and mutant alleles. TheNcoI restriction site of the wild type allele is also labeled. (C) Genotype results of wild type, heterozygote and homozygote embryos. In wild type allele, the 525 bp PCR products can be digested into 385 bp and 140 bp fragments. (D) Diagram showing the structure domains of Myo3bprotein. Arrow indicates the position of the mutation site. (E) qPCR results showing relative expression ofmyo3bin 24 hpf wild type andmyo3bmutants. (F) Fluorescence in situ hybridization results ofmyo3b,urp1 andpkd2l1 in wild type ormyo3bmutant embryos. Scale bar=10 μm.WT:Wild type.)
圖2myo3b突變體的構建及表型分析
Fig.2 Generation and phenotypic analysis ofmyo3bmutant
2.3 myo3a的基因敲除及突變體表型分析
myo3b突變體發育無顯著異常,本研究推測可能是由于Myo3a功能冗余所造成。為此,進一步對myo3a基因進行了敲除。斑馬魚myo3a基因有3個轉錄本,其中最長的轉錄本包含38個外顯子,開放閱讀框全長為5 325 bp,編碼1 775個氨基酸。在3個轉錄本共享的第19外顯子上設計了Cas9靶位點(見圖4A、B)。通過篩選,獲得了缺失5 bp的突變體,該突變破壞了此處的NcoI酶切位點,造成移碼突變,導致編碼的Myo3a蛋白的動力結構域出現異常(見圖4A~D)
與myo3b突變體類似,myo3a的突變體也可正常發育,對其內耳處纖毛的染色結果表明該突變體中Crista和Macula的纖毛基本正常(見圖4E、F),同時鬼筆環肽的染色也沒有發現差異(見圖4E、F),這一結果與小鼠突變體并不完全相同[10]。
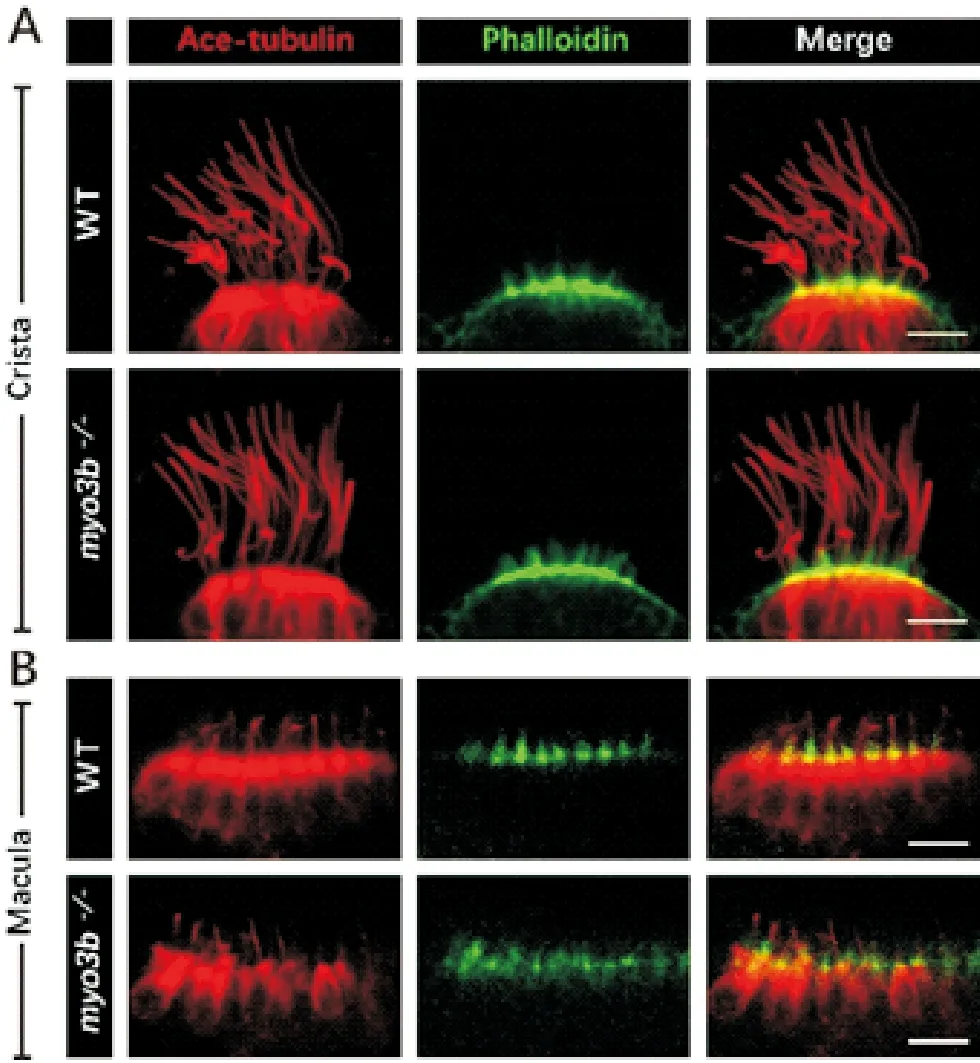
((A)內耳Crista毛細胞染色結果。(B)內耳Macula毛細胞染色結果。紅色為抗乙酰化微管蛋白抗體所標記的動纖毛,綠色代表鬼筆環肽標記的聽纖毛。比例尺=10 μm。(A) Immunostaining results of inner ear crista hair cells. (B) Immunostaining results of inner ear macula hair cells. Red channel shows kinocilia visualized by anti-acetylated α-tubulin antibody, green channel shows stereocilia visualized with phalloidin. Scale bar=10 μm.)
圖3 受精后5天的野生型及myo3b突 變體內耳毛細胞表型分析
Fig.3 Phenotypes of inner ear hair cells of 5 dpf wild type andmyo3bmutants
2.4 myo3a和myo3b雙突變的表型分析
由于myo3a和myo3b突變體均無明顯的發育異常,進一步將兩個突變體進行雜交并篩選得到了雙突變體。與野生型胚胎相比,雙突變體胚胎的眼睛顯著變小(p<0.001),同時魚鰾不能充氣(見圖5A、B)。進一步免疫組化結果表明,雙突變體視網膜分層并無明顯異常,感光細胞形態也基本正常,表明雙突變僅延緩了視網膜整體的發育進程(見圖5 C)。最后,對雙突變胚胎的內耳毛細胞進行了研究,染色結果表明內耳Crista的動纖毛變短,同時鬼筆環肽所標記的聽纖毛也變短(見圖5D、E)。以上結果表明,Myo3a和Myo3b在斑馬魚早期胚胎發育過程中發揮功能,同時其在調控內耳毛細胞聽纖毛發育方面也具有一定的進化保守性。
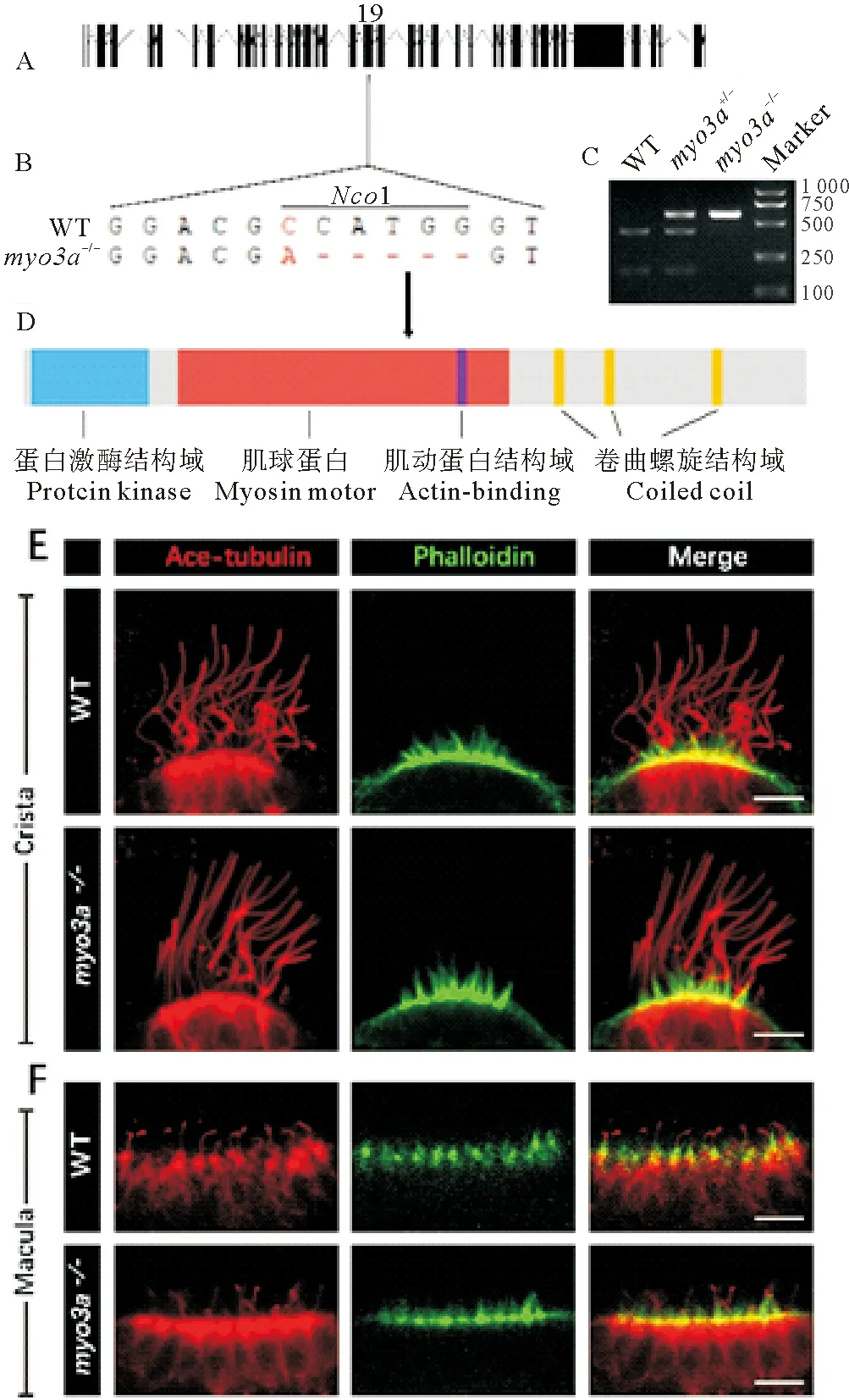
((A)myo3a的基因組結構。(B)野生型及突變體基因序列信息及相應的NcoI酶切位點。(C)野生型,雜合體以及純合突變體NcoI酶切的電泳結果,野生型PCR產物(596 bp)可以被切成422和174 bp片段,而純合突變體無法切開。(D)Myo3a蛋白的結構示意圖,箭頭指示突變位點在蛋白上對應的位置。(E)內耳Crista纖毛染色。(F)內耳Macula纖毛染色。紅色為抗乙酰化微管蛋白抗體染色,綠色代表鬼筆環肽染色。比例尺=10 μm。(A) Genomic structure ofmyo3a. (B) Sequences of wild type and mutant alleles. TheNcoI restriction site of the wild type allele is also labeled. (C) Genotype results of wild type, heterozygote and homozygote embryos. In wild type allele, the 596 bp PCR product can be digested into 422 bp and 174 bp fragments. (D) Diagram showing the structure domains of Myo3aprotein. Arrow indicates the position of mutation site. (E) Immunostaining results of crista hair cells; (F) Immunostaining results of macula hair cells. The red and green channels are the same as
Fig. 3 Scale bar=10 μm.)
圖4myo3a突變體構建及內耳纖毛染色
Fig.4 Phenotype ofmyo3amutants

((A)野生型及myo3a/myo3b雙突變體外觀圖,箭頭指示魚鰾。(B)野生型和myo3a/myo3b雙突變胚胎眼睛面積統計。(C)野生型和myo3a/myo3b雙突變眼睛免疫染色結果。紅色由zpr-1抗體標記雙錐細胞,綠色由鬼筆環肽標記,藍色由DAPI標記細胞核。(D)內耳Crista纖毛染色。紅色由乙酰化微管蛋白抗體標記,綠色由鬼筆環肽標記。(E)野生型及突變體內耳Crista聽纖毛長度統計。比例尺=10 μm,***,p<0.001。(A) External phenotype of wild type andmyo3a/myo3bdouble mutants. Arrows indicate the swim bladder of wild type larva. (B) Statistical results of the eye size in wild type ormyo3a/myo3bdouble mutants. (C) Immunostaining results of sections through the central retinae of wild type andmyo3a/myo3bdouble mutants. Staining with zpr-1 antibody is showed in red, phalloidin is showed in green, nucleus is labeled with DAPI in blue. (D) Immunostaining results of the inner ear crista. Staining with anti-acetylated α-tubulin antibody is showed in red, and stereocilia is labeled with phalloidin in green. (E) Dotted plots of the length of stereocilia in the inner ear crista of wild type and double mutants. Scale bar=10 μm.***,p<0.001.)
圖5myo3a/myo3b雙突變表型分析
Fig.5 Phenotypes ofmyo3a/myo3bdouble mutants
3 討論
本文中首次對斑馬魚III型Myosin基因家族成員myo3a和myo3b進行了研究。整胚原位雜交結果顯示myo3a及myo3b均在斑馬魚的內耳中表達,暗示二者在調控內耳毛細胞發育過程中有一定的功能。在對這兩個基因進行敲除后,發現myo3a或myo3b的單獨缺失對內耳發育無顯著影響,但在雙突變胚胎中,內耳Crista聽纖毛的發育存在明顯異常,表明二者功能存在冗余。這一點在小鼠中也有類似結論,例如小鼠Myo3b突變體聽纖毛無明顯異常,Myo3a的突變體僅有輕微聽覺障礙,而雙突變小鼠聽力顯著下降,主要原因是因為內耳聽纖毛排列異常所導致[10]。
但目前僅發現在內耳Crista毛細胞中存在發育異常現象,Macula纖毛并未發現明顯異常。推測斑馬魚等硬骨魚類存在基因擴增現象導致的基因功能冗余,可能是對這種現象的一種解釋。雖然僅僅鑒定出該家族的Myo3a及Myo3b兩個成員,不排除該家族中有未知成員的存在,同時其它Myosin家族也在內耳中高表達[26],可能在魚類內耳中發揮更重要的功能。
有趣的是,myo3b基因除了在斑馬魚內耳中有表達之外,在24 hpf胚胎的神經管中也有十分特異的表達,且該表達模式與pkd2l1基因基本一致。pkd2l1主要在腦脊液接觸的神經元中表達,在調控胚胎運動方面發揮重要功能[27],這些結果暗示Myo3b可能在調控該神經元的發育以及胚胎運動方面發揮作用。近期的一篇研究結果也指出Myo3b可能定位在該神經元接觸腦脊液一側的“花環”狀結構中[28],這一點也與本研究的結果一致。雖然urp1以及pkd2l1在myo3b突變體中表達無明顯異常,但該腦脊液神經元的生理功能可能受到了影響,未來利用膜片鉗等方法研究雙突變體中該神經元的生理功能以及其所調控的胚胎運動缺陷機制是一個重要研究方向。

