GnRH-a降調節-HRT內膜準備方案在PCOS首次FET移植失敗人群中的應用
孫曉曉,李歡,李東晗,陳圓輝,王雪,張翠蓮
(河南省人民醫院,河南省生殖醫院,鄭州大學人民醫院,鄭州 450003)
多囊卵巢綜合征(PCOS)是一種以月經稀發、高雄激素血癥、胰島素抵抗、不孕為主要特征的育齡期女性最常見的內分泌疾病。據文獻報道,PCOS患者在體外受精-胚胎移植(IVF-ET)治療中卵巢過度刺激綜合征(OHSS)的總發生率高達20%~30%[1]。隨著玻璃化冷凍技術的發展,凍融胚胎移植(FET)作為IVF-ET的重要衍生技術在臨床上得到了廣泛應用,其有效降低了OHSS的發生風險[2]。而FET周期中的胚胎發育潛能、子宮內膜容受性及子宮內膜與胚胎發育的同步性是影響FET臨床妊娠結局的主要因素,因此選擇合理的內膜準備方案至關重要。降調節方案最早應用于臨床,但逐漸被非降調節方案取代,近期文獻提示應用長效GnRH-a降調節后人工周期內膜方案可能改善PCOS患者的FET結局[3]。結合降調節FET在本中心的應用情況,本文通過回顧性分析2016年1月至2019年5月河南省人民醫院生殖中心行FET的PCOS患者的臨床資料,探究降調節FET在有1次移植失敗史的PCOS人群中的應用。
資料與方法
一、研究對象
2016年1月至2019年5月于河南省人民醫院生殖中心行FET的PCOS患者。
納入標準:按照2003年歐洲人類生殖和胚胎年會與美國生殖醫學學會(ESHRE/ASRM)修訂的鹿特丹標準診斷為PCOS的患者;因卵巢過度刺激或其他原因行全胚冷凍的患者;首次FET失敗行第二周期FET的患者。
排除標準:患者雙方任何一方有染色體異常;子宮畸形;有子宮內膜結核病史;宮腔粘連;子宮腺肌癥或者子宮肌瘤壓迫宮腔者;有輸卵管積水或宮腔積液;子宮內膜息肉;植入前胚胎遺傳學診斷(PGD)/植入前胚胎遺傳學篩查(PGS)周期;轉化日內膜<7 mm的患者。
共納入符合標準的553個FET周期。根據在子宮內膜準備過程中是否應用長效GnRH-a降調節,將553個周期分成2組:降調節-激素替代治療(HRT)組(A組,221個周期),HRT組(B組,332個周期);再根據胚胎情況分為不同亞組:降調節-HRT卵裂期組(A1組,101個周期),HRT卵裂期組(B1組,122個周期 ),降調節-HRT囊胚組(A2組,120個周期),HRT囊胚組(B2組,210個周期)。
二、診療回顧
1.胚胎來源:卵巢刺激方案主要包括早卵泡期長效長方案、黃體中期短效長方案及拮抗劑方案,IVF-ET均按本中心常規進行。取卵后第3天(卵裂期胚胎)或者第5~6天(囊胚)根據患者情況評估,將可利用胚胎進行移植,達到冷凍標準的胚胎進行凍存,擇期行FET。
2.內膜準備:本中心對于因各種原因行全胚冷凍首次FET的PCOS患者,常規行單純人工周期內膜準備方案,對有1次移植失敗史的患者再次FET時部分患者行降調節后人工周期準備內膜方案。
降調節FET:于月經周期第2~4天皮下注射GnRH-a(達菲林,博福-益普生,法國),注射后第14天,當達到降調標準時給予補佳樂(拜耳,德國)3~4 mg/次,2次/d,口服,一周后行陰道B超檢查監測卵泡發育及子宮內膜厚度與聲像情況,根據子宮內膜厚度情況決定是否添加17β-雌二醇片(芬嗎通紅片,雅培制藥,美國)。當子宮內膜厚度≥7 mm時給予地屈孕酮片(達芙通,蘇威制藥,荷蘭,10 mg/片)10 mg口服,3次/d,聯合8%黃體酮陰道緩釋凝膠(雪諾同,默克雪蘭諾,德國,90 mg/支)90 mg陰道給藥,1次/d,或黃體酮軟膠囊(安琪坦,法杏大藥廠,法國,100 mg/粒)200 mg陰道給藥,2次/d,轉化內膜。轉化后第4天移植卵裂期胚胎,第6天移植囊胚期胚胎。
單純人工周期:月經第2~4天給予補佳樂,期間藥物調整同降調節FET,當子宮內膜厚度≥7 mm時給予地屈孕酮片口服,10 mg,每日2次,聯合8%黃體酮陰道緩釋凝膠90 mg陰道給藥,1次/d,或黃體酮軟膠囊200 mg陰道給藥,2次/d,轉化內膜。轉化后第4天移植卵裂期胚胎,第6天移植囊胚期胚胎。
3.黃體支持:轉化日開始直到移植14 d查血HCG≥30 U,建議繼續用藥,直到移植后35 d開始逐漸減藥。
4.胚胎復蘇及移植:所有胚胎均采用玻璃化冷凍與快速復溫法復蘇。優質胚胎:第3天(D3)卵裂期胚胎,卵裂球數目為7~9個,胞質均勻,形態規則,碎片<10%或囊胚評分在3BB及以上。不符合優質胚胎標準的為非優質胚胎。
5.妊娠結局判斷:移植后14 d抽血測血清β-HCG,移植后第4~5周在陰道超聲下見妊娠囊、胎芽及胎心搏動者確定為臨床妊娠。
6.觀察指標:比較A組與B組、C組與D組患者的一般情況及臨床結局相關指標,如:胚胎種植率、臨床妊娠率、異位妊娠率、早期流產率。移植后28 d行B超檢查,有孕囊者為臨床妊娠;異位妊娠記為臨床妊娠。早期流產定義為孕12周內自然流產。
三、統計學方法
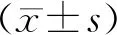
結果
一、A組與B組一般資料、實驗室指標及妊娠結局比較
共納入符合入組標準的553個周期,總妊娠率為64.92%。A組與B組的平均年齡、不孕年限、體重指數(BMI)、移植胚胎個數、內膜厚度等比較均無顯著性差異(P>0.05);B組的囊胚移植比例顯著高于A組,卵裂期胚胎移植比例顯著低于A組(P<0.05)(表1)。兩組的妊娠結局比較,種植率、臨床妊娠率、早期流產率及宮外孕率均無顯著性差異(P>0.05)(表2)。
二、A1組與B1組一般資料、實驗室指標及妊娠結局比較
A1與B1組間比較,一般資料及實驗室各指標均無顯著性差異(P>0.05)(表3)。兩組的妊娠結局比較,A1組的臨床妊娠率、胚胎種植率有高于B1組的趨勢,早期流產率有低于B1組的趨勢,但均無顯著性差異(P>0.05)(表4)。
三、A2組與B2組一般資料、實驗室指標及妊娠結局比較
A2與B2組間比較,其一般資料及實驗室指標均無顯著性差異(P>0.05)(表5)。兩組的臨床妊娠率、胚胎種植率、早期流產率及宮外孕率相近,組間比較均無顯著性差異(P>0.05)(表6)。
四、Logistic回歸分析結果
以臨床妊娠為因變量,對平均移植胚胎數、平均移植優胚數、子宮內膜厚度、是否應用降調節-HRT內膜準備方案等因素進行Logistic回歸分析提示:總數據:平均移植胚胎數、平均移植優胚數、是否為囊胚移植是入組所有患者臨床妊娠的主要影響因素;卵裂期胚胎移植組:平均移植胚胎數、是否行GnRH-a降調節是臨床妊娠的主要影響因素;囊胚移植組:平均移植胚胎數、平均移植優胚數是臨床妊娠的主要影響因素(表7)。
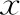
表1 A、B兩組患者一般資料及實驗室指標比較[(-±s),%]
注:與A組比較,*P<0.05

表2 A、B兩組患者妊娠結局比較(%)
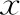
表3 A1、B1組患者一般資料及實驗室指標比較(-±s)

表4 A1、B1組患者妊娠結局比較(%)
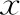
表5 A2、B2組患者一般資料及實驗室指標比較(-±s)

表6 A2、B2組患者妊娠結局比較(%)

表7 臨床妊娠結局相關影響因素Logistic回歸分析
討論
PCOS患者行IVF助孕時獲卵及可利用胚胎數較多,同時PCOS患者因OHSS高危傾向而行全胚冷凍擇期行FET的人群越來越多。Chen等[4]的一項多中心隨機對照試驗(RCT)研究表明,PCOS患者行FET較新鮮胚胎移植具有更高的活產率及更低的OHSS發生風險。國外的一項Meta分析也提示在高反應人群中,FET的活產率要高于新鮮移植活產率[2]。因此本研究比較降調節內膜準備方案在首次FET移植失敗的PCOS患者中的應用。
一項納入FET助孕失敗、尚有冷凍胚胎的PCOS患者研究的結果提示,對于有移植失敗史的PCOS患者,降調節-HRT方案準備子宮內膜其FET周期臨床妊娠率及種植率均顯著高于HRT組FET周期妊娠結局[5]。但此研究未排除反復移植失敗對研究結局的影響,而本研究篩選行全胚冷凍的PCOS患者首次FET失敗再次行FET的患者,排除了這一影響因素。張京順等[3]認為對曾有過移植失敗史的PCOS患者FET周期應用降調節-HRT方案準備子宮內膜,可以改善FET周期臨床結局。但該研究未對卵裂期胚胎移植及囊胚移植進行分組分析,本研究在進行分組分析后發現降調節-HRT在首次FET失敗后的PCOS患者行卵裂期胚胎移植時可以改善臨床結局,但在囊胚組并未觀察到此現象。之前有回顧性隊列研究分析提示,對于有高雄激素血癥的PCOS患者行FET時,GnRH-a降調節-HRT周期準備內膜相比于直接替代周期方案準備內膜能增加持續妊娠率,臨床妊娠率無明顯差別[6]。國外學者Hill等[7]認為,在囊胚移植中HRT內膜準備方案可以得到較好的妊娠率,而降調節可以使內膜與胚胎更同步,可以得到更高的活產率。本研究結果提示對于首次FET失敗的患者再次行囊胚移植時,是否應用降調節-HRT內膜準備方案對臨床結局無影響。
Logistic回歸分析顯示,是否應用GnRH-a、平均移植胚胎數為卵裂期胚胎移植臨床結局的影響因素。提示排除混雜因素的影響后,降調節-HRT是首次FET移植失敗的PCOS患者行卵裂期胚胎移植時臨床結局的影響因素,可能因數據量偏小,獨立樣本t檢驗統計學無差異,后續研究需要繼續擴大樣本量進一步分析探討。既往也有研究表明移植2個胚胎改善妊娠結局[7],本研究結果與之相似,認為移植胚胎個數是臨床結局的影響因素,但臨床工作中控制移植胚胎個數,降低雙胎或多胎妊娠率,減少母嬰并發癥也是臨床中的重點工作之一。本研究結果顯示流產率及宮外孕率各組間比較無顯著性差異,這和之前一些文獻[3-8]研究結果一致。
關于其可能的影響機制探討,之前國內一項RCT研究提示,超生理劑量的E2水平可能影響PCOS人群妊娠結局[9]。郭燕紅等[10]發現長期應用大劑量雌激素會致小鼠子宮內膜著床窗口期縮短。GnRH-a降調節后可能通過抑制內源性雌激素水平,形成低雌內環境,提高子宮內膜容受性,改善胚胎和子宮內膜同步性,從而改善臨床結局。PCOS患者的血清FSH/LH多呈倒置狀態,體內過高LH水平會使子宮內膜過早轉化,內膜發育與胚胎著床不同步,導致胚胎種植率下降[11-12]。國內一項回顧性研究提示,降調節方案可明顯降低移植前后的LH水平,增加種植率和臨床妊娠率[13]。但本研究未涉及降調節前后及各組間激素水平的比較,且尚未隨訪到活產率是本研究的不足之處,后期會進一步完善實驗設計加以探討。國外有學者研究表明,新鮮周期HCG注射日孕酮升高、子宮內膜過早轉化影響卵裂期胚胎妊娠結局,而對囊胚移植卻沒有影響[14],在FET周期中GnRH-a降調節后可能通過降低移植前LH水平,抑制子宮內膜過早轉化,從而改善卵裂期胚胎移植結局,對囊胚移植亦無影響。另有研究表明囊胚相對于卵裂期胚胎具有更好的發育潛能,著床過程更符合生理狀態,與子宮內膜種植窗具有更好的同步性[15-16],降調節內膜準備方案在卵裂期胚胎移植組可以通過提高卵裂期胚胎和子宮內膜同步性,從而改善臨床結局,卻不影響囊胚移植的臨床結局。
綜上所述,GnRH-a降調節內膜準備方案在首次FET失敗的PCOS患者行卵裂期胚胎移植時可能改善臨床結局,但需要前瞻性或更大樣本量的研究去深入探究。

