過表達長鏈非編碼RNA CTC-459F4.3抑制肝癌細胞的增殖和遷移
張 軍,吳一凡,張茂娜,江 悅,江 忍,張 弘*
(1湖北省鄂州市中心醫院病理科,鄂州 436000;2三峽大學醫學院形態學教研室;*通訊作者,E-mail:zmn0306@126.com)
肝癌是我國常見的惡性腫瘤之一,具有較強的增殖和遷移能力,患者通常預后較差[1]。肝癌發生、發展的分子機制尚未明確,尋求調控肝癌發病的分子標志物對抑制肝癌的惡性生物學行為具有重要的臨床意義。長鏈非編碼RNA(long-chain non-coding RNA,lncRNA)是一類長度超過200個核苷酸的非編碼RNA,參與調控基因表達,影響疾病特別是腫瘤的發生、發展[2]。越來越多的lncRNA被報道在肝癌的惡性生物學行為中發揮關鍵作用,并與肝癌患者的預后有關[3,4]。CTC-459F4.3是一種新確定的lncRNA,其在肝癌中的表達及作用機制尚不明確。本研究通過檢測CTC-459F4.3在肝癌組織和細胞株中的表達并構建攜帶CTC-459F4.3的質粒,旨在探討過表達CTC-459F4.3對肝癌細胞增殖和遷移的影響及作用機制。
1 材料與方法
1.1 組織標本及細胞株
收集2017-04~2018-08武漢大學人民醫院鄂州醫院普外科肝癌手術切除標本28例。所有組織標本經術后病理科醫生證實。所有患者均未行術前放療和化療。本研究經本院倫理委員會批準,患者均簽署知情同意書。肝癌細胞株(Huh7、SMMC-7721、MHCC-97H和BEL-7404)以及人正常肝細胞(LO2)購自中國典型培養物保藏中心。
1.2 主要試劑
DMEM培養基和胎牛血清購自美國Gibco公司。攜帶無意義序列的陰性對照質粒和攜帶CTC-459F4.3的質粒購自廣州銳博生物科技有限公司。qPCR引物購自上海生物工程股份有限公司。qPCR試劑盒購于日本TaKaRa公司。LipofectamineTM3000購自美國Invitrogen公司。四甲基偶氮唑藍(MTT)試劑盒購自美國Sigma公司。Transwell小室購自美國corning公司。GAPDH、Rb、p-Rb、CTDSPL、PCNA、MCM7、E2F1蛋白抗體購自英國Abcam公司(蛋白編號分別為ab8245、ab181616、ab47763、ab36839、ab92552、ab2360和ab218527)。
1.3 細胞培養和轉染
在37 ℃、5% CO2培養箱中,肝癌細胞株(Huh7、SMMC-7721、MHCC-97H和BEL-7404)以及正常肝細胞(LO2)均采用含10%胎牛血清的DMEM培養基培養。以對數生長期的SMMC-7721細胞為轉染對象,根據LipofectamineTM3000說明書轉染。細胞隨機分為陰性對照組(轉染攜帶無意義序列的陰性質粒)和CTC-459F4.3組(轉染攜帶CTC-459F4.3的質粒)。轉染后細胞常規培養48 h,進行后續實驗。
1.4 qPCR檢測組織或細胞中CTC-459F4.3和CTDSPL mRNA的表達
組織或細胞總RNA采用Trizol法提取,檢測RNA純度,并將吸光度為1.8-2.0的RNA逆轉錄為cDNA。組織或細胞中CTC-459F4.3和CTDSPL mRNA的表達采用qPCR試劑盒檢測,反應條件為96 ℃ 5 min、95 ℃ 5 s、62 ℃ 30 s、72 ℃ 30 s,38個循環,GAPDH為內參。以2-ΔΔCt方法計算CTC-459F4.3和CTDSPL mRNA在肝癌組織或細胞中的表達量。qPCR引物見表1。
表1 檢測CTC-459F4.3和CTDSPL mRNA表達的qPCR引物序列
Table 1 The qPCR primer sequences for detecting CTC-459F4.3 and CTDSPL mRNA expression

基因 序列(5′-3′) CTC-459F4.3上游:GGGCATGCTGGTAATAGTGTC下游:TGCTGAGACTGTAGTCCCATAGCCTDSPL上游:CCACCAGCTAAGTACCTTCTTCC下游:GGCCGCTTCAGCACATACAGAPDH上游:CTGTGGGAGCGAATCGAGG下游:CAGCGCAAGATGTCCATCA
1.5 MTT法檢測SMMC-7721細胞增殖
取對數生長期的SMMC-7721細胞制備單細胞懸液,按3×103個/孔接種到96孔板,每孔250 μl,每組4個復孔。檢測時,加15 μl/孔MTT溶液,培養4 h,棄上清,加200 μl/孔二甲基亞砜,搖床振蕩18 min,酶標儀測定波長(460 nm)下每孔的吸光值,每24 h檢測1次,連續5次。
1.6 Transwell遷移實驗檢測SMMC-7721細胞遷移
取對數生長期的SMMC-7721細胞使用無血清培養基制備單細胞懸液,按3×104個/孔接種到Trans-well小室的上室,每孔250 μl,下室加550 μl含10%血清的培養基,每組4個復孔。培養箱連續培養24 h。取出上室,甲醛固定30 min,0.1%結晶紫染液染色30 min,棉簽輕輕擦去上室側未穿膜的細胞。選取4個高倍視野,計數穿過上室面的細胞數并取均值統計分析。
1.7 免疫組化檢測肝癌組織中CTDSPL蛋白的表達
肝癌組織及癌旁組織進行石蠟切片,脫蠟及水化后,使用過氧化氫(體積分數0.3%)孵育15 min。使用PBS溶液浸泡15 min,使用血清工作液在室溫下孵育20 min。使用一抗CTDSPL稀釋液(1 ∶100稀釋)在4 ℃下孵育過夜。37 ℃復溫60 min,PBS溶液清洗。使用二抗室溫下孵育60 min,PBS溶液清洗。使用DAB溶液顯色5 min,使用蘇木精復染后,鹽酸乙醇分化并封片。在顯微鏡下觀察肝癌組織及癌旁組織中CTDSPL蛋白的表達。CTDSPL蛋白陽性反應為細胞質中出現棕色顆粒。
1.8 Western blot檢測細胞CTDSPL及下游蛋白的表達
裂解對數生長期的SMMC-7721細胞并提取蛋白,BCA法檢測各組蛋白樣品濃度,以40 μg上樣量計算各組上樣體積。灌制10%聚丙烯酰氨凝膠,恒壓110 V電泳分離蛋白樣品,硝酸纖維膜轉膜,使用5%脫脂奶粉封閉,分別與一抗GAPDH(1 ∶2 000)、Rb(1 ∶2 000)、p-Rb(1 ∶1 000)、CTDSPL(1 ∶1 000)、PCNA(1 ∶1 000)、MCM7(1 ∶1 000)和E2F1(1 ∶1 000)在4 ℃下孵育過夜,分別與二抗在室溫下孵育,迅速采用ECL化學發光試劑發光,凝膠成像系統掃描膠片。
1.9 統計學分析

2 結果
2.1 CTC-459F4.3在肝癌組織和癌旁組織中的表達
與癌旁組織相比,CTC-459F4.3在肝癌組織中呈低表達(P<0.01,見圖1)。
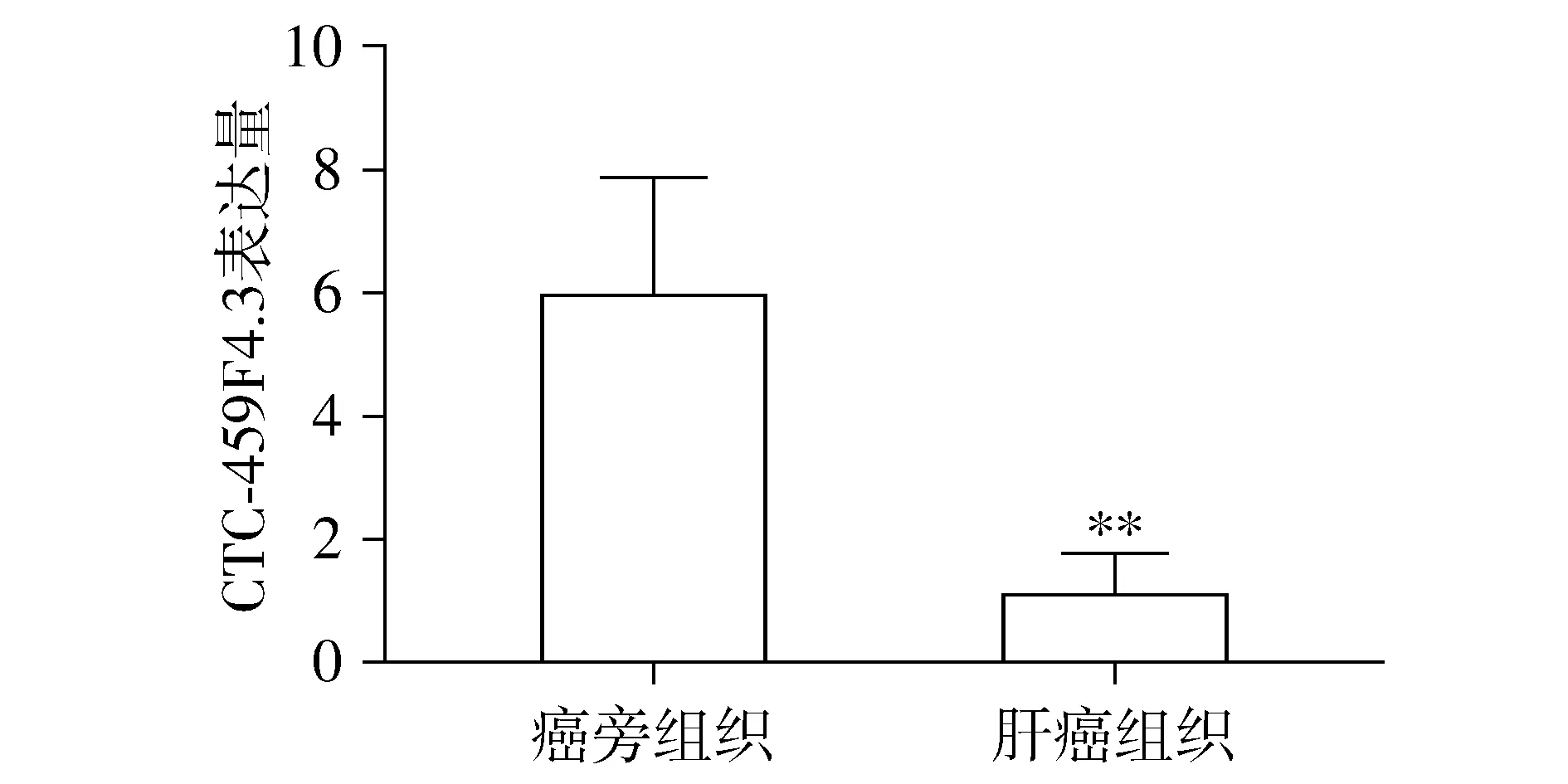
與癌旁組織相比,**P<0.01圖1 CTC-459F4.3在肝癌組織和癌旁組織中的表達Figure 1 Expression of CTC-459F4.3 in hepatic carcinoma tissues and adjacent tissues
2.2 CTC-459F4.3在正常肝細胞和肝癌細胞株的表達
與正常肝細胞(LO2)相比,肝癌細胞株(Huh7、SMMC-7721、MHCC-97H和BEL-7404)中CTC-459F4.3均呈低表達(P<0.05),SMMC-7721細胞中CTC-459F4.3的表達最低(P<0.01,見圖2)。
2.3 CTC-459F4.3質粒的轉染效率
陰性對照組和CTC-459F4.3組SMMC-7721細胞中CTC-459F4.3相對表達量分別為1.08±0.27和11.20±1.07(t=9.15,P<0.01),質粒轉染成功。
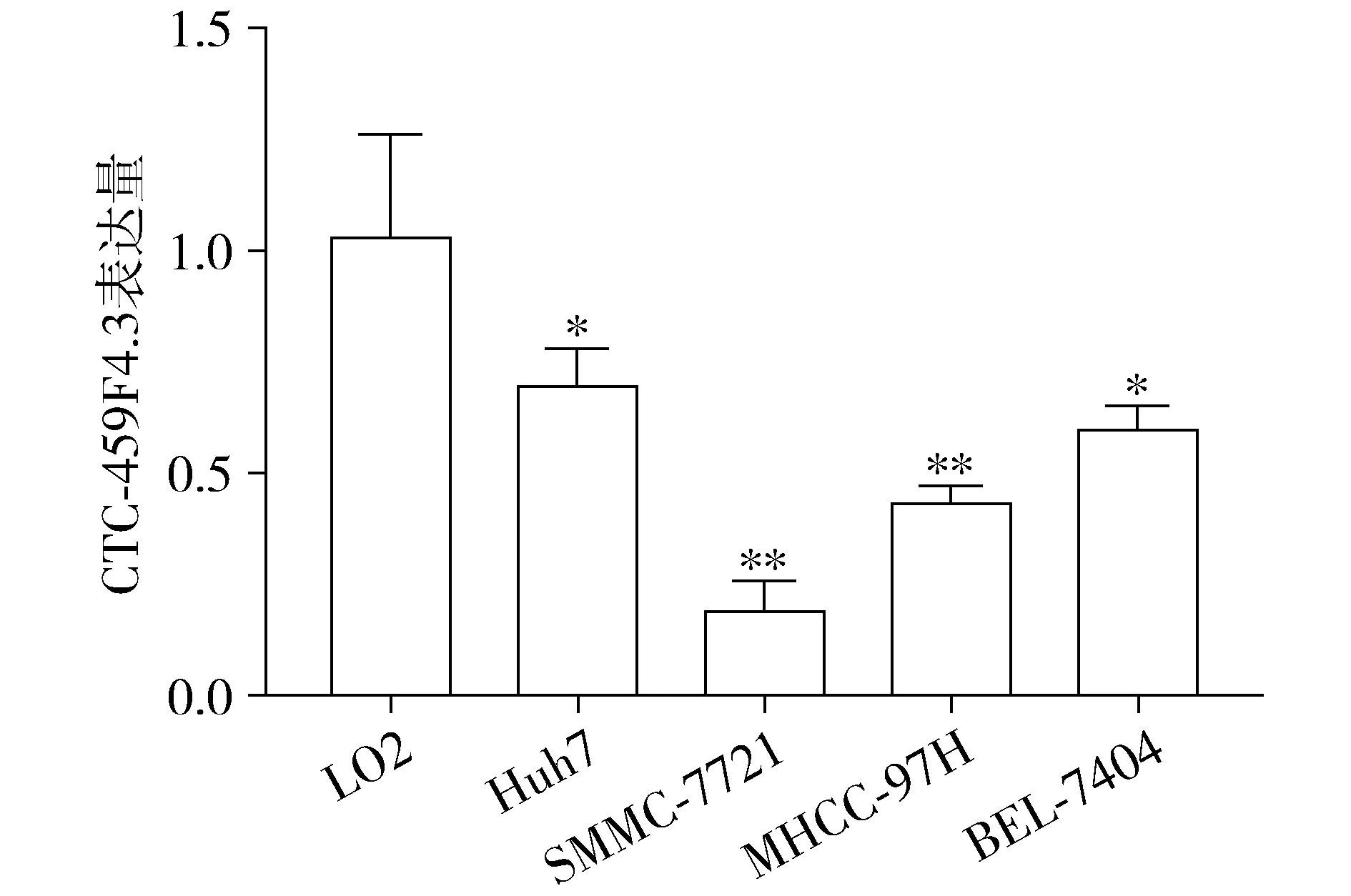
與LO2細胞相比,*P<0.05,**P<0.01圖2 CTC-459F4.3在正常肝細胞和肝癌細胞株中的表達Figure 2 Expression of CTC-459F4.3 in human normal liver cells and hepatic carcinoma cell lines
2.4 過表達CTC-459F4.3對SMMC-7721細胞增殖的影響
MTT檢測結果顯示,與陰性對照組相比,CTC-459F4.3組的SMMC-7721細胞從第3天開始,增殖能力明顯降低(P<0.05,見圖3)。

與陰性對照組相比,*P<0.05,**P<0.01圖3 CTC-459F4.3對肝癌細胞SMMC-7721增殖的影響Figure 3 Effect of CTC-459F4.3 on proliferation of hepatic carcinoma cells SMMC-7721
2.5 過表達CTC-459F4.3對SMMC-7721細胞遷移的影響
陰性對照組和CTC-459F4.3組SMMC-7721細胞遷移細胞計數分別為124.10±19.16和56.06±8.82(P<0.05)。與陰性對照組相比,轉染CTC-459F4.3后的肝癌細胞遷移能力被明顯抑制(見圖4)。
2.6 CTDSPL蛋白在肝癌組織和癌旁組織中的表達
免疫組化法檢測肝癌組織和癌旁組織中CTDSPL蛋白的表達,CTDSPL陽性結果表現為細胞質棕黃色顆粒(見圖5)。肝癌組織和癌旁組織中CTDSPL蛋白的相對表達量分別為4.20±0.47和0.49±0.14(t=7.54,P<0.01),與癌旁組織相比,CTDSPL在肝癌組織中的表達明顯減少。
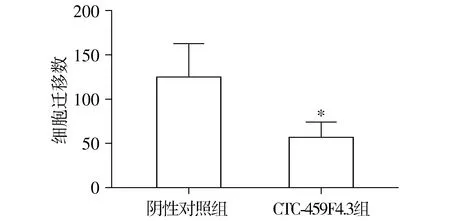
與陰性對照組相比,*P<0.05圖4 CTC-459F4.3對肝癌細胞SMMC-7721遷移的影響Figure 4 Effect of CTC-459F4.3 on migration of hepatic carcinoma cells SMMC-7721
2.7 兩組細胞中CTDSPL mRNA的表達
陰性對照組和CTC-459F4.3組SMMC-7721細胞中CTDSPL mRNA相對表達量分別為1.08±0.25和5.53±0.56(t=7.28,P<0.01)。與陰性對照組相比,CTC-459F4.3組細胞中CTDSPL mRNA的表達明顯增加。
2.8 過表達CTC-459F4.3對CTDSPL蛋白及下游蛋白表達的影響
Western blotting結果顯示,與陰性對照組相比,轉染CTC-459F4.3后,CTDSPL蛋白表達明顯增加,Rb蛋白的磷酸化水平降低,PCNA、MCM7、E2F1蛋白的表達明顯降低(見圖6)。
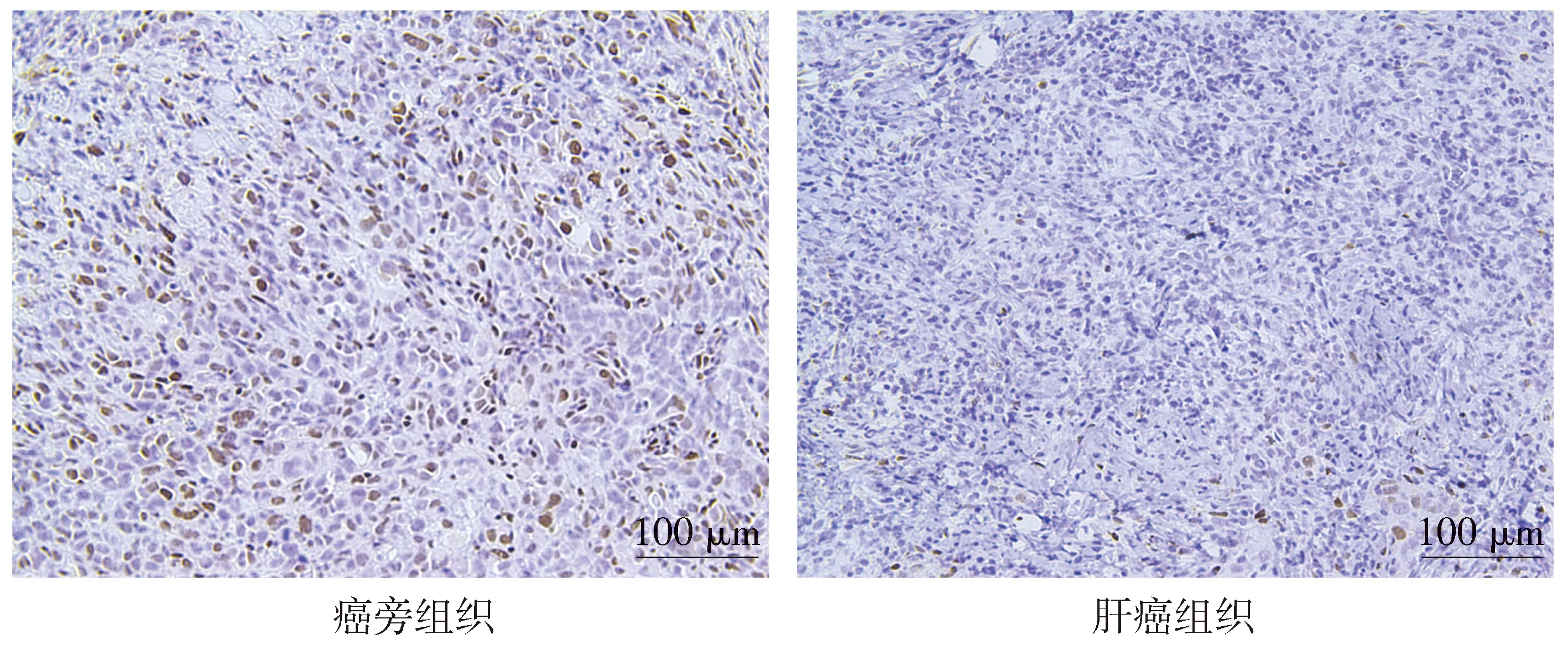
圖5 肝癌組織和癌旁組織中CTDSPL蛋白的表達Figure 5 Expression of CTDSPL protein in hepatic carcinoma tissues and adjacent tissues
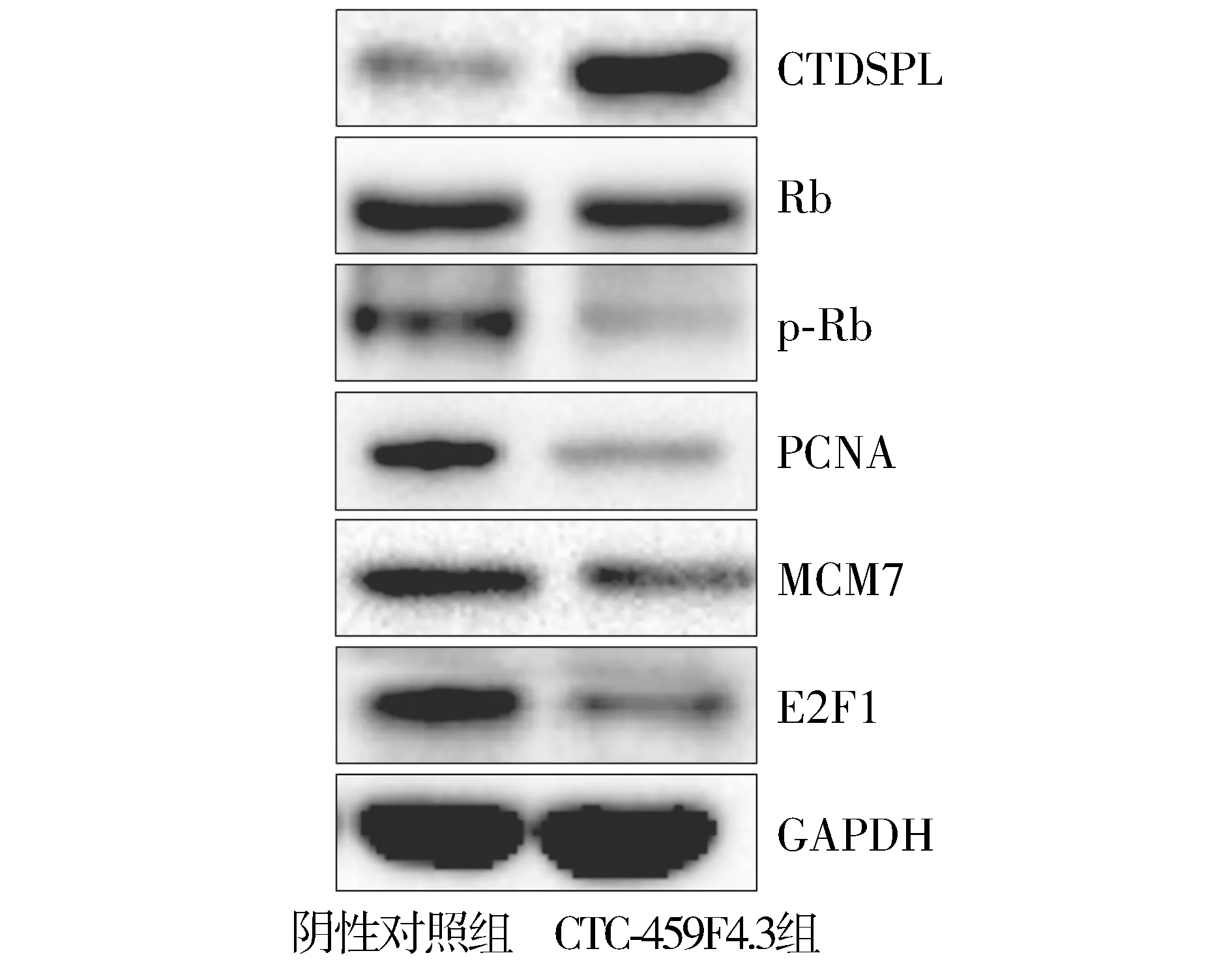
圖6 Western blotting檢測CTC-459F4.3對CTDSPL及下游蛋白表達的影響Figure 6 The effect of CTC-459F4.3 on the CTDSPL protein and downstream target protein expression by Western blotting
3 討論
肝癌的治療主要是手術治療,然而大多數肝癌確診即為晚期,針對晚期肝癌尚無有效的治療方法[5]。探索肝癌發生、發展中的分子調控機制,對肝癌靶向藥物研發具有重要臨床意義。近年的研究表明,長鏈非編碼RNA(long-chain non-coding RNA,lncRNA)在表觀遺傳學、轉錄、轉錄后及表觀遺傳學調控基因的表達,已成為腫瘤發生、發展分子作用機制研究的重點[6]。肝癌細胞的增殖和遷移行為受細胞內基因組學的調控,lncRNA發揮著重要調控作用[7]。SNHG6、GHET1、RGMB-AS1、ANRIL、XIST、TSLNC8等[8-13]lncRNA被發現參與肝癌的發生、發展,且與肝癌的臨床分期、分級及預后相關,lncRNA在肝癌發病過程中的重要作用受到越來越多的關注。CTC-459F4.3是一種新發現的lncRNA,其在腫瘤特別是肝癌中的作用尚不清楚。
本研究結果顯示,CTC-459F4.3在肝癌組織和細胞株中呈低表達,CTC-459F4.3可能參與抑制肝癌的發生、發展。MTT法和Transwell遷移實驗表明,過表達CTC-459F4.3可抑制肝癌細胞的增殖和遷移。CTDSPL全稱羧基末端區域小磷酸化酶樣蛋白,定位于染色體3p21.3區域[14]。CTDSPL作為一種抑癌基因,在葡萄膜黑色素瘤、非小細胞肺癌等多種腫瘤中表達明顯降低[15]。本研究通過免疫組化實驗顯示,肝癌組織中CTDSPL蛋白的表達顯著降低。過表達CTC-459F4.3的SMMC-7721細胞中CTDSPL表達明顯增加,表明CTC-459F4.3可促進CTDSPL蛋白的表達。視網膜母細胞瘤基因(Rb基因)的下游基因PCNA、MCM7對腫瘤細胞的增殖過程至關重要,E2F1蛋白可促進腫瘤細胞的轉移[16-18]。CTDSPL可抑制Rb蛋白的磷酸化,而Rb的去磷酸化具有下調PCNA、MCM7、E2F1蛋白表達的作用,發揮抑制腫瘤生長和轉移的作用[14-18]。本研究結果表明,CTC-459F4.3促進CTDSPL表達上調后,Rb蛋白的磷酸化水平降低,PCNA、MCM7、E2F1蛋白的表達明顯降低,表明肝癌SMMC-7721細胞的增殖和遷移能力可能降低。lncRNA CTC-459F4.3調控CTDSPL基因表達的具體分子機制尚不清楚,這是本課題組下一步研究的重點。
綜上所述,lncRNA CTC-459F4.3在肝癌組織和細胞株中呈低表達,過表達CTC-459F4.3可通過上調CTDSPL基因的表達并促進Rb蛋白的去磷酸化,抑制肝癌細胞的增殖和遷移,CTC-459F4.3有望成為肝癌的治療靶點和分子診斷標志物。

