小鼠子宮內膜間充質干細胞的分離、培養及鑒定
李紅霞,李瑞嬌,張汝月,張引紅,郭興萍*
(1山西省生殖科學研究所,出生缺陷與細胞再生山西省重點實驗室,太原 030006;2山西醫科大學實驗動物中心;*通訊作者,E-mail:sxxp555@163.com)
人子宮內膜是一個高度再生的組織,女性一生大約要經歷子宮內膜400多個周期的脫落和再生。研究發現,子宮內膜這種巨大的再生能力被認為與人類子宮內膜干細胞有直接關系[1],受到越來越多學者的關注。目前,子宮內膜干細胞分類較為多樣化,包括子宮內膜細胞側群(side population, SP)、子宮內膜間充質干細胞、月經血來源的干細胞等[2],其中子宮內膜間充質干細胞因其數量較多,生物學特性明顯等受到更多關注[3]。但其取材的特殊性對該研究的多樣化和深入程度造成了一定的影響。
小鼠雖然不具備靈長類動物的月經周期,但也具有規律的動情周期,并且其動情周期伴隨著子宮內膜細胞的增生及衰亡[4]。另外,Chan等[5]通過標記滯留技術檢測發現,小鼠子宮中也含有子宮內膜干細胞。參考這種情況,本實驗獲取小鼠子宮組織,分離培養得到小鼠子宮內膜間充質干細胞,并對該細胞進行鑒定,為薄型子宮內膜小鼠的內膜修復提供材料,也為治療人薄型子宮內膜及子宮內膜受損的相關疾病提供一定的實驗基礎。
1 材料與方法
1.1 小鼠子宮組織
小鼠子宮組織來源于C57BL/6J經產離乳小鼠(生了小鼠,小鼠離乳后的母鼠),SPF級,購自山西醫科大學實驗動物中心(SCXK(晉)2015-0001)
1.2 主要試劑
細胞培養液MesenCultTMExpansion Kit(Mouse)、L-Glutamine購自STEMCELL Technologies(Canadian)公司,膠原酶Ⅲ、胰蛋白酶-EDTA消化液(0.25%)、青鏈霉素混合液(100×)、臺盼藍染色液(0.4%)、CCK-8試劑盒均購自北京索萊寶科技有限公司,CELLSAVING無血清細胞凍存液購自蘇州新賽美生物科技有限公司。流式抗體(CD29-APC/CD45-PerCP-Cy5.5/CD73-PE-Cy7/CD105-APC/CD117-APC)購自eBioscience公司(USA)。
1.3 小鼠子宮內膜間充質干細胞分離
脫頸處死小鼠,75%酒精消毒,取雙側子宮,置于1×PBS中清洗,剪去系膜等。在PBS中將子宮剪成1 mm×1 mm左右塊狀,將小塊轉移至1.5 ml EP管,加入酶混合液(0.1%膠原酶+0.08%胰酶),37 ℃水浴45 min,加入含10% FBS的培養液中止消化,將消化后所有的液體吸取至15 ml離心管,培養箱放置待用。管中沉淀再次加入酶混合液,37 ℃恒溫水浴45 min,加入含10% FBS的培養液中止消化,兩次消化所得液體混合,用70 μm細胞過濾器過濾液體。將過濾后的液體1 000 r/min離心10 min。棄上清,加培養液重懸,再次離心。所得沉淀即為子宮內膜細胞,取培養液重懸計數后即可進行培養。
1.4 小鼠子宮內膜間充質干細胞培養
將細胞計數,置于25 ml培養瓶中放入培養箱,培養環境為37 ℃,5% CO2,10% O2,85% N2。培養第7天,鏡下觀察若細胞80%-90%融合,則進行1 ∶2或者1 ∶3傳代,若細胞融合過低,則進行半量換液,第10天鏡下觀察傳代。傳代時,PBS沖洗3次,沖去殘留的培養液,用2.5%胰蛋白酶消化3 min,加入含10% FBS培養液中止消化,反復吹打瓶壁,將所獲單細胞懸液1 000 r/min,離心10 min。棄上清,完全培養液重懸細胞,計數后培養。
1.5 小鼠子宮內膜間充質干細胞生長曲線測定
取生長狀態良好的第3代細胞(P3)和第5代細胞(P5),分別于對數期消化后細胞培養液重懸,制成2×104/ml細胞懸液。參照CCK-8說明書,將細胞接種在96孔板,每孔100 μl,加樣孔數為7×9孔。96孔板的周邊孔分別加入細胞培養液100 μl,以保持環境濕潤(CCK8加樣示意圖見圖1)。37 ℃培養24 h,培養條件為5% CO2、10% O2、85% N2。細胞培養1,2,3,4,5,6,7 d,每天設7個復孔,2個空白對照孔。測定前實驗孔每孔加入10 μl CCK-8,孵育2 h,酶標儀測定450 nm波長吸光度值。

圖1 CCK-8加樣示意圖Figure 1 CCK-8 sketch map of loading
1.6 小鼠子宮內膜間充質干細胞表面標志物表達
流式細胞儀鑒定小鼠子宮內膜間充質干細胞表面標記,取生長狀態良好的小鼠子宮內膜干細胞P3和P5,消化后用PBS重懸,制成1×108/ml單細胞懸液,取流式管,每管加入100 μl細胞懸液,共6管。第1管為空白對照,剩余5管參考說明書分別加入流式抗體(CD29-APC-0.625 μl/CD45-PerCP-Cy5.5-0.3 μl/CD73-PE-Cy7-0.625 μl/CD105-APC-0.625 μl/CD117-APC-0.625 μl),混勻,4 ℃孵育30 min,上機檢測。
1.7 小鼠子宮內膜間充質干細胞的凍存
小鼠子宮內膜間充質干細胞凍存采用新賽美無血清細胞凍存液。凍存步驟如下:常規方法收集對數期的貼壁細胞置于離心管中,1 000 r/min離心5 min,棄上清,收集沉淀,根據細胞數加入新賽美無血清細胞凍存液,調整細胞終濃度為5×105-1×107/ml。輕柔地混勻細胞,制成細胞混合液,分裝于凍存管,每管1 ml。-80 ℃保存。
1.8 小鼠子宮內膜間充質干細胞復蘇
從冰箱中取出凍存的細胞,立即放入37 ℃水浴鍋中快速解凍。待凍存管中細胞混合液完全融化后,立即加入1 ml細胞培養基于冷凍管中與細胞混合。將混合液轉移至含有約5 ml細胞培養基的離心管中,混勻,1 000 r/min,離心5 min,棄上清,收集沉淀。加入適量的新鮮細胞培養基,輕柔混勻,取0.1 ml細胞懸液與0.4%臺盼藍染色液0.9 ml混勻,3 min內用細胞計數板計數死細胞與活細胞,其中死細胞被染成藍色,而活細胞拒染呈無色透明狀。活細胞率(%)=活細胞總數/(活細胞總數+死細胞總數)。
細胞計數后,將重懸的干細胞懸液1.9 ml平均分裝轉入2個25 ml培養瓶中,添加培養液至5 ml,37 ℃,5% CO2、10% O2、85% N2培養。
2 結果
2.1 小鼠子宮內膜間充質干細胞形態學觀察
原代分離培養的子宮內膜干細胞24 h置于倒置顯微鏡下觀察,1 d可見細胞基本貼壁,少量梭形細胞和多角形細胞,多為圓形細胞。隨著時間延長,3-4 d,大多為梭形細胞,到6-7 d,可見不同大小的集落,呈漩渦狀。繼續觀察,若7 d左右融合率過低,半量換液后繼續培養,大約10 d達到80%-90%融合,可見細胞排列成網狀。原代含有部分錯落的圓形細胞(小鼠子宮內膜間充質干細胞分離培養,見圖2)。
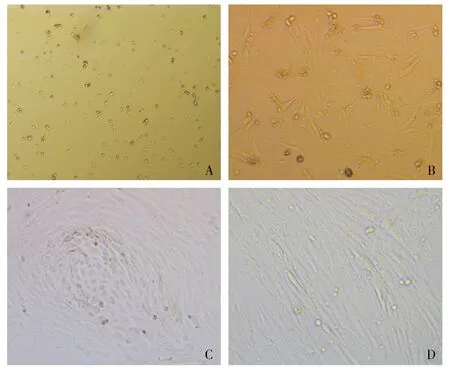
A.培養1 d;B.培養3 d;C.培養7 d;D.培養10 d圖2 小鼠子宮內膜間充質干細胞分離培養 (×100)Figure 2 Culture of mesenchymal stem cell from mice endometrium (×100)
2.2 小鼠子宮內膜間充質干細胞的生長與傳代
隨著傳代次數的增多,圓形細胞逐漸消失,細胞形態越來越統一,傳代細胞較扁平,呈極性排列。各代間細胞形態基本無變化(見圖3)。
2.3 小鼠子宮內膜間充質干細胞增殖曲線
以時間(天數)為橫軸,OD值為縱軸,繪制小鼠子宮內膜干細胞增殖曲線。小鼠子宮內膜間充質干細胞生長曲線,傳代培養潛伏期為1-3 d,增長較為緩慢。對數期為4-6 d,細胞進入快速增長階段。對數期后增長速度逐漸下降。P3和P5兩代細胞增殖曲線無明顯區別(見圖4)。
2.4 小鼠子宮內膜間充質干細胞表面標志物表達
對P3,P5小鼠子宮內膜間充質干細胞進行流式細胞術檢測,小鼠子宮內膜間充質干細胞表面標記物流式細胞儀檢測結果見圖5。結果發現P3細胞尚未達到比較理想的純化狀態,P5細胞純化效果較好。小鼠子宮內膜干細胞第5代高表達CD29(97.7%),CD73(85.2%),CD105(99.8%),低表達CD45(5.6%),不表達CD117(0.1%)。

A. 第3代細胞 B.第5代細胞圖3 小鼠子宮內膜間充質干細胞傳代培養 (×100)Figure 3 Observation of mesenchymal stem cells from mice endometrium after different passages (×100)
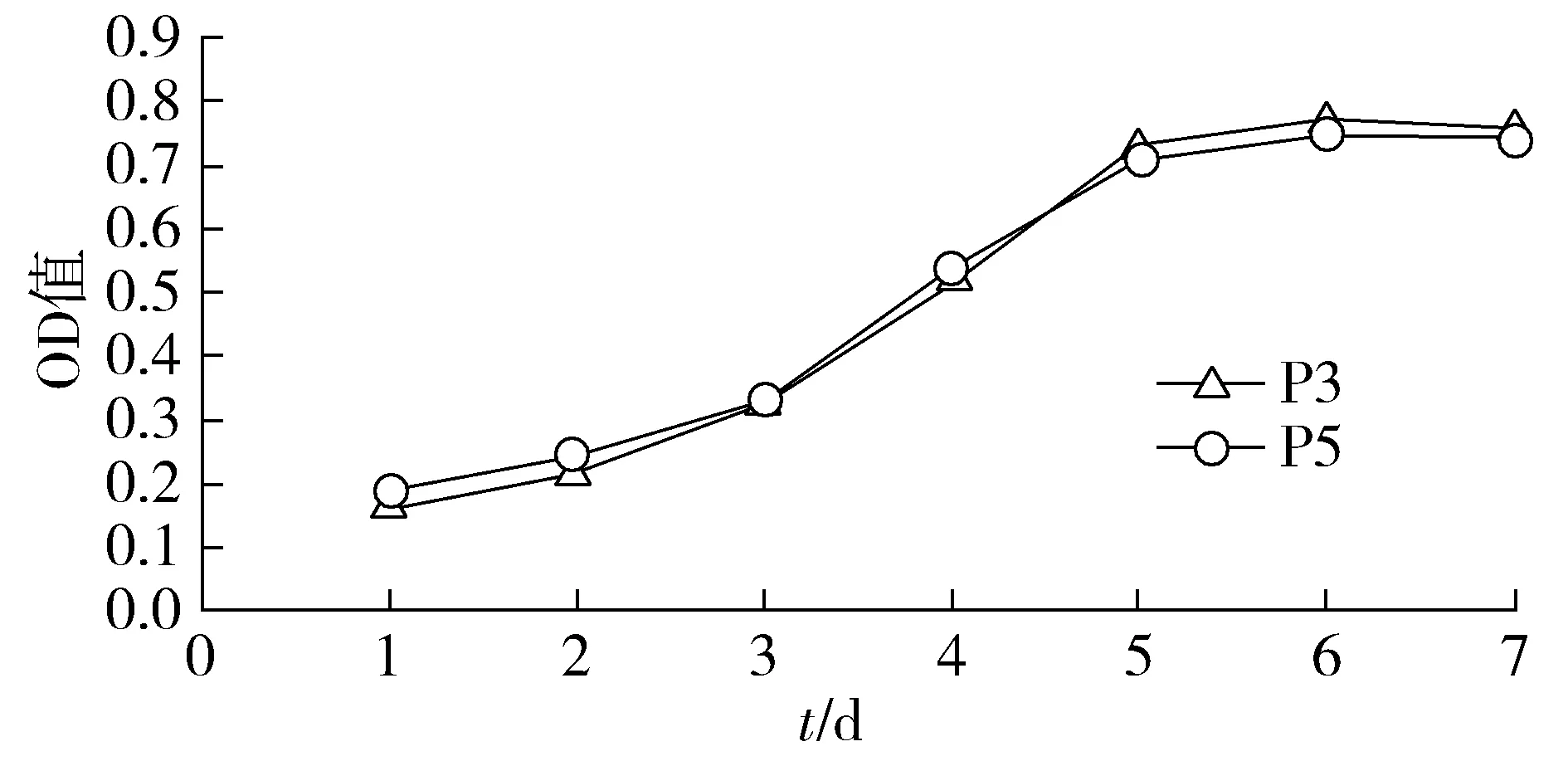
圖4 小鼠子宮內膜間充質干細胞增殖曲線Figure 4 Proliferation curve of mesenchymal stem cell from mice endometrium
2.5 小鼠子宮內膜間充質干細胞的凍存與復蘇
臺盼藍法計數(細胞計數板),細胞復蘇后存活率達到96%以上,生長狀態良好,增殖能力強,與凍存前細胞活力無明顯差異。
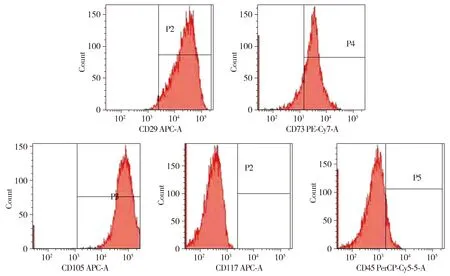
圖5 P5流式細胞儀分析小鼠子宮內膜間充質干細胞表面標記物Figure 5 Phenotypic analysis of mesenchymal stem cell from mouse endometrium by flow cytometry
3 討論
1978年,Prianishnikov[6]首次提出子宮內膜干細胞這一概念,人類開始意識到,具有強大再生能力的子宮內膜干細胞在子宮內膜周期性的增生和剝落中扮演著不可忽視的重要角色。2004年,Chan等[7]首次從女性子宮內膜組織中分離出人子宮內膜基質細胞和上皮細胞,并通過單克隆細胞培養、相關干細胞因子的表達等證明子宮內膜中確實存在子宮內膜干細胞。2009年,Gargett等[8]通過再次確定人子宮內膜干細胞巨大的再生能力及體外誘導分化等實驗,確認子宮內膜干細胞不僅在子宮內膜再生干預方面有重大作用,也因其易于獲得,從而為基于間充質干細胞的細胞療法提供了一種新的可能。近年來,經血源性干細胞逐漸走入大眾視野,不僅取材方便,獲得過程對供體無手術風險,更因其比分泌期子宮內膜干細胞具有更強的增殖能力和自我更新能力得到了行業的廣泛關注[9]。將源于經血的干細胞作為細胞治療的種子細胞移植所進行的修復研究也已涉及心肌梗死、Duchenne型肌營養不良、Ⅰ型糖尿病、結腸炎及子宮內膜修復等多個方向及領域[10-12]。
由于倫理學、有創采集等多種原因,人體作為子宮內膜干細胞的供體,深入研究有諸多不便。小鼠作為應用最多的實驗動物,有著眾多不可忽視的優勢。雖然月經是人和靈長類動物特有的生殖特性,小鼠屬于嚙齒類動物,不具備這一特性。但是小鼠具有和人類相似的子宮結構和規律的動情周期。小鼠的動情周期為4-5 d,每個動情周期都伴隨著子宮細胞的增生和凋亡[4]。同時2006年Chan等[5]已通過標記滯留細胞(label retaining cells,LRCs)首次確定C57BL/6J小鼠子宮中含有子宮內膜干細胞。胡菲菲等[13]從生育期小鼠4個動情期(動情前期、動情期、動情后期、動情間期)和小鼠產后子宮內分離子宮內膜干細胞,并比較這些子宮內膜干細胞數量,結果發現產后小鼠子宮中SP細胞明顯多于正常未孕的小鼠。徐靜[14]通過Hoechst-SP法檢測小鼠產后第1,3,7,14,17.5,21,28,60天子宮內膜SP細胞比率,發現第17.5天時的SP細胞比率達到峰值。新生小鼠約21 d離乳,考慮到動物福利的情況,綜合考慮,本實驗最終選擇產后21-23 d的C57BL/6J母鼠作為實驗材料,獲取子宮內膜干細胞。
子宮內膜分離消化的方法主要包括機械研磨法、剪碎法、酶消化法、組合法等多種方法[14,15],其中剪碎法和酶消化法組合為大多實驗室所認可。酶的使用又包括膠原酶、胰酶、DNA酶等。本實驗在經歷了擠壓法獲得子宮內膜、刮取法獲得子宮內膜加少量肌層、全子宮剪碎消化分離培養,膠原酶+DNA酶消化法、膠原酶加胰酶消化法等不同組合次數的摸索,最后確定選擇(0.1%膠原酶+0.08%胰酶)2次消化法,70 μm細胞過濾器過濾后可獲得較為純凈的子宮內膜單細胞懸液。
目前,根據來源或者不同的分離手段將子宮內膜干細胞主要分為:間充質干細胞、上皮干細胞、SP干細胞、經血源性干細胞、子宮內膜再生細胞等[2]。常規貼壁分離培養所含細胞分為子宮內膜上皮干細胞和間充質干細胞。子宮內膜上皮干細胞含量較少,約占子宮內膜干細胞總數的5%,分離不易且體外培養困難[6]。間充質干細胞含量較多,主要位于基質和肌層交界處。研究發現,間充質干細胞來源于發育早期的中胚層[7],不同來源包括骨髓[16]、脂肪[17]、臍帶[18]等的間充質干細胞都具有類似的特性。鑒此,本實驗選擇了STEMCELL Technologies公司的MesenCultTMExpansion Kit(Mouse)作為細胞培養液,該細胞培養液專為富集小鼠骨髓間充質干細胞設計,并配合低氧環境進行培養,實驗發現在此環境下,子宮內膜干細胞生長狀態良好,增殖明顯。
常規干細胞的鑒定包括形態觀察,克隆形成實驗,流式細胞儀對細胞表面標記進行分析、免疫組化鑒定等。本實驗結果顯示培養所獲子宮內膜干細胞形態學特征與文獻報道[13]較為一致,且增殖力強。通過流式細胞儀對細胞表面標記進行分析是近年來應用最為廣泛的一種鑒定手段。Deane等[19]實驗結果顯示,來源于成年小鼠子宮的間質細胞高表達CD90和CD44,低表達CD45和EpCAM。Chan等[5]研究認為,小鼠子宮內膜干細胞在表達sca-1、CD31、α-SMA的同時也表達雌激素受體(ERα)和Ki-67(增殖標志),不表達c-Kit。部分學者研究結果顯示子宮內膜干細胞中CD29、CD44、CD73、CD90、CD105、CD140、CD146等均表達陽性[20,21]。李建國等[22]研究表明小鼠骨髓間充質干細胞高表達CD29和CD44,基本不表達CD45和CD11b,趙文秀等[23]研究顯示小鼠脂肪間充質干細胞高表達CD29和CD44,不表達CD34、CD45、CD11b、CD14。參考文獻及相關預實驗,本實驗最后決定選擇CD29、CD45、CD73、CD105、CD117(c-kit)作為鑒定標記,實驗結果顯示本實驗所培養的小鼠子宮內膜干細胞表達CD29,CD73,CD105,不表達CD45、CD117。通過以上實驗,可以確定本實驗所分離培養的為小鼠子宮內膜間充質干細胞。
子宮內膜是對女性維持生理功能和生育功能有著重大意義的部分,也是輔助生殖領域影響胚胎著床的關鍵因素[24]。子宮內膜干細胞的深入研究,對子宮內膜功能改善、子宮疾病治療有著積極的影響。因此,在人類子宮內膜研究較為受限的情況下,全方位研究小鼠子宮內膜干細胞,為人類子宮內膜干細胞的研究與應用提供相關數據支撐。

