自載體的pH響應核-殼型紫杉醇-阿霉素納米棒協同靶向治療非小細胞肺癌
李亞楠,董慶榕,張 輝*
(1山西醫科大學第一醫院放射科,太原 030001;2山西醫科大學醫學影像學院;*通訊作者,E-mail:zhanghui-mr@163.com)
癌癥是嚴重危害人類健康的重大疾病之一,化療是主要的治療手段[1]。紫杉醇(PTX)和阿霉素(DOX)是兩種重要且廣泛使用的化療藥物,在多種腫瘤中表現出良好的抗癌活性,且具有不同的溶解性和作用機制。PTX疏水性強,在細胞有絲分裂周期的G2期與微管蛋白二聚體相互作用,促進微管聚合并抑制解聚,形成高度穩定的微管,從而阻止細胞分裂[2]。DOX親水性強,通過插入作用與DNA結合,誘導一系列生物化學反應,最終導致腫瘤細胞凋亡[3]。由于腫瘤細胞耐藥性的產生,單一PTX或DOX以分子態使用時往往不能完全緩解腫瘤,因此,近年來報道了多種納米級藥物釋放系統用于增強這兩種藥物的活性并減少耐藥,如脂質體[4]、膠束[5]、無機納米顆粒[6]等。這些納米體系在一定程度上改善了藥物活性和耐藥性,但仍存在著載藥量低、載體導致的全身毒性、載體的合成和調節困難、性質差異較大的兩種藥物很難共負載在同一個納米體系等問題,這些障礙嚴重限制了其在生物醫學領域中的應用。
納米材料的形貌、尺寸和表面化學性質對它的細胞內吞和細胞內遷移有重要影響。近年來,一維納米結構在生物醫學領域引起了廣泛的研究興趣,由于其具有獨特優勢,如更好的內吞效率[7]、更長的循環時間[8]、更高的載藥量和更強的生物基底黏附性[9],以便提高治療和成像效果。考慮以上因素,若能開發一種使用最少惰性材料來負載并功能化物化性質差異較大的兩種藥物,且達到最大療效,是納米載藥體系發展的重要趨勢,關于高載藥量的刺激響應型自載體核-殼雙藥納米棒給藥系統,具有重大的應用潛力,但目前報道較少。
本研究中,我們采用溶劑交換法制備PTX納米棒,化學偶聯法制備具有pH響應基團的DOX前藥,兩種藥物體系以體積比5 ∶1混合,依次經超聲和攪拌處理后,制備出pH響應的核-殼型雙藥納米棒復合體系。精確表征了該雙藥納米棒的形貌、尺寸、兩種藥物的結合情況、在不同pH值緩沖液中的釋放特性,實時追蹤納米雙藥的細胞內吞過程,測試其對非小細胞肺癌的協同靶向抑制效果,并評價功能化分子的生物相容性。研究表明,該協同體系制備簡單、載藥量高、穩定性好,具有較強的協同增強抗腫瘤活性,且方法普適。這一策略將為新型多藥協同制劑的設計和制備提供有益的啟示,并在腫瘤的精準診療中發揮潛在應用,現報道如下。
1 材料與方法
1.1 儀器
掃描電子顯微鏡(SEM,S-4300冷場發射,加速電壓為5 kV,日本Hitachi公司),透射電子顯微鏡(TEM,HF5000,加速電壓為200 kV,日本Hitachi公司),激光共聚焦顯微鏡(Leica SP8,德國徠卡公司),UV-vis分光光度計(Perkin-Elmer Lambda 750 UV/Vis/NIR,珀金埃爾默股份有限公司),酶標儀(SUNRISE,奧地利Tecan公司),Millipore Biocel Milli-Q system(美國密理博公司)。
1.2 主要試劑
PTX(純度>99%)、DOX(純度>98%)、PMHC18(馬來酸酐-十八碳烯交替共聚物)、mPEG-NH2(5K)、EDC[1-(3-二甲氨基丙基)-3-乙基碳二亞胺]、MTT(噻唑藍)購自Sigma-Aldrich試劑公司;DCJTB購自J&K科學有限公司;NHS(羥基琥珀酰亞胺)、DMSO(二甲基亞砜)、RPMI-1640細胞培養基、trypsin-EDTA胰酶細胞消化液(含0.25%胰酶和0.02%EDTA)購自Invitrogen試劑公司。
1.3 DOX-PEG-PMHC18的合成
將DOX的氨基與PMHC18-PEG的羧基偶聯,合成了具有pH響應特性的酰胺鍵,并得到兩親性的DOX前藥DOX-PEG-PMHC18。其中,PMHC18-PEG參照之前的文獻報道來合成[10],簡要步驟如下:10 mg PMHC18和143 mg mPEG-NH2(5K)溶解在5 ml含6 μl三乙胺和11 mg EDC的二氯甲烷中,攪拌條件下反應24 h,用氮氣吹干二氯甲烷溶劑,所得固體溶解在水中形成透明溶液,用蒸餾水在截留分子量為14 kDa的透析袋中透析2 d,以去除未反應的mPEG-NH2、EDC和TEA,凍干后的白色固體-20 ℃保存待用。DOX與PMHC18-PEG之間的酰胺化過程與PMHC18-PEG的合成類似,凍干的粉紅色固體產物-20 ℃保存備用。
1.4 PTX納米棒的制備和表面功能化
采用溶劑交換法制備PTX納米棒:首先將PTX在水浴超聲條件下溶解于無水乙醇中,終濃度為3 mg/ml,用微量注射器從中取出100 μl溶液,室溫下(25 ℃)注入5 ml快速攪拌的去離子水中(1 000 r/min),繼續攪拌5 min后停止,將該反應體系收集在10 ml無色玻璃凍存瓶中,水浴超聲后(選擇高頻檔位)得到乳白色的PTX納米棒懸濁液。將200 μl DOX-PEG-PMHC18水溶液(1 mg/ml)迅速加入1 ml PTX納米棒懸濁液中,磁力攪拌0.5 h,獲得穩定的核-殼型雙藥納米棒。
1.5 PTX-DOX納米棒的儲存穩定性
將10 ml的PTX納米棒、DOX-PEG-PMHC18和PTX-DOX雙藥納米棒懸濁液分別密封在20 ml無色玻璃凍存瓶中,每種樣品體系設置3個重復,室溫下避光保存,同時開始計時,以保存當時為計時零點,隨后分別在第0,1,2,4和6個月時用佳能數碼相機對三組樣品的外觀形態進行拍照,并在拍照的同時,根據PTX在227 nm處的吸收強度與溶液濃度的定量擬合方程式,用UV-vis分光光度計對三組樣品上清液中的PTX含量進行定量檢測。
1.6 PTX-DOX納米棒的pH響應體外釋放特性
將90 μmol/L的PTX-DOX納米棒分散在不同pH值的緩沖液中(0.01 mol/L的PBS緩沖液pH=7.4,0.01 mol/L的醋酸緩沖液pH=5.0),轉移到截留分子量為3 500的透析管中,透析管浸入到150 ml的各自緩沖液中,37 ℃下搖動,在預設時間點,取出5 ml透析液并補充等量的緩沖液。根據DOX最大吸收峰(505 nm)處吸收強度與濃度的對應關系繪制標準曲線,并根據標準曲線計算各個時間點的DOX釋放量和累積釋放率,根據3次重復實驗的平均值繪制累積釋放率隨時間變化的函數曲線。
1.7 細胞培養
人非小細胞肺癌細胞株(A549細胞)購自美國模式培養物集存庫(ATCC),貼壁培養在含10% FBS和1%青鏈霉素的RPMI-1640培養基中,在37 ℃含5% CO2的培養箱中孵育,細胞用胰蛋白酶(0.05%)/EDTA消化處理并傳代培養。
1.8 PTX-DOX納米棒被腫瘤細胞內吞的過程觀察
將A549細胞(5×104個細胞/孔)接種于24孔板,37 ℃,5% CO2的細胞培養箱環境中培養24 h,加入DCJTB摻雜(制備PTX納米棒時,在3 mg/ml的PTX乙醇溶液中溶解少量DCJTB,即得到穩定摻雜DCJTB的PTX納米棒)的PTX-DOX納米棒(PTX=5 μmol/L),并開始計時,繼續培養到設定的觀測時間點(10 min、30 min、1 h、2 h、4 h),棄培養基,PBS洗3次,用4%的多聚甲醛固定細胞,激光共聚焦顯微鏡觀察納米棒被細胞內吞的過程,激發光為514 nm,發射光為550~650 nm,不含納米棒的加樣組作為空白對照。
1.9 PTX-DOX納米棒的抗腫瘤活性檢測
將A549細胞(1×104個細胞/孔)接種于96孔板,37 ℃,5% CO2的細胞培養箱環境中培養24 h,顯微鏡下觀察細胞生長和貼壁狀態,棄培養基,并加入含不同濃度的4種藥物的新培養基,4組藥物分別:PTX,DOX,DOX+PTX混合物,PTX-DOX雙藥納米棒,藥物濃度為0.001,0.01,0.1,1,10 μmol/L,將加完藥物的96孔板再放入培養箱中培養48 h,隨后拿出培養板,棄培養基,用150 μl PBS緩沖液洗滌3次,采用MTT法測試各組藥物對腫瘤細胞的抑制作用,并用GraphPad Prism 7繪制細胞相對存活百分比隨藥物濃度的變化曲線,進行曲線擬合并確定最大半數抑制濃度(IC50)值,每組設3個復孔,每個結果重復3次。
2 結果
2.1 PTX-DOX納米棒的組裝及抗腫瘤過程
如圖1所示,藥物組裝和內吞過程主要包括4個關鍵步驟:①不同于傳統的載體基藥物體系,本研究將疏水性藥物PTX溶解在良溶劑中,加水制備均勻的純藥納米棒;②親水性藥物DOX偶聯表面活性劑制備的兩親性前藥加入到PTX納米棒的水懸濁液體系中對其進行表面功能化,得到共負載雙藥的納米棒PTX-DOX;③功能化的PTX-DOX納米棒通過能量介導的內吞作用進入到腫瘤細胞中;④藥物從納米復合體系中釋放并表現出協同增強的抗腫瘤活性,其中PTX與微管結合,通過穩定微管將細胞有絲分裂抑制在G2/M期,從而誘導信號通路導致細胞凋亡;DOX作為一種DNA插入劑來抑制DNA和RNA的生物合成[11]。這一巧妙的設計策略大大提高了載藥量,降低了載體的毒性和代謝負擔,最終提高腫瘤的治療效果。

圖1 自載體PTX-DOX雙藥納米棒的組裝、細胞內吞及抗腫瘤過程示意圖Figure 1 Schematic assembly, endocytosis and anti-tumor process of self-carrier PTX-DOX nanorods
2.2 PTX-DOX納米棒的制備和表征
采用溶劑交換法制備PTX納米棒,圖2A中的SEM結果顯示,該方法可大量制備具有均勻形貌和尺寸的納米棒(長度500 nm,直徑40 nm),DOX偶聯表面活性劑后得到的兩親性前藥對PTX納米棒進行表面功能化修飾,用1H NMR和UV-vis分光光度計表征DOX前藥,圖2B中DOX-PEG-PMHC18在505 nm處的特征吸收峰表明了DOX與PMHC18-PEG的成功偶聯。

A.SEM表征PTX納米棒的形貌和尺寸 B.UV-vis吸收光譜表征DOX與PMHC18-PEG的成功偶聯圖2 PTX-DOX納米棒的制備與表征Figure 2 The preparation and characterization of PTX-DOX nanorods
2.3 PTX-DOX納米棒的儲存穩定性
PTX-DOX納米棒和PTX納米棒分散在生理緩沖液中(PBS),室溫保存6個月,分別在0,1,2,4,6個月時拍照記錄兩種懸濁液的外觀形態,并用UV-vis分光光度計測量上清液中的PTX含量。圖3為保存至第6個月時的結果,從圖3A的數碼照片結果可知,新制備的PTX和PTX-DOX納米棒分別呈現均勻的乳白色和粉紅色,但在PBS分散介質中,PTX納米棒懸濁液逐漸析出白色沉淀,但PTX-DOX體系保存6個月時仍能保持均勻的粉紅色。圖3B為兩種體系上清液中PTX的定量檢測結果,由圖可知,保存6個月時,PTX納米棒體系的上清液中幾乎無PTX存在,但PTX-DOX體系的上清液中仍能檢測到較高的PTX含量,與圖3A結果一致,說明PTX-DOX納米棒具有良好的體液儲存穩定性。

A.PTX-DOX和PTX納米棒在PBS緩沖液中儲存6個月時的數碼照片 B.PTX-DOX和PTX納米棒在PBS緩沖液中儲存6個月時上清液的UV-vis吸收光譜圖3 PTX-DOX納米棒的儲存穩定性Figure 3 The storage stability of PTX-DOX nanorods
2.4 PTX-DOX納米棒的pH響應藥物釋放特性
在37 ℃的PBS緩沖液(pH=7.4)和醋酸緩沖液(pH=5.0,模擬腫瘤間質和細胞內小體的酸性環境)中,透析PTX-DOX納米棒懸濁液250 h,并在各個預設時間點檢測透析液中DOX的釋放量,由圖4可知,納米棒在PBS緩沖液中孵育250 h時,30%的DOX被釋放,而在醋酸緩沖液中大于75%的DOX被釋放,說明PTX-DOX納米棒具有明顯的pH響應藥物釋放特性,可以被腫瘤酸性環境調節來釋放藥物。
2.5 PTX-DOX納米棒的細胞內吞過程
用DCJTB摻雜的PTX-DOX納米棒孵育A549細胞,CLSM檢測孵育到不同時間點的細胞內紅色熒光強度,由圖5可知,納米棒可快速進入細胞,培養初期,細胞內幾乎無熒光信號,隨著時間延長逐漸出現紅色熒光,且納米棒孵育細胞2 h后,細胞內觀察到高信噪比的強熒光且保持穩定。
2.6 PTX-DOX納米棒的抗腫瘤活性
分別用PTX、DOX、PTX+DOX、PTX-DOX納米棒4種藥物體系作用于A549細胞48 h,如圖6所示,與其他系統相比,PTX-DOX納米棒具有更強的藥效(IC50=0.003 μmol/L),PTX+DOX混合體系對腫瘤細胞的抑制效果優于單一藥物(IC50=0.016 μmol/L),兩種單藥體系中,在相同給藥濃度下,PTX對腫瘤細胞的殺傷效果優于DOX(IC50值分別為0.043和16 μmol/L),因此,4種給藥體系對人非小細胞肺癌A549細胞的抗腫瘤活性順序依次為:PTX-DOX納米棒>PTX+DOX混合物>PTX>DOX。
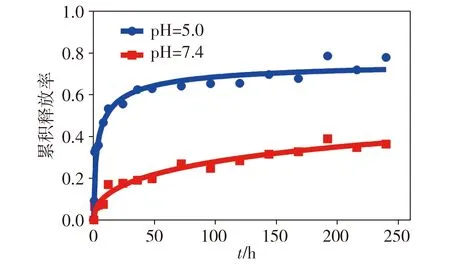
圖4 不同pH值下PTX-DOX納米棒中的DOX在不同時間點的累積釋放率Figure 4 Time-dependent cumulative release ratio of DOX from PTX-DOX nanorods at different pH values

圖5 PTX-DOX納米棒孵育A549細胞的細胞內吞過程Figure 5 The endocytosis of PTX-DOX nanorods in A549 cells
3 討論
針對化療藥物在腫瘤治療中的重要作用[12],以及基于載體的單一藥物納米釋放體系存在的載藥量低、載體毒性、代謝負擔、易產生耐藥等問題[13],本研究將具有不同抗癌機制且可協同增強抗癌效果的兩種化療藥物PTX和DOX共負載于同一個自載體的納米棒復合結構中,形成核-殼型雙藥系統,該系統具有優良的體液儲存穩定性,可響應腫瘤部位的酸性環境并被腫瘤細胞快速內吞,發揮協同增強的抗腫瘤活性,該制備策略可推廣適用于多種雙藥體系。
采用溶劑交換法可大量制備長度500 nm、直徑40 nm、形貌尺寸均勻的PTX納米棒,兩親性的DOX前藥DOX-PEG-PMHC18對其進行表面功能化修飾后得到穩定的核-殼型PTX-DOX納米棒。該復合體系可在體液環境中長期穩定保存6個月以上,且DOX前藥對PTX納米棒的功能化修飾增加載藥體系的體內循環時間,抵抗網狀內皮系統的清除,未功能化的PTX納米棒由于Ostwald熟化過程[14]很快析出白色沉淀,因此,納米藥物的表面功能化對增加其穩定性和藥物活性非常必要。
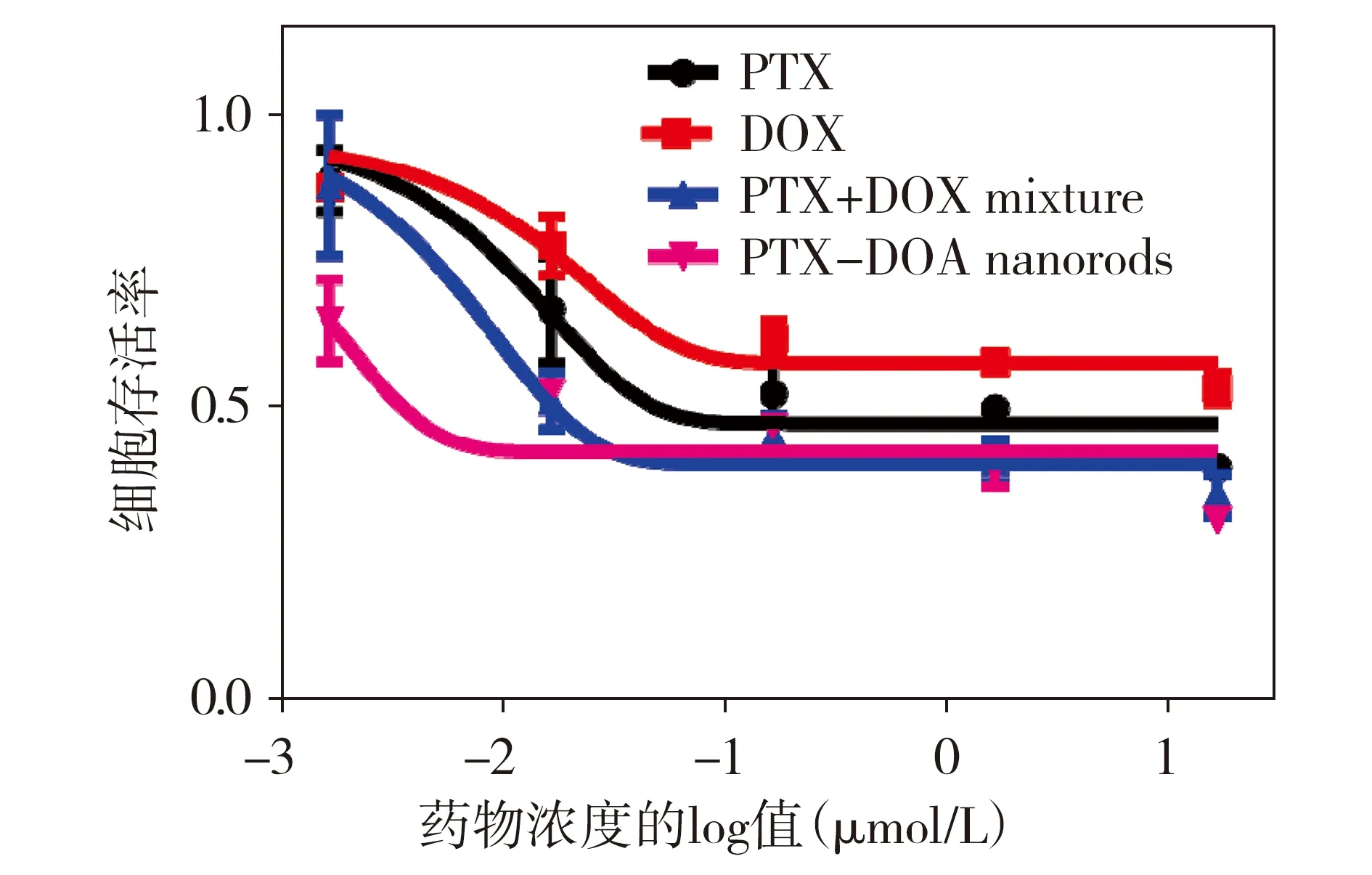
圖6 四種藥物體系對A549細胞的抑制作用 (37 ℃,48 h)Figure 6 Dose-effect profiles of four drug systems against A549 cell lines at 37 ℃ for 48 h
與正常組織相比,腫瘤微環境呈現酸性,已有報道顯示,酰胺鍵在酸性環境下容易斷裂[15],因此,通過形成酰胺鍵將DOX與兩親性的PEG分子偶聯制備DOX前藥,并對PTX納米棒功能化后所得到的PTX-DOX雙藥納米棒復合體系可響應腫瘤部位的低pH值而促進藥物釋放,在體外釋放250 h時達到大于75%的釋放量,在正常pH值的組織環境中僅釋放30%,這將減少藥物在循環過程中的過早釋放,并增強腫瘤部位的藥物富集和響應。
用一種高量子產率的紅色熒光染料DCJTB[16]標記PTX-DOX納米棒后,激光共聚焦熒光顯微鏡監測到該復合體系可被人非小細胞肺癌細胞快速內吞,2 h達到穩定狀態。進入細胞后,該復合體系在更低的用藥濃度下表現出協同增強的抗腫瘤活性,用PTX、DOX、PTX+DOX混合物、PTX-DOX納米棒分別與A549細胞共孵育48 h,藥物抑制腫瘤細胞的IC50值分別為0.043,16,0.016,0.003 μmol/L,由此可知,藥物的抗腫瘤活性順序為:PTX-DOX納米棒>PTX+DOX混合物>PTX>DOX,PTX-DOX納米棒的細胞毒性增強,主要解釋為這種納米雙藥可利用單一體系同時提供比例一致的聯合藥物有效載荷,從而使它們的組合效果最大化;而在簡單的雙藥混合體系中,藥物攝取的差異和細胞中藥物的隨機分布會影響藥物的組合療效;單一用藥或分子態藥物由于通過濃度依賴的擴散機制進入細胞,容易產生耐藥而導致活性降低,這一結果凸顯了納米棒雙藥復合體系用于惡性腫瘤協同靶向治療的優勢和重要性。
4 小結
本研究以提高非小細胞肺癌的治療效果并減小傳統化療藥物的耐藥性為出發點,將紫杉醇和阿霉素組合到一個納米級藥物釋放系統中,成功制備出以PTX納米棒為核,用兩親性的DOX前藥對其表面功能化修飾后得到核-殼型的PTX-DOX納米棒復合藥物釋放系統,該體系可在體液環境下長期穩定保存6個月以上,靈敏地響應腫瘤部位的酸環境,被腫瘤細胞快速內吞并有效釋放,表現出協同增強的抗腫瘤活性,且對正常組織安全低毒。這種新型的組合策略和協同增效方法可廣泛應用于其他多種藥物體系和疾病類型,為癌癥的早期診斷和高效治療提供設計思路和技術指導。

