長時間不同頻率電刺激對C2C12肌管細胞代謝指標和基因表達的影響
孫景權 上官若男 李松波 嚴翊 謝敏豪



摘? ? 要:探究長時間不同頻率EPS對C2C12肌管細胞代謝指標和基因表達的影響,試圖建立EPS誘發C2C12肌管細胞TG堆積和線粒體功能增強的細胞模型。方法:采用4種EPS方案誘發C2C12肌管細胞收縮,實驗分為5組:對照組(C組)、30 V+2 ms+0.5 Hz組(0.5 Hz組)、30 V+2 ms+1 Hz組(1 Hz組)、30 V+2 ms+5 Hz組(5 Hz組)、30 V+2 ms+10 Hz組(10 Hz組)。比色法檢測細胞內TG、乳酸和ATP含量,RT-PCR方法檢測細胞中IL-6、MyHCⅠ、MyHCⅡa、MyHCⅡb、MyHCⅡx、Cyt C和PGC-1α等mRNA含量。結果:1)與C組相比,EPS后即刻,頻率0.5~10 Hz組乳酸含量非常顯著增加(P<0.01);頻率1 Hz和10 Hz組細胞中ATP含量均顯著降低(P<0.05),其中頻率0.5 Hz和5 Hz組細胞中ATP含量非常顯著降低(P<0.01)。2)與C組相比,頻率0.5 Hz和1 Hz組MyHCⅠ和MyHCⅡb的mRNA含量顯著增加(P<0.05),頻率5 Hz組MHC4種亞型mRNA含量變化不明顯(P>0.05),頻率10 Hz組MyHCⅠ、MyHCⅡa和MyHCⅡb亞型mRNA含量非常顯著降低(P<0.01),而MyHCⅡx亞型mRNA含量非常顯著增加(P<0.01)。3)與C組相比,頻率0.5~10 Hz組PGC-1α和Cyt C mRNA含量均顯著增加(P<0.05),同時EPS增加了C2C12細胞中IL-6 mRNA的含量(P<0.05)。4)與C組相比,4 d EPS方案停止后12 h,各組肌管細胞中TG含量均沒有出現變化;4 d EPS方案停止后24 h,0.5 Hz組和1 Hz組肌管細胞中TG含量增加但無顯著性(P>0.05);4 d EPS方案停止后36 h,0.5 Hz組和5 Hz組細胞中TG含量顯著增加(P<0.05)。結論:EPS方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30 V、頻率0.5 Hz或1 Hz或5 Hz、單次時長2 ms和每天3 h共2 d,EPS停止后36 h)能夠明顯誘發C2C12肌管細胞TG含量堆積和線粒體功能增強。
關鍵詞:EPS;C2C12 肌管細胞;線粒體;TG;電脈沖;模型
中圖分類號:G 804.8? ? ? ? ? 學科代碼:040302? ? ? ? ? ?文獻標識碼:A
Abstract:Objective: To explore the effect of long time and different frequency electrical stimulation on the metabolic index and gene expression in C2C12 myotubes, so as to establish a cell model for EPS-induced TG accumulation and the increase of mitochondrial function in C2C12 myotubes. Methods: Four protocols of EPS were used to induce contraction of C2C12 myotubes. The experiment was divided into five groups: control group (C group), 30V 2ms 0.5Hz group (0.5Hz group), 30V 2ms 1Hz group (1Hz group), 30V 2ms 5Hz. Group (5Hz group), 30V 2ms 10Hz group (10Hz group). Colorimetric assay was used to detect intracellular TG, lactate, and ATP content. RT-PCR was used to detect mRNA levels of IL-6, MyHCⅠ, MyHCⅡa, MyHCⅡb, MyHCⅡx, Cyt C, and PGC-1α. Results: 1) Compared with C group, the lactate content in the 0.5Hz-10Hz group was significantly increased (P<0.01) immediately after stimulation, and the ATP content in cells was significantly decreased in the 1Hz and 10Hz groups (P<0.05). However, the ATP content in cells at 0.5 Hz and 5 Hz groups significantly decreased (P<0.01). 2) Compared with C group, MyHCⅠ and MyHCⅡb were significantly increased in the 0.5 Hz/1 Hz group (P<0.05), and the four myosin heavy chain isoforms exhibited no change in 5 Hz group (P>0.05). The mRNA content of MyHCⅠ, MyHCⅡa, and MyHCⅡb subtypes was significantly decreased (P<0.01) in the 10 Hz group, while the mRNA levels of MyHCⅡx isoform was significantly increased (P<0.01). 3) Compared with C group, the mRNA content of PGC-1α and Cytochrome C were significantly increased (P<0.05) in 0.5-10 Hz group, and the mRNA content of IL-6 was significantly increased by EPS in C2C12 cells (P<0.05). 4) Compared with C group, TG content in EPS groups did not change in 12h after 4d electrical stimulation, and the TG content in 0.5Hz and 1Hz groups were increased in 24h after 4d electrical stimulation but there was no significant difference (P>0.05); however, the TG content in 0.5 Hz and 5 Hz groups were significantly increased in 36h after 4d electrical stimulation (P<0.05). Conclusion: the EPS protocols (Voltage 14V, a single stimulation duration 2ms, frequency 1Hz, a stimulation time of 2h, a total 2 days, followed by, voltage 30 V, a single stimulation duration 2ms, frequency 0.5 Hz or 1 Hz or 5Hz, a stimulation time of 3 h, and a total 2 days) have induced TG accumulation and mitochondrial function enhancement in C2C12 myotubes.
Keywords:EPS; C2C12 myotubes; mitochondria; TG; electrical pulse stimulation; model
許多研究表明,長期耐力訓練能夠增加骨骼肌細胞中甘油三酯(triglyceride,TG)的含量和線粒體氧化脂肪酸能力,這與耐力性項目運動員骨骼肌耐力水平的增加有直接關系[1-3]。在長時間低強度運動中,骨骼肌收縮所需要的能量中有90%來源于游離脂肪酸的氧化代謝[4]。肌細胞內TG作為局部的高密度能量,其可以通過脂解作用釋放脂肪酸來為骨骼肌收縮提供能量[5-6]。不論是耐力性項目運動員[7-8]、Ⅱ型糖尿病患者[2]還是老年人人群(60~75歲)[1,9],長時間中等強度的運動鍛煉均可以提升骨骼肌細胞的TG含量、骨骼肌胰島素敏感性、Ⅰ型骨骼肌纖維脂肪酸利用能力及骨骼肌整體氧化能力,但是運動誘發骨骼肌出現這些健康效應的分子機制還不清楚。通過研究骨骼肌細胞對收縮刺激的適應性變化,是闡明運動誘發骨骼肌產生健康效應機制的主要方法之一[10]。
一個科學的體外細胞培養模型是研究生物學現象機制的重要工具。在細胞培養中,電脈沖刺激(electrical pulse stimulation,EPS)能夠加快骨骼肌細胞(肌管)分化,它能夠替代神經電信號激活骨骼肌纖維[11-12]。目前,一些研究中已經出現使用EPS誘導細胞收縮的模型[13]。1997年,有研究發現,采用EPS激活培養的骨骼肌細胞后,其能夠引起骨骼肌細胞產生收縮[11]。隨后在2007年,有研究發現EPS能夠加速骨骼肌細胞肌節的形成[12]。近幾年,許多研究發現EPS能夠誘發骨骼肌細胞相關基因表達和代謝特征的變化。例如一次性長時間EPS(14 V,1 ms,50 Hz,24 h)能夠顯著增加氧化型MyHCⅠ和MyHCⅡx,同時增加PGC-1α、Cyt C和中鏈乙酰輔酶A脫氫酶(medium chain acyl-coA dehydrogenase,MCAD)蛋白表達量,即顯著增加骨骼肌氧化功能[14]。一次性短時間高頻EPS(電壓30 V,單次時長200 ms,頻率100 Hz,持續5~60 min)能夠顯著增加骨骼肌細胞脫氧葡萄糖攝入量和乳酸產生量,同時降低磷酸肌酸含量;而一次性長時間低頻EPS顯著增加骨骼肌細胞葡萄糖和脂肪酸氧化能力,丙酮酸脫氫酶復合物4、IL-6、Cyt C、肉堿棕櫚酰轉移酶B和MyHCⅠ蛋白和mRNA表達量顯著增高[13]。但是,目前還鮮少見到長時間EPS誘發骨骼肌細胞收縮進而導致TG堆積和線粒體功能增強的成功建立的細胞模型。
綜上所述,本研究采用長時間不同頻率的EPS方案誘發C2C12肌管細胞收縮,檢測C2C12細胞中TG含量、乳酸含量、肌細胞收縮蛋白和線粒體相關功能蛋白含量變化情況,試圖建立EPS誘發C2C12肌管細胞收縮并伴隨TG堆積和線粒體功能增加的細胞模型,為進一步研究長期運動鍛煉增加肌細胞中TG含量并伴隨線粒體功能增強的機制提供實驗基礎。
1? ?材料和方法
1.1? 細胞培養
小鼠成肌細胞細胞株C2C12(CRL-1772),接種于含培養基的100 mm培養皿中,在37 ℃、5%CO2恒溫培養箱中培養。培養基包含高糖DMEM(4.00 mM L-谷氨酰胺,4 500 mg/L葡萄糖,無丙酮酸鈉,HyClone,貨號SH30022.01,美國猶他州洛根市)、10%胎牛血清(Ausvin,貨號VS500T,澳大利亞)、1%青鏈霉素混合液(貨號KGY0023,購自江蘇凱基生物技術有限公司)。使用0.25%胰蛋白酶-EDTA消化液(貨號KGY0012,購自江蘇凱基生物技術有限公司)進行細胞消化。對于本次實驗,細胞被鋪入6孔板(Corning,New York,USA)。當6孔板中細胞融合到90~95%時,將C2C12細胞培養基更換為分化培養基(高糖DMEM,2%馬血清,1%青鏈霉素混合液)。每24 h更換一次分化培養基。細胞分化4~6 d后,分化完成的肌管細胞被用于EPS處理。
1.2? EPS方案
本研究使用儀器C-Pace EP culture pacer(IonOptix,Dublin,Ireland)產生EPS使肌管細胞收縮。此儀器能夠發出雙極性脈沖到懸掛在培養基中的C-dish碳電極上。EPS方案如下:EPS共持續4 d,第1天和第2天:電壓14 V,單次刺激時長2 ms,頻率1 Hz,電刺激總時間2 h;第3天和第4天:電壓30 V,單次刺激時長2 ms,頻率分別為0.5 Hz、1 Hz、5 Hz和10 Hz,電刺激總時間3 h(見表1)。基于此,本研究實驗細胞被分為5組:對照組(C組)、30 V+2 ms+0.5 Hz組(0.5 Hz組)、30 V+2 ms+1 Hz組(1 Hz組)、30 V+2 ms+5 Hz組(5 Hz組)、30 V+2ms+10 Hz組(10 Hz組),其中C組為未進行電刺激組。每1組均包含6個孔的細胞作為檢測對象(n=6)。EPS前1 h每孔更換2 mL新配分化培養基。EPS每天進行1次,共持續4 d。根據以往研究[14],在最后一次EPS后3 h收集細胞提取總RNA進行MHC亞型、IL-6、PGC-1α、Cyt C等mRNA含量測試。另外,分別在最后一次EPS后即刻、12 h、24 h和36 h后收集細胞,使用裂解液后提取蛋白質和進行TG、ATP等含量的測試。

1.3? 細胞中TG測試
肌管細胞中總TG含量采用組織甘油三酯酶法測定試劑盒(組織細胞)(E1013,購自北京普利萊(APPLYGEN)基因技術有限公司)進行測試,操作步驟按照試劑盒說明書進行。最后使用酶標儀(benchmark plus microplate spectrophotometer,BIO-RAD,California,USA) 在550 nm波長下測量吸光度。根據標準樣品讀數繪制標準曲線,并計算樣品中TG濃度。樣品中相對TG含量使用細胞總蛋白濃度進行校準。
1.4? 細胞中乳酸含量測試
細胞中乳酸含量測定使用乳酸比色法測定試劑盒(貨號:#K607-100,BioVision,Milpitas CA,USA),測試方法依照說明書進行。最后,使用酶標儀(BIO-RAD,California,USA)在波長570 nm下讀取吸光度。根據標準曲線計算出樣品中乳酸含量(nmoL),根據公式計算:
樣品乳酸濃度=每孔中乳酸含量(nmoL)/每孔中樣品體積(μL)×樣品稀釋比例。(1)
樣品中相對乳酸含量使用細胞總蛋白濃度進行校準。
1.5? 細胞中ATP含量測試
細胞中ATP含量測試使用ATP檢測試劑盒(貨號:S0026,購自上海碧云天生物技術有限公司),測試方法依照說明書進行。最后,在檢測孔內加上20 μL樣品或標準品,迅速用微量移液器混勻,至少間隔2 s后,用GloMaxR 20/20 Luminometer化學發光檢測儀(貨號:E5311,美國Promega-GloMax Promega GloMax)測定RLU值;根據標準曲線計算出樣品中ATP的濃度,相對ATP含量用樣品中蛋白濃度校準。
1.6? 蛋白質提取及濃度測定
6孔板中每孔加細胞裂解液(貨號:110000-L2,購自北京賽馳生物科技有限公司) 200? μL,用細胞刷將細胞刮下,收集在1.5 mL離心管中,置于冰上。用槍頭反復吹吸細胞沉淀,8~10次,以充分懸浮細胞。旋渦劇烈震蕩1 min,靜置15 min。期間取出震蕩2~3次,每次30 s。4 ℃離心,12 000 g,15 min,將上清分裝至預冷離心管中,-80 ℃保存備用。總蛋白濃度測定采用Thermo Scientific公司的BCA蛋白定量分析試劑盒(Prod# 23225,Life technologies,Eugene,Oregon),采用BSA作為標準液制作標準曲線,測試方法依照說明書進行。
1.7? 實時熒光定量RT-PCR
細胞中總RNA提取采用TaKaRa MiniBEST Universal RNA Extraction Kit(貨號9767,Takara),操作步驟按照試劑盒說明書進行。然后,使用微量分光光度計(NanoDrop 2000)測定總RNA濃度,純度要求:A260/A280比值在1.9~2.0,RNA濃度=A260×稀釋倍數×0.04 μg/μL。提出的mRNA使用PrimeScriptTM RT Master Mix (Perfect Real Time)(貨號:RR036A,Takara)來進行逆轉錄。然后Bio-RAD上機,反轉錄程序為37 ℃15 min,85 ℃5 s,4 ℃無窮。
實時熒光定量RT-PCR。使用SYBRR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(貨號:RR820A,Takara)試劑盒。按照試劑盒說明書要求配制20 μL的反應體系,在Applied Biosystems7500 Fast Real-Time PCR System儀器上進行定量分析。兩步法 PCR 擴增標準程序:95 ℃預變性30 s;95 ℃ 5 s,60 ℃ 30~34 s的PCR反應設置40個循環;之后熔解曲線程序95 ℃ 15 s,60 ℃15 s,95 ℃ 60 s,并且用核糖體18S1 RNA作為內參基因校準。PGC-1α、MyHCⅠ、MyHCⅡa、MyHCⅡx、MyHCⅡb、Cyt C、IL-6和18S rRNA mRNA采用SYBR green方法進行檢測。引物購自生工生物工程(上海)股份有限公司,序列見表2,并且用18S rRNA進行內參基因校準。定量方法用2—△△Ct表示基因的表達量。計算公式為:
△△Ct=[Ct(實驗組目的基因)-Ct(18S1)]-[Ct(對照組目的基因)-Ct(18S1)](2)

1.8? 數據處理方法
數據以平均數±標準誤(X±SEM)表示,采用SPSS18.0統計軟件進行處理。組間比較采用單因素方差分析,顯著水平取P<0.05,非常顯著水平取P<0.01。作圖軟件采用Excel 2010和GraphPad Prism 5。
2? ?結果
2.1? 一次性EPS對C2C12肌管細胞中乳酸和ATP含量的影響
為了檢測EPS誘導肌管細胞收縮后細胞中乳酸和ATP含量的變化,分化4~6 d的肌管細胞先進行2 d EPS(電壓14 V,單次刺激時長2 ms,頻率1 Hz,EPS總時間2 h/d),第3 d進行一次性高電壓不同頻率刺激(電壓30 V,單次刺激時長2 ms,頻率分別為0.5 Hz、1 Hz、5 Hz和10 Hz,EPS總時間3 h)。EPS后即刻收集細胞檢測乳酸和ATP含量,采用單因素方差分析事后檢驗方法計算結果。

如圖1所示,與C組相比,一次性的電壓30 V、頻率0.5 Hz和10 Hz、單次時長2ms、共3 h的EPS均能顯著升高刺激即刻時C2C12肌管細胞中乳酸含量(P<0.05),同時發現電壓30 V、頻率1 Hz和5 Hz、單次時長2 ms、共3 h的EPS均能非常顯著升高刺激即刻時C2C12肌管細胞中的乳酸含量(P<0.01)。如圖2所示,與C組相比,一次性的電壓30 V、頻率0.5~10 Hz、單次時長2 ms共3 h的EPS均能夠非常顯著降低C2C12細胞中的ATP含量(P<0.01)。
2.2? 不同EPS方案對C2C12肌管細胞中MHC亞型mRNA含量的影響
本研究觀察這幾種EPS方案是否能夠改變C2C12肌管細胞中4種MHC亞型的mRNA含量。如圖3所示,與C組相比,電壓30 V、頻率0.5 Hz、單次時長2 ms共3 h的EPS有增加氧化型蛋白重鏈Ⅰ型(P<0.05)和快肌纖維標志性肌球蛋白重鏈Ⅱb型mRNA含量的趨勢,但未見顯著性(P<0.05)。電壓30 V、頻率1 Hz、單次時長2 ms共3 h的EPS能夠顯著增加氧化型蛋白重鏈I型(P<0.05)和快肌纖維標志性肌球蛋白重鏈Ⅱb型mRNA含量(P<0.01)。而電壓30 V、頻率5 Hz、單次時長2 ms共3 h的電刺激對骨骼肌MHC4種亞型mRNA含量的影響不明顯。然而,電壓30 V、頻率10 Hz、單次時長2 ms共3 h的EPS非常顯著降低MyHCⅠ、MyHCⅡa和MyHCⅡb亞型mRNA含量(P<0.01),非常顯著增加MyHCⅡx亞型mRNA含量(P<0.01)。

2.3? 不同EPS方案對C2C12肌管細胞中線粒體相關功能蛋白mRNA含量的影響
本研究檢測了EPS對線粒體相關蛋白Cyt C、PGC-1α和IL-6mRNA含量的影響。如圖4A所示,與C組相比,電壓30 V、頻率0.5~10 Hz、單次時長2 ms的EPS方案均能夠顯著增加C2C12肌管細胞中Cyt C mRNA表達量(P<0.05)。如圖4B所示,與C組相比,電壓30 V、頻率1~10 Hz、單次時長2 ms的EPS方案均能夠顯著增加C2C12肌管細胞中PGC-1αmRNA含量(P<0.05),而0.5 Hz組有增加趨勢但無顯著性(P>0.05)。如圖4 C所示,與C組相比,隨著頻率的增加,C2C12細胞中IL-6 mRNA含量出現增加趨勢,至10 Hz呈現非常顯著性增加(P<0.01)。

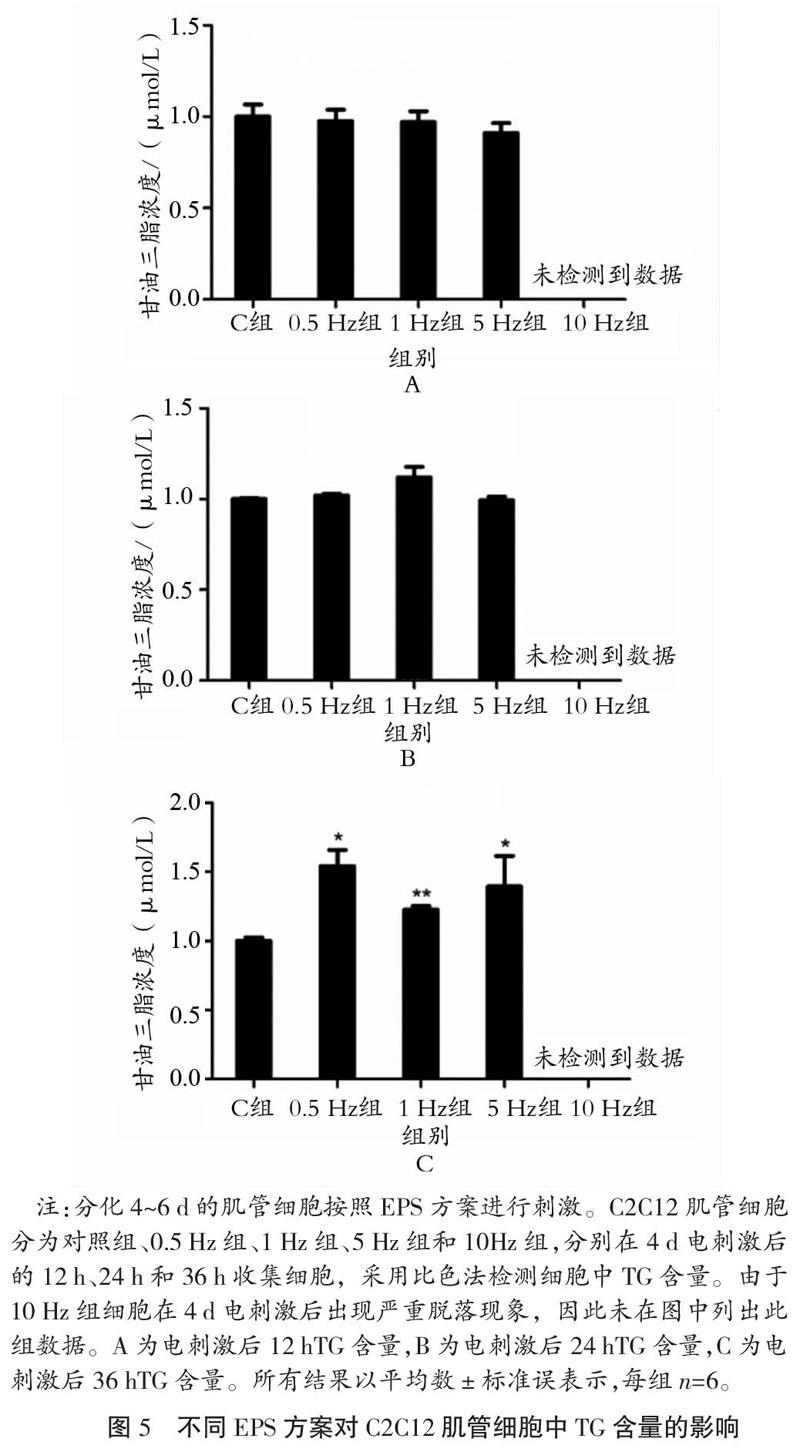
2.4? 不同EPS方案對C2C12肌管細胞中TG含量的影響
如圖5所示,與C組相比,4 d電刺激方案(電壓30 V,頻率0.5~5 Hz,單次時長2 ms)停止后12 h肌管細胞中TG含量均沒有出現變化。4 d電刺激方案停止后24 h,與C組相比, 0.5 Hz組和1 Hz組肌管細胞中TG含量增加但未見顯著性(P>0.05)。4 d電刺激方案停止后36 h,與C組相比,0.5 Hz組和5 Hz組細胞中TG含量顯著增加(P<0.05),1 Hz組細胞中TG含量非常顯著增加(P<0.01)。
3? ?討論
本文的研究目的是采用EPS誘發C2C12肌管細胞收縮來模擬運動性骨骼肌收縮,從而研究不同EPS方案對C2C12肌管細胞TG、乳酸、ATP、MHC亞型和線粒體相關功能蛋白mRNA含量的影響,試圖建立EPS誘發C2C12肌管細胞TG堆積和線粒體功能增加模型,為研究長期運動鍛煉增加骨骼肌細胞中TG堆積并伴隨線粒體功能增加的機制提供實驗方案。本研究結果如下:1)一次性的電壓30 V、頻率0.5~10 Hz、單次時長2 ms共3 h的電刺激均能夠非常顯著增加C2C12細胞中乳酸含量并降低ATP含量;2)電刺激方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30 V、頻率0.5 Hz或1 Hz或5 Hz、單次時長2 ms和每天3 h共2 d,EPS停止后36 h)均能夠顯著誘發骨骼肌細胞中TG堆積和線粒體功能蛋白mRNA含量增加,在細胞水平上為進一步建立長期運動鍛煉誘發骨骼肌細胞TG堆積和線粒體功能增強模型打下良好基礎。
3.1? 不同EPS方案誘發的C2C12肌管細胞收縮
規律性體力活動對健康具有促進作用,比如預防和治療各種慢性疾病(Ⅱ型糖尿病、心血管疾病、抑郁癥等)[15]。研究還顯示運動過程中收縮的骨骼肌通過分泌肌因子參與調節運動使健康受益的過程[16]。近年來,在關于骨骼肌細胞運動適應性分子機制的研究中,EPS刺激骨骼肌細胞已經作為鑒定新穎肌肉因子的主要工具。尤其是近來發現的人類骨骼肌細胞的EPS方案,其對于理解規律性運動和健康促進之間分子機制具有重要作用[17]。體外細胞模型可能適用于研究收縮細胞(尤其是不同運動方案誘發細胞收縮)的信號通路和代謝適應性變化過程[18]。使用模擬骨骼肌收縮的體外模型,在理解骨骼肌代謝調控作用與其他器官之間復雜和多方向的“crosstalk”方面已經起到實質性進展[19]。研究表明,在細胞培養水平上,給予細胞EPS處理有利于骨骼肌細胞分化成肌管細胞,這些研究顯示EPS能夠激活骨骼肌細胞并且可以作為一種神經電信號的替代方法[11-12]。早期研究發現,不同電刺激方案誘導MHC亞型中快肌和慢肌的特異性改變,因此,確認EPS是研究體外骨骼肌收縮活性的一種有效模型[20]。C2C12細胞和主要大鼠細胞株對EPS是敏感的,它們主要被用于研究骨骼肌收縮-誘導代謝改變的過程。第1個報道EPS作為一種體外運動模型應用到骨骼肌細胞研究中的是C2C12細胞[21]。在此研究中,Nedachi等 [21]發現EPS誘導肌細胞出現明顯收縮,同時伴隨AMPK和MAPK激活、葡萄糖攝入量和胰島素敏感性增加。本研究首先要確定不同EPS方案是否能夠誘發C2C12肌管細胞收縮,采用EPS后肌管細胞中乳酸含量、ATP含量及MHC亞型mRNA含量變化作為判定肌管細胞收縮的指標。Nikolic等[13]采用一次性高頻率EPS方案(30 V,100 Hz,間歇5 s,脈沖持續時間200 ms共5~60 min)能夠顯著增加細胞內乳酸含量、增加葡萄糖攝入量、降低ATP和PCr含量。本研究采用EPS方案為:分化4~6 d的肌管細胞,先進行2 d EPS(電壓14 V,單次刺激時長2 ms,頻率1 Hz,電刺激總時間2 h/d),其目的為利用此EPS方案來加速C2C12肌管與肌小節的生成[12];第3 天和第4 天分別進行一次高電壓不同頻率刺激(電壓30 V,單次刺激時長2 ms,頻率分別為0.5 Hz、1 Hz、5 Hz和10 Hz,EPS總時間3 h)。本研究結果發現:一次性EPS方案(電壓30 V、頻率0.5和10 Hz、脈沖2 ms 共3 h)也能夠顯著增加刺激后即刻細胞內乳酸含量,同時降低細胞內ATP含量。另一個EPS方案(電壓11.5 V,頻率1 Hz,脈沖2 ms共2~24 h)也發現低頻刺激能夠導致細胞骨架的重組、肌節結構重新合成和肌管明顯收縮[22]。這些結果說明本研究采用的EPS方案能夠促進肌管細胞收縮并消耗ATP作為能源供應。同時本研究也成功建立C2C12肌管細胞收縮后乳酸堆積模型,而且發現電壓30 V是誘導C2C12肌管細胞乳酸堆積的一個關鍵參數。另外,MHC亞型基因表達情況常被用于區分不同骨骼肌纖維類型[23]。大量的研究表明,EPS能夠導致MHC亞型基因表達的改變。長時間低頻EPS促進大鼠肌管細胞分化和增加慢肌纖維類型標志物MyHCⅠ表達[24]。同時,在持續2周EPS過程中,肌纖維由快肌類型逐漸過渡到慢肌類型[25]。也有研究發現,1周EPS方案(電壓7.5 V,頻率3 Hz,脈沖10 ms,每次10 min)和1周EPS方法(電壓7.5 V、頻率3 Hz,脈沖10 ms,每次30 min)均使快肌纖維表達量降低而慢肌纖維則無改變[26]。另外,研究報道:電壓30 V、頻率1 Hz、脈沖時長2 ms共24 h或者48 h 的EPS能夠顯著增加MyHCⅠ(慢縮氧化型肌纖維標志物)含量[13]。這些結果表明,長時間低頻EPS促進肌管細胞慢肌纖維增加。本研究數據也顯示:電壓30 V、頻率0.5 Hz或1 Hz、單次時長2 ms共3 h的EPS能夠顯著增加MyHCⅠ和MyHCⅡb型mRNA含量,這說明這一EPS方案能夠顯著增加骨骼肌氧化型和快速收縮型肌纖維含量,這可能與本研究所采用的電刺激方案中電壓較大且持續時間相對較短有關。而電壓30 V、頻率10 Hz、單次時長2 ms共3 h的EPS相對C2C12肌管細胞來說強度較大,主要以增加快縮型MyHCⅡb亞型mRNA含量為主。另外,IL-6被認為是機體骨骼肌收縮的另一個標志細胞因子[27-28]。Nedachi等[21]研究發現24 hEPS(頻率1 Hz)誘導C2C12細胞中許多來源于收縮骨骼肌細胞肌因子的表達,例如IL-6和CXCL等。本研究也發現:EPS方案能夠使C2C12肌管細胞中IL-6 mRNA含量增加,而且呈現頻率依賴性。綜合這些數據,認為本研究采用的EPS方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30V、頻率0.5 Hz~10 Hz、單次時長2 ms和每天3 h共2 d)能夠誘發C2C12肌管細胞收縮。
3.2? 長時間不同頻率EPS誘發C2C12肌管細胞代謝指標和基因表達變化
大量研究表明,長時間耐力訓練能夠增加骨骼肌細胞中TG含量和線粒體功能。例如耐力性項目運動員往往伴隨著骨骼肌細胞中脂滴含量增加和線粒體功能增強[7-8]。同時,長時間鍛煉中老年人其骨骼肌細胞中脂質含量顯著增加伴隨骨骼肌氧化能力增強[1,7]。另外,有研究發現2周的訓練(有氧耐力和間隙功率自行車訓練)就能夠使無訓練男性(年齡(23.3±3.2)歲)股外側肌中的IMCL顯著增加(42±14)%[3],但是其機制目前尚不清楚。建立一種能夠模擬長時間運動誘發骨骼肌收縮的體外細胞模型從而研究其機制顯得尤為重要。本研究探究了長時間不同頻率EPS對C2C12肌管細胞代謝指標和基因表達的影響,其將為研究長時間耐力訓練增加骨骼肌細胞TG含量的機制提供幫助。本研究發現:電壓30 V、單次刺激時長2 ms、頻率分別為0.5 Hz或1 Hz或5 Hz、停止電刺激后36 h的方案能夠顯著增加C2C12肌管細胞TG含量。本研究結果顯示:EPS能夠顯著增加C2C12肌管細胞分泌乳酸含量、降低ATP含量和改變MHC亞型mRNA含量等,本研究認為此EPS方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30 V、頻率0.5 Hz或1 Hz或5 Hz、單次時長2 ms和每天3 h共2 d,EPS停止后36 h)是可用于研究長期運動訓練誘導骨骼肌TG堆積的成功建立的細胞模型。
另外,耐力訓練誘發線粒體功能和氧化能力增強[29-30]。PGC-1α作為一個轉錄調節因子,是線粒體功能和合成增加的關鍵調節蛋白[31]。作為肌肉訓練的標志蛋白,PGC-1α常被認為是運動誘發骨骼肌出現代謝改變的細胞內因子[13,32]。PGC-1α這一線粒體蛋白是作為轉錄因子發揮作用,其mRNA含量代表著線粒體功能和合成能力[31]。研究發現長時間EPS能使PGC-1αmRNA含量增加2.4~2.9倍[14]。Cyt C是線粒體氧化呼吸電子傳遞鏈成分,其含量高低代表著細胞線粒體氧化還原功能[33]。本研究采用的EPS方案均能夠顯著增加C2C12肌管細胞中PGC-1α和Cyt C 的mRNA含量。另外,被認為是機體骨骼肌收縮的標志肌源性細胞因子之一的IL-6[27-28],EPS后細胞中含量也出現增多。Nikolic等[13]采用的48 hEPS能夠增加線粒體含量和檸檬酸合成酶活性。Lambernd等[22]發現24 hEPS方案可增加蛋白復合物Ⅱ、Ⅳ和Ⅴ含量。這些說明EPS使C2C12肌管細胞線粒體出現適應性變化,線粒體功能增強。EPS誘導PGC-1α增加與骨骼肌氧化型肌纖維類型增多的結果是一致的,因此PGC-1α作為轉錄調節因子,它的升高伴隨著骨骼肌類型由糖酵解、快縮型向氧化型肌纖維類型轉化[34-35]。EPS誘發C2C12肌管細胞Cyt C和PGC-1α mRNA含量的增加,這可能是由于EPS促使肌管細胞收縮分泌乳酸引起的。因為研究發現:6 h乳酸處理L6細胞后其Cyt C和PGC-1α的mRNA含量和蛋白含量顯著增加[36]。綜上所述,電刺激方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30 V、頻率0.5 Hz或1 Hz或5 Hz、單次時長2 ms和每天3 h共2 d,EPS停止后36 h)均能夠顯著誘發骨骼肌細胞中線粒體功能蛋白mRNA含量增加,同時“乳酸”這一代謝物將為長期運動訓練增加骨骼肌線粒體功能增加提供新思路。
4? ?結論
EPS方案(電壓14 V、頻率1 Hz、單次時長2 ms和每天2 h共2 d,緊接著,電壓30 V、頻率0.5 Hz或1 Hz或5 Hz、單次時長2 ms和每天3 h共2 d,EPS停止后36 h)能夠誘發C2C12肌管細胞TG堆積和線粒體功能增強,該方案是誘發C2C12肌管細胞TG堆積和線粒體功能增強的成功建立的細胞模型。
參考文獻:
[1]? PRUCHNIC R, KATSIARAS A, HE J, et al. Exercise training increases intramyocellular lipid and oxidative capacity in older adults[J]. Am J Physiol Endocrinol Metab, 2004, 287(5): 857.
[2]? SHAW C S, SHEPHERD S O, WAGENMAKERS A Journal, et al. Prolonged exercise training increases intramuscular lipid content and perilipin 2 expression in type I muscle fibers of patients with type 2 diabetes[J]. Am J Physiol Endocrinol Metab, 2012, 303(9): 1158.
[3]? SCHRAUWEN-HINDERLING V B, SCHRAUWEN P, HESSELINK M K, et al. The increase in intramyocellular lipid content is a very early response to training[J]. J Clin Endocrinol Metab,2003, 88(4): 1610.
[4]? HAVEL R J. Influence of intensity and duration of exercise on supply and use of fuels[M]. New York: Plenum, 1971: 315.
[5]? HURLEY B F, NEMETH P M, MARTIN W R, et al. Muscle triglyceride utilization during exercise: effect of training[J]. J Appl Physiol (1985), 1986, 60(2): 562.
[6]? HOPPELER H, HOWALD H, CONLEY K, et al. Endurance training in humans: aerobic capacity and structure of skeletal muscle[J]. J Appl Physiol (1985), 1985, 59(2): 320.
[7]? GOODPASTER B H, HE J, WATKINS S, et al. Skeletal muscle lipid content and insulin resistance: evidence for a paradox in endurance-trained athletes[J]. J Clin Endocrinol Metab, 2001, 86(12): 5755.
[8]? AMATI F, DUBE J J, ALVAREZ-CARNERO E, et al. Skeletal muscle triglycerides, diacylglycerols, and ceramides in insulin resistance: another paradox in endurance-trained athletes [J]. Diabetes, 2011, 60(10): 2588.
[9]? DUBE J J, BROSKEY N T, DESPINES A A, et al. Muscle characteristics and substrate energetics in lifelong endurance athletes[J]. Med Sci Sports Exerc, 2016, 48(3): 472.
[10]? NEDACHI T, FUJITA H, KANZAKI M. Contractile C2C12 myotube model for studying exercise-inducible responses in skeletal muscle[J]. Am J Physiol Endocrinol Metab, 2008, 295(5): 1191.
[11]? THELEN M H, SIMONIDES W S, VAN HARDEVELD C. Electrical stimulation of C2C12 myotubes induces contractions and represses thyroid-hormone-dependent transcription of the fast-type sarcoplasmic-reticulum Ca2+-ATPase gene[J]. Biochem J, 1997, 321 (3): 845.
[12]? FUJITA H, NEDACHI T, KANZAKI M. Accelerated de novo sarcomere assembly by electric pulse stimulation in C2C12 myotubes[J]. Exp Cell Res, 2007, 313(9): 1853.
[13]? NIKOLIC N, BAKKE S S, KASE E T, et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise[J]. PLoS One, 2012, 7(3): 33203.
[14]? BURCH N, ARNOLD A S, ITEM F, et al. Electric pulse stimulation of cultured murine muscle cells reproduces gene expression changes of trained mouse muscle[J]. PLoS One, 2010, 5(6): 10970.
[15]? PEDERSEN B K, SALTIN B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases[J]. Scand J Med Sci Sports, 2015, 25(S3): 1.
[16]? FEBBRAIO M A, PEDERSEN B K. Contraction-induced myokine production and release: is skeletal muscle an endocrine organ [J]. Exerc Sport Sci Rev, 2005, 33(3): 114.
[17]? GORGENS S W, ECKARDT K, JENSEN J, et al. Exercise and regulation of adipokine and myokine production[J]. Prog Mol Biol Transl Sci, 2015(135): 313.
[18]? NIKOLIC N, GORGENS S W, THORESEN G H, et al. Electrical pulse stimulation of cultured skeletal muscle cells as a model for in? vitro exercise - possibilities and limitations[J]. Acta Physiol (Oxf), 2017, 220(3): 310.
[19]? ECKARDT K, GORGENS S W, RASCHKE S, et al. Myokines in insulin resistance and type 2 diabetes[J]. Diabetologia, 2014, 57(6): 1087.
[20]? NAUMANN K, PETTE D. Effects of chronic stimulation with different impulse patterns on the expression? of myosin isoforms in rat myotube cultures[J]. Differentiation, 1994, 55(3): 203.
[21]? NEDACHI T, FUJITA H, KANZAKI M. Contractile C2C12 myotube model for studying exercise-inducible responses in skeletal muscle[J]. Am J Physiol Endocrinol Metab, 2008, 295(5): 1191.
[22]? LAMBERND S, TAUBE A, SCHOBER A, et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways[J]. Diabetologia, 2012, 55(4): 1128.
[23]? SPANGENBURG E E, BOOTH F W. Molecular regulation of individual skeletal muscle fibre types[J]. Acta Physiol Scand, 2003, 178(4): 413.
[24]? WEHRLE U, DUSTERHOFT S, PETTE D. Effects of chronic electrical stimulation on myosin heavy chain expression in satellite cell cultures derived from rat muscles of different fiber-type composition[J]. Differentiation, 1994, 58(1): 37.
[25]? KUBIS H P, SCHEIBE R J, MEISSNER J D, et al. Fast-to-slow transformation and nuclear import/export kinetics of the transcription factor NFATc1 during electrostimulation of rabbit muscle cells in culture[J]. J Physiol, 2002, 541(3): 835.
[26]? ZEBEDIN E, SANDTNER W, GALLER S, et al. Fiber type conversion alters inactivation of voltage-dependent sodium currents in murine C2C12 skeletal muscle cells[J]. Am J Physiol Cell Physiol, 2004, 287(2): 270.
[27]? PEDERSEN B K, STEENSBERG A, FISCHER C, et al. The metabolic role of IL-6 produced during exercise: is IL-6 an exercise factor [J]. Proc Nutr Soc, 2004, 63(2): 263.
[28]? PEDERSEN B K, STEENSBERG A, FISCHER C, et al. Searching for the exercise factor: is IL-6 a candidate [J]. J Muscle Res Cell Motil, 2003, 24(2-3): 113.
[29]? COFFEY V G, HAWLEY J A. The molecular bases of training adaptation[J]. Sports Med, 2007, 37(9): 737.
[30]? HOOD D A, IRRCHER I, LJUBICIC V, et al. Coordination of metabolic plasticity in skeletal muscle[J]. J Exp Biol, 2006, 209(12): 2265.
[31]? GLEYZER N, VERCAUTEREN K, SCARPULLA R C. Control of mitochondrial transcription specificity factors (TFB1M and TFB2M) by nuclear respiratory factors (NRF-1 and NRF-2) and PGC-1 family coactivators[J]. Mol Cell Biol, 2005, 25(4): 1354.
[32]? HANDSCHIN C. The biology of PGC-1alpha and its therapeutic potential[J]. Trends Pharmacol Sci, 2009, 30(6): 322.
[33]? JOSEPHS T M, LIPTAK M D, HUGHES G, et al. Conformational change and human cytochrome c function: mutation of residue 41 modulates caspase activation and destabilizes Met-80 coordination[J]. J Biol Inorg Chem, 2013, 18(3): 289.
[34]? LIN J, WU H, TARR P T, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres[J]. Nature, 2002, 418(6899): 797.
[35]? HANDSCHIN C, CHIN S, LI P, et al. Skeletal muscle fiber-type switching, exercise intolerance, and myopathy in PGC-1alpha muscle-specific knock-out animals[J]. J Biol Chem, 2007, 282(41): 30014.
[36]? HASHIMOTO T, HUSSIEN R, OOMMEN S, et al. Lactate sensitive transcription factor network in L6 cells: activation of MCT1 and mitochondrial biogenesis[J]. The FASEB Journal, 2007, 21(10): 2602.

