高脂飲食誘導的肥胖對SD大鼠卵泡發育及IGF-1/PI3K/Akt通路的影響
劉莉,李金麗,鄧小艷,肖慶,吳春林,胡雅君
肥胖是由于多種原因引發的體內脂肪含量過多而產生的一種臨床常見代謝性疾病,目前肥胖癥已嚴重影響人們生活質量[1]。既往研究發現肥胖患者血清中炎性因子表達水平明顯升高并可促使脂肪組織產生炎性反應,同時高表達的炎性因子又可參與胰島素信號轉導信號通路進而造成胰島素抵抗[2]。育齡女性過度肥胖導致不孕、流產及妊娠并發癥發生率明顯增加,近來研究發現女性卵泡發育、排卵等主要依賴于性激素調節系統,而性激素主要通過脂肪組織進行分泌及代謝[3]。由此推測過度肥胖引發的脂肪組織炎性反應可能影響卵泡發育,深入研究可為肥胖婦女生殖治療方案的制定提供理論依據。胰島素生長因子(insulin like growth factor-1,IGF-1)在人體內水平過度升高可通過促使卵泡閉鎖、凋亡進而降低卵巢功能[4]。同時IGF-1水平升高還可通過促使胰島素受體底物表達進而激活磷脂酰肌醇-3激酶/蛋白激酶B(phosphatidylinositol-3 kinase/protein kinase B,PI3K/Akt)信號通路,研究發現多囊卵巢綜合征患者血清IGF-1水平升高并可通過激活PI3K/Akt信號通路進而參與多囊卵巢綜合征發生過程[5]。關于IGF-1/PI3K/Akt信號通路與肥胖及卵泡發育的關系尚未闡明,因此,本研究通過構建高脂飲食誘導的肥胖大鼠模型檢測卵泡發育相關激素水平,初步探討其對IGF-1/PI3K/Akt信號通路的影響,為降低肥胖育齡女性卵泡發育異常所致的不孕不育發生率及提高輔助生殖治療效果提供一定依據,報道如下。
1 材料與方法
1.1 實驗動物 8周齡清潔級雌性SD大鼠20只,體質量180~270 g,由湖北省疾病預防控制中心實驗動物中心提供,分籠喂養且正常飲水攝食,培養條件為室溫22~25℃,濕度70%。動物許可證號:SCXK(鄂)2017-0008,動物合格證書編號No.42000600007275,實驗動物設施使用證編號No.00133206。該實驗于2017年1月—2018年1月在武漢市第一醫院中心實驗室進行,并獲得武漢市第一醫院倫理委員會批準。
1.2 主要試劑與儀器 性激素卵泡刺激素(follicle-stimulating hormone, FSH)、黃體生成素(luteinizing hormone, LH)、雌激素(estrogen, E2)、催乳素(prolactin,PRL)、睪酮(testosterone,T)放射免疫分析試劑均購自天津協和醫藥科技有限公司;白細胞介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、C反應蛋白(C reactive protein,CRP)酶聯免疫吸附(ELISA)檢驗試劑盒與三酰甘油(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein-C,LDL-C)、總膽固醇(total cholesterol,TC)檢測試劑盒均購自上海博谷生物科技有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、酸性磷酸酶(acid phosphatase,ACP)、過氧化氫酶(catalase,CAT)檢測試劑盒均購自南京建成生物研究所;兔抗鼠PI3K及其磷酸化p-PI3K、Akt及其磷酸化p-Akt單克隆抗體均購自美國Cell Signaling Technology公司;兔抗鼠IGF-1單克隆抗體購自福州邁新公司;HPR標記的山羊抗兔IgG二抗購自上海生物工程股份有限公司。核酸蛋白測定儀購自普泰生物技術公司;石蠟切片機購自湖北貝諾醫療科技有限公司;G9800全自動生化儀購自北京九強生物技術股份有限公司;DMLS2光學顯微鏡購自北京普瑞賽司儀器有限公司;SN-697B型智能放射免疫γ測量儀購自上海核所日環光電儀器有限公司。
1.3 建模與分組 20只雌性SD大鼠均進行適應性喂養1周,按照隨機數字表法選取10只作為正常飲食組,其余10只大鼠均參照張靚等[6]研究方法進行高脂喂養,喂養10周,大鼠體質量超過正常飲食組20%視為肥胖大鼠模型建模成功[7]。將建模成功的10只大鼠作為高脂飲食組,正常飲食組與高脂飲食組SD大鼠均繼續喂養1周后檢測各項指標。
1.4 動物麻醉及取材 2組大鼠禁食過夜,次日清晨采用1 ml利多卡因實施腹腔麻醉,分別摘除大鼠眼球后靜脈叢取血,采集血液樣本,置于離心機內(3 000 r/min轉速)離心20 min,收集上層血清,置于-80℃超低溫冰箱保存待測。取血后斷頸處死大鼠,并摘取卵巢,在無菌水中清洗3次,每組選取5只大鼠卵巢采用福爾馬林固定取出包埋于石蠟中。另選取5只大鼠卵巢剪碎后放入勻漿器,在冰盒中勻漿,并將勻漿液分裝到2.0 ml EP管中,剩余的卵巢組織凍存在-200℃的液氮中備用。
1.5 觀察指標與方法
1.5.1 大鼠卵巢組織病理觀察: 取石蠟包埋卵巢組織,采用石蠟切片機切片,厚度約為6 μm,蘇木精—伊紅(hematoxylin-eosin,HE)染色,100倍顯微鏡下觀察大鼠卵巢組織形態學變化,每組標本隨機選取5個視野,計算卵泡總數、成熟卵泡總數、黃體總數等。
1.5.2 血脂水平檢測:取采集的血液標本,應用全自動生化分析儀檢測2組大鼠血清TC、TG、LDL-C水平,嚴格按照試劑盒說明書進行操作。
1.5.3 卵泡發育相關激素水平檢測: 取采集的血液標本,采用放射免疫法檢測血清卵泡發育相關激素水平,應用放射免疫計數器檢測大鼠血清中FSH、 E2、P、PRL、LH、T水平。
1.5.4 血清炎性因子檢測: 取采集的血液標本,采用ELISA法檢測血清炎性因子IL-6、TNF-α、CRP水平,嚴格按照試劑盒說明書操作。
1.5.5 卵巢組織中氧化應激指標檢測:取20 mg卵巢組織,加入生理鹽水并研磨成組織勻漿,生理鹽水和勻漿液以10∶1混合,置于離心半徑為10 cm離心機內以3 000 r/min轉速離心15 min,吸取上清液,參照SOD、MDA、ACP、CAT檢測試劑盒說明書進行檢測。
1.5.6 蛋白免疫印跡法(Western-blot)檢測卵巢組織IGF-1/Akt通路相關蛋白:取100 mg大鼠卵巢組織,加入RTPA蛋白裂解液,采用BCA法測定蛋白濃度,取20 μg總蛋白進行10% SDS-PAGE凝膠電泳分離蛋白,之后移至PDVF膜,5%脫脂奶粉封閉,2 h后加入IGF-1/Akt通路相關蛋白一抗,稀釋比均為1∶1000,4℃孵育過夜,次日加入二抗(稀釋比1∶10 000),室溫孵育1 h后采用ECL法進行顯影,放入凝膠分析系統觀察各蛋白條帶并采用Quantity One圖像分析系統對各條帶進行光密度分析,各蛋白均以β-actin為內參基因,目的蛋白與內參條帶積分光密度值的比值即蛋白相對表達量。
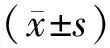
2 結 果
2.1 2組大鼠卵巢病理變化及卵泡、黃體變化比較 HE染色結果顯示,正常飲食組大鼠卵泡正常發育且內含豐富的顆粒細胞,周圍含有原始卵泡與優勢卵泡,黃體結構正常;高脂飲食組大鼠卵泡發育不正常且內含的顆粒細胞排列松散,同時向腔內塌陷且無明顯卵泡腔結構,含有不良黃體且呈彌漫性篩網狀及微囊狀結構,同時黃素化顆粒細胞減少,圖1見封3。與正常飲食組相比,高脂飲食組大鼠發育不良卵泡比率顯著升高(P<0.05),見表1。高脂飲食組黃體總數17個,異常10個(58.52%),正常飲食組黃體總數20個,無異常黃體。

表1 2組大鼠卵泡及黃體變化比較 [例(%)]
2.2 2組大鼠體質量及血脂水平變化比較 與正常飲食組相比,高脂飲食組大鼠體質量、TC、TG、LDL-C水平均顯著升高(P<0.01),見表2。
2.3 2組大鼠卵泡發育相關激素水平比較 與正常飲食組相比,高脂飲食組大鼠E2、P、FSH、LH、PRL水平均顯著降低(P<0.01),T水平顯著升高(P<0.01),見表3。
2.4 2組SD大鼠血清炎性因子及卵巢組織中氧化應激水平比較 與正常飲食組相比,高脂飲食組大鼠血清炎性因子IL-6、TNF-α、CRP水平均顯著升高(P<0.01),卵巢組織中MDA、ACP水平均顯著升高(P<0.01),SOD、CAT水平均顯著降低(P<0.01),見表4。
2.5 2組大鼠IGF-1/Akt通路蛋白表達比較 與正常飲食組相比,高脂飲食組大鼠IGF-1、p-Akt、p-PI3K蛋白表達水平均顯著升高(P<0.05),而Akt、PI3K蛋白表達水平比較差異無統計學意義(P>0.05),見圖2、表5。
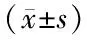
表2 2組大鼠體質量及血脂水平變化

圖2 2組大鼠IGF-1/Akt通路相關蛋白表達比較
3 討 論
女性過度肥胖可引發不孕癥、月經異常、排卵障礙及多囊卵巢綜合征等疾病,同時可增加自然流產及妊娠期高血壓、妊娠期糖尿病等風險,研究顯示肥胖女性新生兒先天性心臟病、神經管缺陷等發生風險較高[8]。肥胖患者可能通過胰島素抵抗、慢性炎性反應等病理過程影響卵母細胞發育及妊娠結局,但其具體作用機制尚未完全闡明。因此,探究肥胖對卵泡發育的影響及其可能作用機制,為提高肥胖女性輔助生殖治療效果提供依據。
肥胖是指能量攝入超過能量消耗導致脂肪組織過
度增生,TG、TC等血脂水平升高可引起脂代謝紊亂進而產生肥胖[9]。本研究通過高脂飲食誘導構建肥胖SD大鼠模型,檢測正常飲食大鼠與肥胖大鼠血脂水平,結果顯示高脂飲食組大鼠體質量、TC、TG、LDL-C水平均明顯高于正常飲食組,提示高脂飲食誘導的肥胖SD大鼠模型造模成功。HE染色可直接觀察卵巢病理組織改變[10]。本研究切取2組大鼠卵巢與子宮組織,HE染色觀察其病理改變,結果顯示正常飲食組大鼠卵巢原始卵泡、成熟卵泡較高脂飲食組均明顯增多,高脂飲食組卵泡發育不良且異常黃體數目較多,提示肥胖能阻礙SD大鼠生殖細胞正常發育并引發生殖功能失調。機體性激素調節系統主要為下丘腦—垂體—卵巢軸(HPOA),HPOA系統還涉及FSH、LH、E2等激素,激素水平變化直接影響卵泡發育[11-12]。本研究結果顯示高脂飲食組大鼠E2、P、PRL、FSH、LH水平均明顯低于正常飲食組,T水平明顯高于正常飲食組,說明E2、P、PRL、FSH、LH、T水平異常可影響卵泡發育,分析原因可能為高脂飲食誘導肥胖大鼠攝入能量過多,引起脂肪細胞堆積導致血液中T水平升高并抑制HPOA功能,進而使肥胖大鼠E2、P、PRL、FSH、LH水平降低。FSH、LH、E2等相關激素異常表達可促使HPOA功能紊亂進而導致卵泡發育停止甚至卵泡閉鎖。肥胖還是一種與炎性反應相關的疾病,本研究進一步分析高脂飲食誘導的肥胖對炎性反應及氧化應激反應的影響,結果顯示高脂飲食組大鼠血清炎性因子IL-6、TNF-α、CRP水平均明顯高于正常飲食組,高脂飲食組大鼠卵巢組織中氧化應激指標MDA、ACP水平均明顯高于正常飲食組, SOD、CAT水平均明顯降低。有研究顯示肥胖型多囊卵巢綜合征患者血清中IL-6、TNF-α、CRP水平均明顯升高,其中IL-6作為一種前炎性細胞因子與胰島素抵抗指數呈正相關,IL-6、TNF-α、CRP均與LH、FSH密切相關[13]。同時肥胖大鼠體內炎性反應還可促使卵巢組織發生氧化應激反應,MDA、ACP、SOD、CAT異常表達可反映卵巢組織氧化應激水平變化[14-16]。提示高脂飲食誘導的肥胖可能通過加重大鼠體內炎性反應及氧化應激反應,干擾HPOA功能進而促使FSH、LH、E2等卵泡發育相關激素水平異常從而影響卵泡發育。
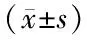
表3 2組大鼠卵泡發育相關激素水平變化比較
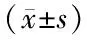
表4 2組大鼠血清炎性因子及卵巢組織中氧化應激水平比較
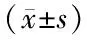
表5 2組大鼠IGF-1/Akt通路相關蛋白的表達比較
卵巢組織中IGF-1呈高表達時,通過抑制其表達可改善HPOA調節功能進而促使初級卵泡發育為優勢卵泡,同時可通過提高大鼠FSH、LH、E2等激素水平抑制卵巢組織中IGF-1表達進而恢復大鼠排卵功能[17-18]。IGF-1主要由卵巢、肝臟、脂肪組織合成分泌,研究發現IGF-1表達水平升高可促使雄激素過量合成進而擾亂HPOA調節系統[19]。IGF-1/PI3K/Akt信號通路可參與蛋白質合成代謝相關過程,通過激活該信號通路可對糖尿病骨骼肌發育發揮保護作用[20-22]。PI3K/Akt信號通路對炎性反應、腫瘤發生及發展過程均發揮重要作用,研究顯示多囊卵巢綜合征患者IGF-1表達水平升高可激活PI3K/Akt信號通路[23]。本研究結果顯示,高脂飲食組大鼠IGF-1、p-Akt、p-PI3K表達水平均明顯高于正常飲食組,分析原因可能為肥胖大鼠IGF-1水平過度升高可增加卵巢對黃體生成素的敏感性進而促使卵泡閉鎖并抑制優勢卵泡發育,同時IGF-1可通過與胰島素樣生長因子受體結合并促使胰島素受體底物發生磷酸化進而激活PI3K/Akt信號通路[24]。提示高脂飲食誘導的肥胖可能抑制優勢卵泡發育,其可能與IGF-1/PI3K/Akt信號通路激活有關。
綜上所述,高脂飲食誘導的肥胖可促使SD大鼠卵泡發育相關激素水平紊亂進而促使卵泡發育停止,其可能與IGF-1/PI3K/Akt信號通路激活有關。肥胖女性生殖治療過程中抑制IGF-1水平可能有助于卵泡發育。但關于高脂飲食誘導的肥胖與卵泡發育其他信號通路及其可能作用機制均需進一步研究。
利益沖突:無

