納米刀消融聯合膽道支架治療不可切除肝門部膽管癌探討
陳艷軍 程冰冰 郜宇 陳升陽 周百中 李曉勇
鄭州大學第五附屬醫院肝膽胰外科(鄭州450052)
肝門部膽管癌占膽管惡性腫瘤的50%~60%[1]。由于解剖位置特殊,腫瘤極易侵犯二級甚至三級膽管,并累及周圍的門靜脈、肝動脈,因此根治性切除率低,有文獻報道肝門部膽管癌的根治性切除率僅有20% ~30%[2]。既往對于無法手術切除的肝門部膽管癌的治療大多以放化療或者姑息性內外引流為主,但療效欠佳。
納米刀是一種新型消融技術,它利用不可逆電穿孔原理在腫瘤細胞膜上形成難以計數的納米級小孔,繼而導致腫瘤細胞調亡[3]。目前國內外有關該技術的文獻大多聚焦于胰腺癌[4]、前列腺癌等實體腫瘤的治療,而在肝門部膽管癌治療中的應用鮮有報道,本研究回顧性分析了鄭州大學第五附屬醫院肝膽胰腺外科采用納米刀技術治療的26 例不可切除肝門部膽管癌患者的臨床資料,旨在為不可切除肝門部膽管癌患者的治療提供新的選擇。
1 資料與方法
1.1 納入與排除標準納入標準:(1)所有患者術前均行影像學檢查、血清腫瘤標志物檢驗,結合典型的臨床癥狀、體征等資料,以及術中探查確診為不可切除肝門部膽管癌;(2)肝功能分級在B 級以上;(3)無心、肺、腎等重要臟器功能異常;(4)患者依從性好,能夠堅持定期復查,并接受長期隨訪。排除標準:(1)一般情況差,伴有嚴重心肺腎等臟器功能障礙,無法耐受手術;(2)既往嚴重心肌梗死患者;(3)安裝心臟起搏器患者;(4)依從性差,不能接受定期復查和隨訪患者。
1.2 一般資料回顧性分析鄭州大學第五附屬醫院2016年1月至2018年6月收治的26 例不可切除肝門部膽管癌患者的臨床資料,見表1。
1.3 手術過程及分組納米刀消融治療采用美國Angio Dynamics 公司生產的Angiodynamics Nanoknife System 開腹實施。主要步驟:(1)右側肋緣下斜切口或上腹部反“L”型切口,常規切除膽囊并適當游離肝十二指腸韌帶,充分顯露肝門部結構;(2)術中超聲再次確定腫瘤侵犯范圍及Bismuth-Corlette 分型,精確測量腫瘤三個徑向(左右、上下、前后)參數,將數據輸入納米刀消融系統,設計布針方案;(3)5 mL 注射器各進針點試行穿刺并抽吸再次確定進針徑路上無血管,選用單極消融電極針主針1 根,輔針2~3 根精準布針,確保布針范圍覆蓋腫瘤區域,設置相鄰電極針間距為1.5~2.5 cm,暴露消融電極1.5~2.0 cm;(4)按預設的消融針間組合及消融頻次,采用直流(25A)高壓(2 500 ~3 000 V)電脈沖依次消融,每兩針間的消融由90 ~130 次電脈沖組成;(5)根據納米刀儀器顯示的消融前后電流變化趨勢判斷消融效果,若儀器顯示消融后電流較消融前無明顯上升,可適當調整脈沖次數后再次消融。消融完畢后觀察穿刺點有無出血或膽汁滲漏,必要時縫扎;(6)消融原則:先深后淺,針與針之間平行等深,自左至右或自右至左逐步推進;(7)確定無活動性出血后縱行切開膽總管,按手術方案放置T 管∕膽道支架或膽道復合支架(膽道支架+放射性粒子鏈)。根據手術中具體方案的不同,將26 例患者分為A 組(常規消融組)、B 組(消融+膽道支架)、C 組(消融+復合支架組)3 組。其中A 組11 例,納米刀消融術中未放置膽道支架,但其中4 例術中放置T 管;B 組11 例,納米刀消融術中放置單純膽道塑料支架;C組4 例,消融術中放置膽道復合支架(膽道塑料支架+放射性粒子鏈,其中放射性粒子鏈由術者自行制備),全部患者均未行膽腸吻合等內引流手術。術后適時經PTCD 管或T 管行膽道造影檢查了解膽道再通情況。
表1 26 例肝門部膽管癌患者的一般資料Tab.1 General data of 26 patients with hilar cholangiocarcinoma
1.4 統計學方法采用SPSS 17.0 軟件包對所得數據進行統計分析,計量資料以(x ± s)表示,對術前術后相關指標比較采用配對t檢驗,對術后各組生存率的比較采用K-M 法進行分析,以P<0.05 差異有統計學意義。
2 結果
2.1 膽道再通情況術后2 周左右經T 管或PTCD管造影,結果顯示:11 例患者術后2 周膽管再通,8 例術后1 個月膽管再通,3 例術后2 個月膽管再通,4 例始終未再通,膽管再通率84.6%(圖1、2)。

圖1 納米刀消融術后經T 管造影,肝內,外膽管依次顯影Fig.1 The intrahepatic and extrahepatic bile ducts were developed successively by t-tube angiography after the nano knife ablation
2.2 術后隨訪
2.2.1 拔管時間18 例術前行PTCD 治療患者,8例于術后2 周經PTCD 管造影檢查證實膽道再通后予以拔除,4 例于術后1 個月拔除,1 例術后1 個月意外脫落,2 例于術后2 個月拔除,其余3 例術后膽紅素下降不明顯,未予拔除。
2.2.2 術后生存情況A 組11 例患者術中未行膽道支架置入,1 例術后因再次黃疸行內鏡下逆行鼻膽管引流(endoscopic nasobiliary drainage,ENBD)治療,另有1 例兩次行內鏡下膽道支架置入均未成功,其余9 例患者術后未再做其他治療,此11 例患者術后總生存時間1.5 ~15 個月,平均(7.4 ± 1.2)個月。B 組11 例患者術中放置膽道支架,5 例術后再次出現黃疸時行內鏡下治療,其中1 例鏡下歷經困難取出術中支架并成功置入膽道金屬支架,4 例鏡下取出支架失敗,遂行ENBD 治療,其余6 例術后未再行其他治療,11 例患者術后總生存時間4 ~24 個月,平均(10.9 ± 1.7)個月。C 組4 例患者術中放置膽道復合支架,3 例術后再次出現黃疸時成功于內鏡下取出術中膽道復合支架并置入新支架(圖3),其中2 例為金屬支架,1 例未再行其他治療,4 例患者術后總生存時間8 ~23 個月,平均(13.3±3.0)個月。各組間患者總生存時間差異無統計學意義(P= 0.155),但生存時間各組之間變化的趨勢較為明顯(表2)。26 例患者總生存時間1.5 ~24 個月,平均(9.8±5.6)個月。

圖2 納米刀消融術后經PTCD 管造影,左、右肝管及膽總管依次顯影Fig.2 The left and right hepatic ducts and common bile duct were developed successively by PTCD angiography after the nano knife ablation
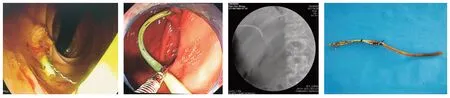
圖3 術后內鏡下取出并更換膽道支架Fig.3 Remove and replace the biliary stent under endoscope after surgery
表2 納米刀消融術后生存情況Tab.2 Survival after ablation with nano knife ±s

表2 納米刀消融術后生存情況Tab.2 Survival after ablation with nano knife ±s
組別A 組B 組C 組例數11 11 4生存期(月)7.4±1.2 10.9±1.7 13.3±3.0 P 值0.155
3 討論
肝門部膽管癌惡性程度高,由于解剖位置的特殊性,且其生長方式具有縱向浸潤及橫向侵犯的特點[5],多數患者就診時已失去根治性切除機會,預后較差。近年來,肝門部膽管癌的發病率呈上升趨勢[6]。目前的治療方法主要包括放化療以及膽道內外引流、膽道支架植入、導管內射頻消融等姑息性治療,其目的在于緩解梗阻,改善膽汁引流,由于未對腫瘤本身進行干預,故患者的遠期生存無明顯改善,多數患者生存期不足1年[7]。
納米刀消融技術是通過電極針將高壓、低能、直流電脈沖施加于一定范圍的腫瘤區域,從而在腫瘤細胞膜上產生無數的納米級小孔[8],即不可逆電穿孔(irreversible electroporation,IRE),導致細胞內液外流,繼而引起細胞穩態失衡最終導致腫瘤細胞死亡。基于其非致熱損傷作用機制,IRE只破壞腫瘤細胞膜,不損傷細胞外基質成分[4,9],因此血管、膽管等脈管結構仍可保持正常的連續性而免受損傷,故而尤其適用于緊鄰或浸潤血管、膽管等重要結構的惡性腫瘤[10]。本研究發現納米刀消融術后2 周左右經膽道造影證實膽管再通且連續性完好,表明納米刀消融對膽管腫瘤細胞發揮明確的毀損作用的同時,確可維持膽管結構的連續性。
本研究中,A 組患者術后再次出現黃疸,考慮腫瘤復發導致膽道再次梗阻,1 例患者行ENBD 治療,另有1 例兩次試行內鏡下膽道支架置入均未成功,表明對于肝門部膽管癌患者,內鏡下膽道支架置入操作并非易事。國外的研究[11]將內鏡下放置膽管支架的難易程度進行分級,分級越高則操作難度越大、放置支架的成功率越低且并發癥發生率高。而術中放置膽道支架由于是在開腹直視下實施,容易克服支架通過膽道狹窄處時遇到的阻力,操作相對容易,成功率高。本研究中B 組11 例患者均于術中成功放置膽道支架。
支架閉塞是膽道支架常見并發癥,當發生支架閉塞時,大多需要更換。塑料支架的遠端如果位于膽管下段內,當發生支架堵塞時,再次干預會非常困難[2]。本研究中,B 組患者術后因再次黃疸考慮支架閉塞時有5 例接受內鏡下支架更換,由于支架遠端在膽管內,未通過十二指腸乳頭進入腸腔,1 例歷經困難于鏡下取出膽道內支架,另有4 例未能成功取出,此種情況與國外的相關報道一致。文獻報道,腔內放療可延長支架通暢時間及生存時間[12]。本研究中,C 組患者術中放置膽道復合支架(膽道支架+放射性粒子鏈),粒子鏈由術者自行制備并與膽道支架牢固捆綁在一起,粒子鏈下端經十二指腸乳頭置入十二指腸腸腔內。后期發生膽道支架堵塞需更換新支架時,該支架一方面可使取出原支架的操作難度較前明顯降低,另一方面也為后續行內鏡逆行胰膽管造影(endoscopic retrograde cholangiopancreatography,ERCP)治療提供術中導向及置管“通道”,可大大提高ERCP下置管成功率。2 個半衰期后或患者再次出現黃疸時,行十二指腸鏡檢查通過鏡下牽拉粒子鏈尾端取出“膽道復合支架”并置入新支架,使納米刀消融的療效進一步得到延伸。鄭文恒等[13]的研究發現,單純行經皮肝膽道支架置入術的患者,其中位生存期為9.6 個月。本研究中,納米刀消融聯合膽道復合支架治療的患者,術后生存期平均為(13.3 ± 3.0)個月,最長可達23 個月,明顯優于文獻中單純行膽道支架植入術患者,亦優于常規納米刀消融組及膽道支架組患者,統計學分析未發現顯著性差異考慮與C 組患者樣本量過少、數據偏差較大有關。
在治療不可切除的肝門部膽管癌方面,納米刀消融可最大限度的毀損腫瘤細胞,同時保持膽道結構的連續性,無需膽管空腸吻合,不改變生理結構,損傷小。由于肝門部膽管癌具有“階段性侵犯”、“跳躍性轉移”的病理特點,因此難以達到根治的目的,完成R0 切除的病人術后復發幾率仍然較高[5];即使是對經過嚴格選擇的病人施行肝移植手術,其復發率也有20%[14]。因此,對于不可切除肝門部膽管癌的治療,更需要結合膽道支架、放射性粒子鏈、內鏡下更換支架等多種技術手段。
目前關于納米刀消融在肝門部膽管癌治療中應用的報道較少,本研究包含的樣本量亦較小,尤其是C 組患者僅有4 例,在療效尤其是術后生存率統計分析方面會有較大偏差。納米刀消融治療不可切除肝門部膽管癌尚面臨諸多問題,比如術前腫瘤浸潤深度的判斷、消融邊界的確定、術中消融效果的判斷、最佳消融參數的確定等等,其確切療效尚需進一步增加樣本量、總結經驗、改進技術并積極隨訪觀察。熒光顯影及三維重建技術近年來越來越多的應用于肝臟腫瘤手術中,如能將熒光顯影或反向顯影、三維重建技術應用于肝門部膽管癌納米刀消融治療中,用來確定腫瘤邊界及消融范圍,可大大提高腫瘤根治性毀損可能性,減少或延緩腫瘤的復發及進展,結合免疫治療等最新的腫瘤治療方式,有望使不可切除肝門部膽管癌的治療取得更為顯著的進展。

