綠色木霉B3菌株發酵液殺線活性分析及其穩定性測定
李 通,毛維興,薛應鈺,張樹武,徐秉良
(甘肅農業大學 植物保護學院,甘肅省農作物病蟲害生物防治工程實驗室,蘭州 730070)
小麥禾谷孢囊線蟲(Heteroderaavenae) 屬于植物寄生線蟲,自1908年在英國首次發現以來,近年已在32個國家發生并引發危害[1],如在澳大利亞小麥受害面積達2×106hm2,導致減產23%~50%,嚴重時可達73%~89%,每年造成經濟損失高達7000萬美元[2]。自1989年在中國湖北天門山首次發現小麥禾谷孢囊線蟲以來,現已發現該線蟲廣泛分布于河北、河南、北京、湖北、甘肅、青海和安徽等省(市),危害面積超過百萬公頃,已成為小麥生產的一個新問題[3-5]。目前,關于植物寄生蟲的防治主要采用化學藥劑和種植抗病品種,雖然化學藥劑殺線活性高,但對環境污染嚴重、毒性大、殘留高且很難降解,進而嚴重影響人畜健康和有益生物的安全[6]。同時,大多數抗病品種作物在同一區域連作以后,抗性也會逐漸減弱[7]。因此,微生物防治植物病原線蟲已成為目前研究的新趨勢和新方向[8]。
木霉屬真菌(Trichodermaspp.) 作為土壤微生物的主要組成群落之一[9-10],也是海洋中普遍存在的一類真菌[11-12]。中國物產豐富,地理環境和氣候差異多樣,木霉菌種類繁多,目前國內已報道的有25種[13-14]。木霉菌具有較強廣譜性、廣泛適應性和多種拮抗機制等特點,已被作為一類重要的生防菌應用于植物病害的生物防治,但相關報道表明其在田間防治中受到多種環境因素的影響(如溫度、濕度、土壤質地、結構和線蟲數量等)。筆者從前期分離保存的120株木霉菌中篩選獲得一株生長速率快、產孢量和殺線活性強的綠色木霉B3菌株,但目前國內外有關綠色木霉B3菌株對禾谷孢囊線蟲毒殺活性及穩定性方面尚未報道和研究。因此,本試驗通過綠色木霉B3菌株發酵液對禾谷孢囊線蟲2齡幼蟲毒殺活性及其穩定性的測定,以便為植物寄生線蟲生防制劑的開發和利用提供借鑒。
1 材料與方法
1.1 材 料
1.1.1 供試菌株 綠色木霉(T.viride) B3菌株。由甘肅農業大學植物保護學院植物病原學實驗室分離保存。
1.1.2 供試線蟲 禾谷孢囊線蟲(H.avenae) 2齡幼蟲,由甘肅農業大學植物保護學院植物病原學實驗室分離保存。
1.2 試驗方法
1.2.1 綠色木霉B3菌株孢子懸浮液與發酵液制備 向在PDA平板上活化培養6 d的綠色木霉中加入1滴吐溫-80(Tween-80) 和5 mL無菌水充分振蕩,并使其分生孢子脫落在無菌水中,即得到分生孢子懸浮液的原液,并用血球計數板計數原液的濃度使其為1.0×107個/mL,備用。然后,將PDB液體培養基分裝于150 mL三角瓶中,每個三角瓶分裝60 mL培養基,并分別加入 1 mL分生孢子懸浮液,以加入1 mL無菌水和1滴Tween-80作為對照,每個處理和對照重復3次,并置于25 ℃、轉速為180 r/min和16 h/8 h光照的控溫振蕩器中連續培養7 d。7 d后,將其通過雙層濾膜過濾即得到發酵液的原液,并保存于 4 ℃冰箱,備用。
1.2.2 綠色木霉B3菌株殺線活性及其穩定性測定 微波處理穩定性測定:將綠色木霉B3菌株發酵液10 mL置于150 mL三角瓶內,并置于微波爐中(功率800 W)分別處理 10、30、60、120和300 s,待自然冷卻后進行殺線活性測定。殺線活性測定參照張樹武等[15]方法。將分離的禾谷孢囊線蟲2齡幼蟲配制成懸浮液,濃度為3~4條/10 μL,保存在50 mL離心管中,備用。然后,利用96孔細胞培養板進行殺線活性測定,每孔取10 μL線蟲懸浮液,然后加入90 μL不同條件下處理的發酵液,每個處理組和對照組25 ℃處理線蟲24、48和72 h時,分別觀察并記錄線蟲的死亡率。試驗過程中每個處理和對照均重復6次。殺線活性測定方法下同。
線蟲死亡率=(死亡線蟲數/供試總線蟲 數)×100%
光照穩定性測定:將綠色木霉B3菌株發酵液20 mL加入不加皿蓋的培養皿(d=9 cm) 中,置于照度為4 000 lx可見光的培養箱中分別照射0 h、6 h、18 h、24 h、36 h、48 h、72 h、96 h和120 h后進行殺線活性測定。試驗過程中每個處理和對照均重復6次。
金屬離子穩定性測定:利用經滅菌處理的ddH2O分別配制濃度為0.1 mol/L的K+、Cu2+、Mg2+、Fe3+、Na+、Fe2+和Zn2+的離子溶液,與無菌發酵液按1∶9體積比混合,4 ℃下放置24 h后進行殺線活性測定。試驗過程中以未處理的發酵液作為對照,且每個處理和對照均重復6次。
耐儲藏性測定:將綠色木霉B3菌株發酵液各50 mL裝入無菌的密封三角瓶中,于4 ℃和室溫下分別儲藏10~60 d后進行殺線活性測定。試驗過程中以未處理的發酵液作為對照,每個處理和對照均重復6次。
酸堿穩定性測定:將綠色木霉B3菌株發酵液各25 mL于三角瓶(規格50 mL) 中,經1 mol/L 鹽酸和1 mol/L氫氧化鈉分別調整pH至2~12,并于4 ℃冰箱靜置24 h后將各處理pH調回發酵液原始pH進行殺線活性測定。試驗以未經1 mol/L 鹽酸和1 mol/L氫氧化鈉處理的綠色木霉B3菌株發酵液作為對照,每個處理和對照均重復6次。
氧化還原穩定性:利用經滅菌的ddH2O分別配制不同濃度的雙氧水與亞硫酸鈉。將氧化劑雙氧水配制為0.1、0.3、0.5、0.7、0.9和1.1 mol/L 6個濃度梯度,還原劑亞硫酸鈉配制為 0.1、0.3、0.5、0.7、0.9和1.1 mol/L 6個濃度梯度。然后,將各處理濃度的氧化還原劑與發酵液按1∶9體積比混合,4 ℃下放置24 h后進行殺線活性測定。試驗過程中以未處理的發酵液作為對照,且每個處理和對照均重復6次。
1.2.3 數據分析 試驗數據利用Microsoft Excel 2007整理,采用 SPSS 16.0統計分析軟件對數據進行方差分析并做差異顯著性檢驗(Duncan氏新復極差法)。
2 結果與分析
2.1 微波處理對綠色木霉B3菌株殺線活性及其穩定性影響
隨著綠色木霉B3菌株發酵液處理線蟲時間的增加,其發酵液對禾谷孢囊線蟲2齡幼蟲的毒殺活性隨著處理時間的增加而增強,尤其處理 72 h時,2齡幼蟲死亡率最高為86.82%。同時,綠色木霉B3菌株發酵液經微波處理后,其殺線活性與未處理對照菌株發酵液相比整體無顯著差異。處理禾谷孢囊線蟲24 h后,經微波處理的發酵液其殺線活性顯著高于未處理菌株發酵液,尤其微波處理時間為2.0 min時,其殺線活性最高;處理線蟲48和72 h后,經微波處理發酵液與未處理菌株發酵液殺線活性無顯著差異(圖1)。

不同字母表示差異顯著(P<0.05),下同 Different letters mean significantly differences(P<0.05),The same below.
2.2 光照穩定性
研究結果表明,綠色木霉B3發酵液經不同時間段光照處理后,對禾谷孢囊線蟲2齡幼蟲的毒殺活性與對照相比無顯著差異。處理線蟲 72 h時,當光照處理時間為6~56 h時,2齡幼蟲死亡率均大于80%,尤其發酵液光照處理48 h時,其殺線活性顯著高于未處理菌株發酵液,但是隨著處理時間的增加,當發酵液光照處理時間為56~96 h時,其殺線活性為71.4%~76.91%,與未處理發酵液無顯著差異;當發酵液光照處理時間為120 h時,其殺線活性顯著降低(圖2)。
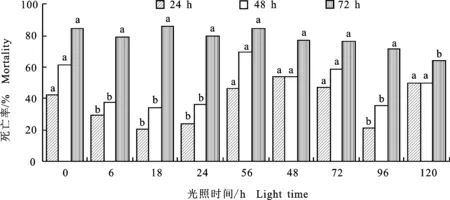
圖2 光照處理后綠色木霉B3菌株殺線活性及其穩定性Fig.2 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain after light treatment
2.3 金屬離子穩定性
綠色木霉B3發酵液經不同金屬離子處理后,再處理線蟲24 h,Ca2+處理的發酵液殺線活性顯著高于未處理發酵液;處理線蟲48 h后發現Zn2+和Fe3+對線蟲的毒殺作用略高于未處理的發酵液;處理線蟲72 h后發現K+和Mg2+對發酵液的殺線效果影響較大,與對照相比線蟲死亡率分別降低29%和10%,但是Zn2+和Fe3+對菌株發酵液殺線活性無顯著影響,表明其穩定性較好(圖3)。
2.4 儲藏穩定性
綠色木霉B3菌株發酵液在25 ℃下儲藏0~40 d后,與對照相比,其發酵液在處理線蟲24和48 h后殺線活性無顯著變化,但在儲藏50和 60 d后,處理線蟲24和48 h其殺線活性顯著降低。然而,其發酵液在儲藏0~60 d后,發酵液處理線蟲72 h時,其殺線活性與對照相比均無顯著差異(圖4)。
2.5 酸堿穩定性
結果表明,不同pH對綠色木霉B3菌株發酵液殺線活性具有不同程度的影響,尤其在pH=2和pH=12條件下,其發酵液處理線蟲24 h后,殺線活性與對照(pH 7.6)相比差異顯著,但是在pH為 4~10條件下,其發酵液處理線蟲72 h后,殺線活性與對照相比無顯著差異。當pH為12時,殺線活性略低于對照(pH 7.6),但差異較少(圖5)。
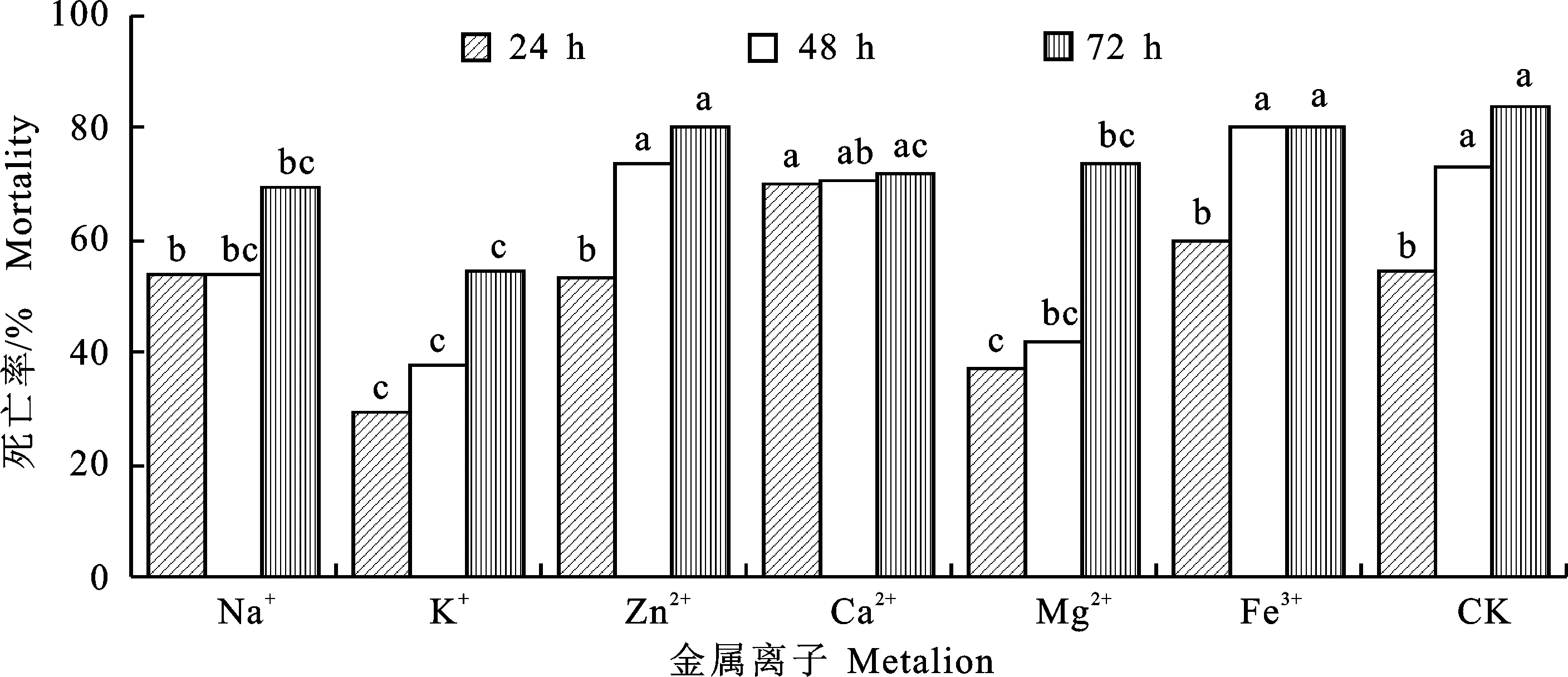
圖3 金屬離子處理后綠色木霉B3菌株殺線活性及其穩定性Fig.3 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain after metal ion treatment
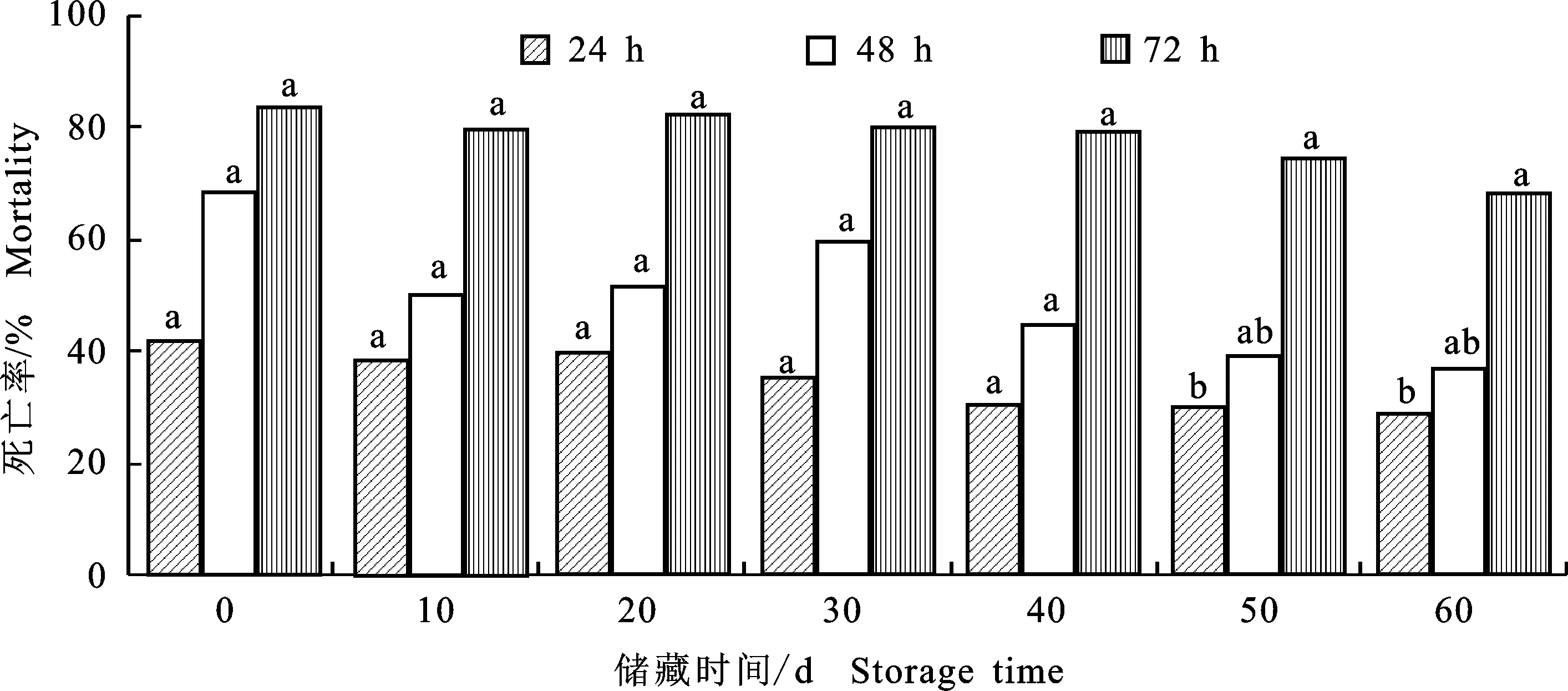
圖4 貯藏一定時間后綠色木霉B3菌株殺線活性及其穩定性Fig.4 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain for a certain period of time

圖5 不同pH綠色木霉B3菌株殺線活性及其穩定性Fig.5 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain with different pH
2.6 氧化還原穩定性
研究結果表明,不同濃度氧化劑H2O2對綠色木霉B3菌株發酵液殺線活性具有不同程度的影響,當綠色木霉B3菌株發酵液經0.9 mol/L H2O2處理后,其殺線活性顯著降低,尤其處理線蟲 72 h,線蟲的死亡率為66.7%,與對照相比降低16.3%。然而當雙氧水為0.3 mol/L時,處理線蟲 72 h,線蟲死亡率高達90%,與未處理的發酵液相比線蟲死亡率增加7%,顯著提高B3菌株的殺線活性(圖6)。
不同濃度還原劑Na2SO3對綠色木霉B3菌株發酵液殺線活性具有不同程度的影響,當還原劑Na2SO3濃度為1.1 mol/L時,處理線蟲72 h,殺線活性顯著降低。然而,當還原劑濃度為 0.9~0.1 mol/L時,殺線活性與未處理相比無顯著變化(圖7)。
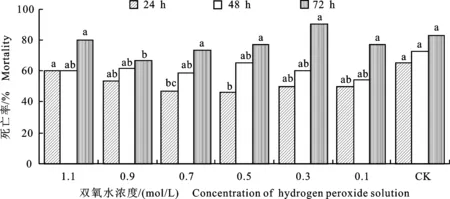
圖6 氧化劑(雙氧水)處理后綠色木霉B3殺線活性及其穩定性Fig.6 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain treated with oxidant(hydrogen peroxide)
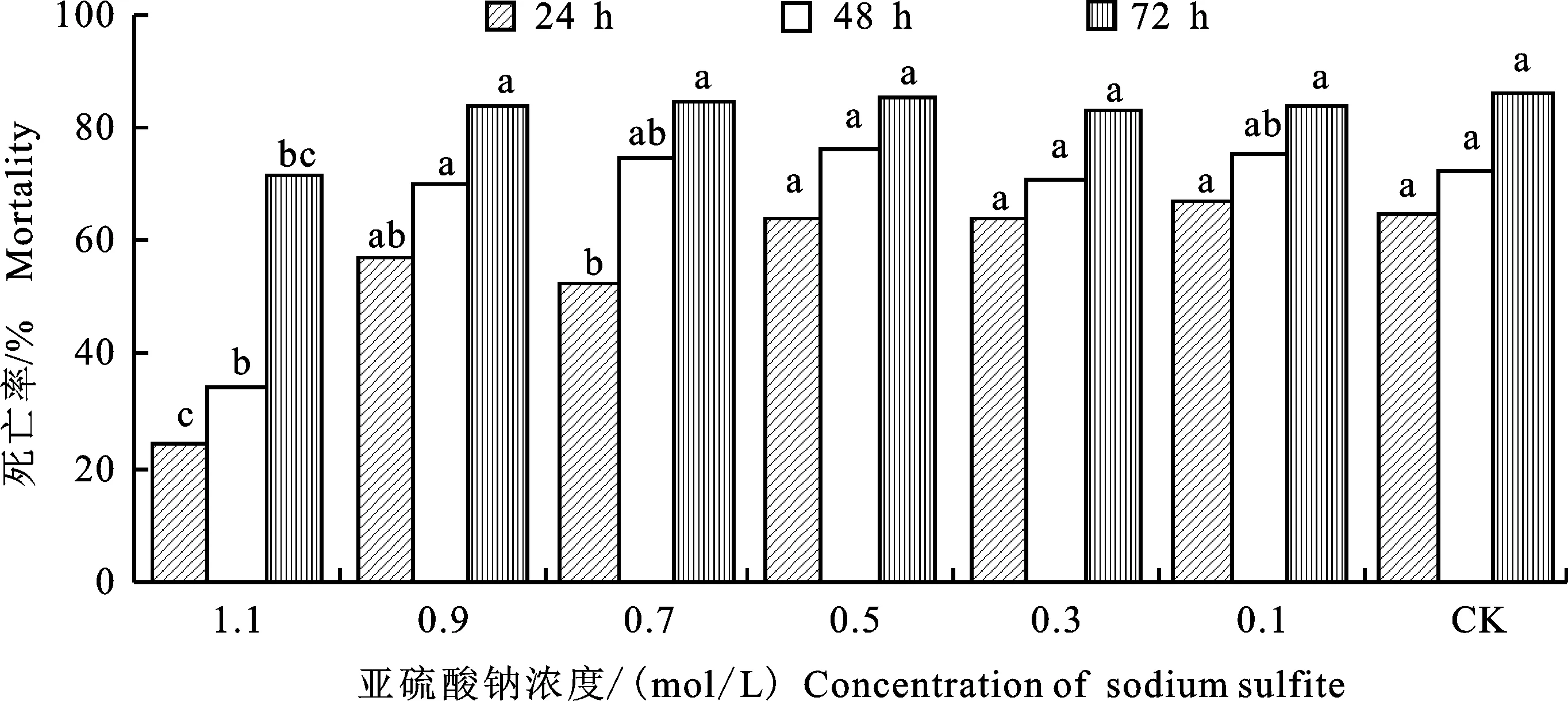
圖7 還原劑(亞硫酸鈉)處理后綠色木霉B3殺線活性及其穩定性Fig.7 Nematicidal activity and stability in vitro of Trichoderma viride B3 strain treated with reducing agent(sodium sulfite)
3 結論與討論
綠色木霉(T.viride) 是自然界中廣泛分布的一種土傳植物病害拮抗生防菌,其在植物病害生物防治中具有重要意義。劉萬斌[16]研究表明,綠色木霉HS-4對引起向日葵枯萎病的鐮刀菌(Fusariumspp.) 具有良好的抑制作用,其抑菌率為81.46%;安霞[17]研究發現,綠色木霉TV41對辣椒疫病的盆栽防治效果可達82.33%;Gajera等[18]發現,綠色木霉JAU60可以將黑曲霉(Aspergillusniger) 引起的落花生環腐病發生率降低51%~58%;Al-Hazmi等[19]研究發現,綠色木霉和哈茨木霉(T.harzianum)對番茄爪哇根結線蟲(Meloidogynejavanica) 的繁殖和根結的增長有良好的抑制作用,且能夠促進番茄幼苗的生長,但是目前國內外有關綠色木霉對植物病原線蟲的毒殺作用報道較少。
本試驗通過測定微波、光照、金屬離子、儲藏時間、酸堿、氧化和還原劑等因素對綠色木霉B3菌株殺線活性及其穩定性的影響,表明綠色木霉B3對禾谷胞囊線蟲具有較強的毒殺活性,且微波、光照、金屬離子和儲存時間對其殺線活性無顯著影響,能夠保持良好的穩定性。另外,本試驗發現高酸性和高堿條件對綠色木霉B3菌株發酵液殺線活性具有顯著影響,可能是發酵液中的殺線活性物質在高酸和高堿的條件下發生反應,進而導致其對線蟲的毒殺作用降低。同時,不同濃度的氧化和還原劑不僅對綠色木霉B3菌株發酵液殺線的穩定性無顯著影響,而且能夠提高綠色木霉菌株B3發酵液的殺線活性。褚福紅等[20]測定綠色木霉代謝物對芒果炭疽菌(Colletotrichumgloeosporioides)抑菌率的穩定性,抑菌率達到74.18%,對熱、光、微波較為穩定,在pH 6~7時亦較為穩定,與本試驗發現綠色木霉B3菌株發酵液在pH 2~10時殺線活性均穩定的結論有所不同。張雯龍等[21]發現鏈霉菌(Streptomycetaceae) S417發酵液對玉米大斑病菌(Helminthosporiumturcicum) 和香蕉炭疽病菌(Gloeosporiummusarum) 等5種病原菌的抑菌率為82.5%~69.6%,在堿性條件下發酵液的穩定性降低,Cu2+、Fe3+對代謝產物的影響較大,而本試驗中綠色木霉菌株B3在pH 2~12條件下均穩定,且防腐劑、氧化劑、還原劑對其影響不顯著。本試驗表明Zn2+和Fe3+對綠色木霉菌株B3具有良好的穩定性,這可能與不同菌株的生物學特性和微生物的種類等有關。張建華等[22]發現,高溫、酸堿、自然光和紫外光處理對長枝木霉T6菌株發酵液抑菌活性無顯著影響,在4 ℃和常溫下儲存60 d其抑菌活性保持不變。這與本研究結果相符合。伊洪偉[23]研究表明,酸堿條件對長枝木霉發酵液抑菌活性影響較大,這與本試驗的結果亦相符合。
本研究表明,自然光和微波處理對綠色木霉菌株B3發酵液殺線活性無顯著影響,該發酵液抗氧化性、還原性和耐強酸強堿性較強,耐貯藏性也較好。然而有關綠色木霉菌株B3發酵液殺線代謝產物的種類和結構尚待進一步研究。

