環境中鋁來源、鋁毒機制及影響因子研究進展
藺慶偉,馬劍敏*,彭雪,孫健,劉碧云,吳振斌
1. 河南師范大學生命科學學院,河南 新鄉 453007;2. 中國科學院水生生物研究所,湖北 武漢 430070;3. 中國市政工程中南設計研究總院有限公司,湖北 武漢 430010
鋁(Al)是地殼中含量最豐富的金屬元素(Zheng et al.,2005)。過去數十年,全球每年約4.38×109t原鋁被用于人類社會活動(如航空、建筑、電業、工業生產、生活用具和農業等)(唐遠景,1994;王冰,2014;Zhu et al.,2016)。隨著生產力和經濟水平的提高,鋁用量每年持續增長(Zhang et al.,2016)。正常情況下或較低濃度下(<0.2 mg·L-1)鋁對生物是無毒的。目前世界上約40%的耕地為酸性,而且酸雨出現的頻度和范圍逐漸擴大,鋁在酸性條件下(pH 6.0-6.5)更易以離子態溶出,嚴重危害植物的產量和品質(Stodart et al.,2007;Chen et al.,2018),影響生物多樣性。隨著食物鏈的轉移和富集,鋁對動物乃至人體也產生損害,因而受到廣泛關注(Stodart et al.,2007)。
傳統鋁鹽絮凝劑(明礬 KAl(SO4)2·12H2O,硫酸鋁Al2(SO4)3·18H2O)在給水和污水處理中具有良好效果,近年來傳統和新型絮凝劑(聚合氯化鋁PAC)在湖泊富營養化治理、除磷控藻方面也得到越來越廣泛應用(Lin et al.,2017a;Rott et al.,2017)。處理后的尾水以及酸雨淋溶攜帶大量的鋁鹽進入河流、湖泊等自然水生態系統,長久富集的鋁鹽會對水生植物、魚類、浮游生物等產生毒害(Jiri et al.,2005;Kochian et al.,2015)。前人的研究關注酸性環境中鋁的毒性,且主要集中于對陸生植物的毒害作用,而對水生生物的鋁毒方面研究較少,且注重室內模擬研究,關于大范圍、大流域、野外原位鋁毒的研究鮮有報道。本文綜述了有關陸地及水生生態系統中鋁的來源及存在形式,鋁毒對藻類、魚類、植物和人體的影響以及影響鋁毒因子的研究進展,以期為鋁的科學應用及生態系統中的鋁毒風險評估提供一定的參考。
1 生態系統中鋁鹽的來源及存在形式
1.1 陸地生態系統中鋁來源及存在形式
自然條件下,鋁在地殼中主要以化合態的形式存在于各種巖石或礦石里(約占地殼總量的7.8%),如鋁硅酸鹽正長石K(AlSi3O8),鈉長石Na(AlSi3O8),鈣長石 Ca(Al2Si2O8),白榴石 K(AlSi2O6),霞石Na(AlSiO4),硅線石 Al2SiO5和高嶺石Al2O3·2SiO2·2H2O 。 鋁 土 礦 AlO(OH)和 冰 晶 石Na3AlF6是重要的鋁礦來源。純的氧化鋁以金剛砂的形式存在,當被低含量的其他金屬氧化物染色時,它會形成紅寶石或藍寶石(Namiesnik et al.,2010)。由鋁的氧化物與冰晶石共熔電解可制得鋁(高蘭等,2015)。
經過多年的研發,人類掌握了鋁的諸多特性和用途。由于鋁在空氣中具有良好的穩定性、以及出色的導電導熱性、延展性和抗腐蝕性等特點,它被廣泛應用于制作生活器具、電纜材料、熱交換器、器械裝置等諸多方面(李青等,2016;王冰,2014;許國棟等,2012),且質量輕強度高的特點賦予鋁合金在國防軍工、航空、交通等領域具有特殊用途(唐遠景,1994)。不同形態的鋁鹽憑借其化學特性在醫藥、農業、造紙、凈水、殺菌消毒等方面發揮各種各樣的作用,如Al(OH)3凝膠液具有中和胃酸和治療潰瘍的作用;磷化鋁用于谷倉殺蟲的熏蒸劑(Zheng et al.,2005);硫酸鋁常用作造紙的填料、媒染劑,并用于制造沉淀色料、防火布和藥物;明礬是一種重要的凈水劑、染媒劑(李青等,2016)。硝酸鋁可用來制白熱電燈絲,硅酸鋁常用作顏料以及油漆、橡膠和塑料的填料等,鋁的羧酸鹽也常被用作防水劑、殺菌劑、消毒劑和耐熱穩定劑等(賀婷婷,2013)。
鋁在人類社會生活中的廣泛應用也正是生態系統中鋁的豐富來源。目前,除鋁制炊具和自然攝入(飲用水、空氣、藥物)外,食品本底及含鋁食品添加劑(硫酸鋁鉀、硫酸銨鋁和部分鋁色淀)成為人們日常生活中鋁的主要來源。當人體通過各種途徑攝入過多的鋁元素(Al 2 mg·kg-1人體質量)時,我們的神經、骨骼、肝臟和生殖系統等都會受到不同程度的損傷和致毒。此外,近 50年來,鋁已成為世界上應用最為廣泛的金屬之一(高蘭等,2015),隨之帶來的是鋁工廠、化工工業排放大量含鋁的廢水,對環境造成嚴重的污染,鋁生產工廠排放的污水中含鋁可達300-1000 mg·L-1,氧化鋁生產工廠排放污水中含鋁可達10-70 mg·L-1(周立志,2016)。作為金屬,鋁可以回收再造,但是回收率不高,往往以鋁單體、氧化鋁或合金形式流散到周圍環境中,再經氧化、酸化、溶解等反應進入土壤、水體等生態系統。
中國鋁土礦儲量占世界總儲量的2.8%,居世界第7位。中國目前是世界上鋁型材生產大國,截至2007年,中國在產的鋁擠壓廠數量、生產能力、產量均居世界第一(許國棟等,2012;王冰,2014)。經過近幾年產品結構的調整和市場調節,鋁加工廠數減少,分布逐步分散;產品出口增加,成為世界上最主要的鋁型材生產和凈出口國家。中國鋁加工材快報產量和型材逐年增高(高蘭等,2015),但是鋁工業廢渣赤泥附液中鋁含量高達3501 mg·L-1,這些廢渣如果得不到科學的處置,經過漫長的遷移轉化進入土壤,會對陸地生態系統產生嚴重污染(Zhu et al.,2016;周立志,2016)。
1.2 水生態系統中鋁來源及存在形式
自然條件下,河流、湖泊中的鋁來源于巖石、土壤風化產物在天然水體中的溶解,其含量和形態取決于流域巖石土壤類型、氣候特點、風化類型、植被因素等條件(石慧,2016)。雖然天然水體中鋁的含量很低,但是隨著世界經濟的快速發展,酸雨出現的頻度和范圍不斷擴大,酸雨或其他酸性廢水反復沖刷、浸漬著地表中的鋁土及其伴生礦,加上土壤酸化使其中的鋁被活化成為溶解態,令鋁大量溶出,使陸地環境中的鋁越來越多地進入水體;另一方面,酸雨或大氣中酸度增加,腐蝕各種鋁制品,使其快速溶解進入環境,增加環境中的鋁負荷;再者,由于湖濱帶和江濱帶的快速發展,一些酸性土壤被擾動,采礦、冶煉、化工制藥等工業產生的大量含鋁廢水、廢渣進入水體生態系統(楊忠蓮,2013)。
而且,鋁鹽(Al2(SO4)3、AlCl3、KAl(SO4)2·12H2O、聚合氯化鋁和聚合硅酸鋁類等)廣泛用作水的混凝劑、“鎖磷劑”、殺藻劑,在湖泊富營養化控制(Cooke et al.,2005;王艷等,2010;Nogaro et al.,2013)、除磷抑磷(Robertson et al.,2000;Lin et al.,2017a;朱廣偉等,2017)和污/廢水處理(Sharp et al.,2006;Agarwal et al.,2016)、引水工程預處理(Verma et al.,2012;Jin et al.,2015;張玥等,2017)、殺藻控藻(Wen et al.,2018)等方面的應用也越來越廣泛,但這些可溶性鋁化物在凈化水的過程中,同時也給處理過的水留下了不同程度的殘留鋁。所以越來越多的鋁包括雨水徑流含鋁,進入到自然水生態系統中(Wang et al.,2010)(見圖1)。地表水正常鋁濃度在60-300 μg·L-1之間,河流水中平均鋁含量為64 μg·L-1,但是隨著外來鋁的匯入,日積月累富集帶來一定的生態風險,不僅污染環境、危害生態,而且毒害人類健康(賀婷婷,2013)。
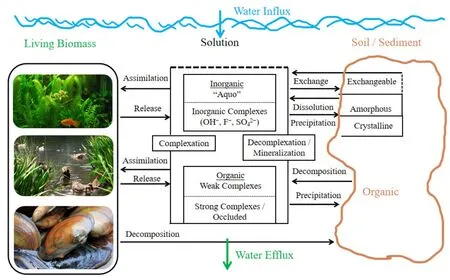
圖1 水生態系統中鋁循環示意圖(Driscoll et al.,1996)Fig. 1 A schematic representation of the Al cycle in aquatic system (Driscoll et al., 1996)
之前的研究(王振華,2012)表明,中國主要河流長江、珠江、湘江、鴨綠江等水中的溶解鋁含量為1.7-52.9 μg·L-1,而白洋淀濕地湖泊的可溶性鋁含量較高,為261-429 μg·L-1。云貴高原沉積物鋁含量高于東部地區,富營養化程度越高,沉積物中磷、鋁含量越高。美國東部阿迪朗達克地區 203個湖泊的平均pH值為6.3,總鋁含量為137.7 μg·L-1,單體鋁含量為 43.2 μg·L-1(Robert et al.,1999)。在明礬處理過的地表水中,鋁的濃度可達2.57 mg·L-1。在美國,地下水和地表水中鋁濃度分別為140-290 μg·L-1和 16-1170 μg·L-1(Wang et al.,2010)。國外報道(Driscoll et al.,1996)佛羅里達州的168個湖泊總鋁平均含量達89.1 μg·L-1,其中12%為酸性,pH 6.3。
當進入水體中,鋁鹽快速溶解,形成鋁離子,隨后通過幾步反應發生水解作用(Al3++3H2O=Al(OH)3+3H+),形成一種不溶解的膠狀晶體(Al(OH)3)絮狀物(Ebeling et al.,2006)。硫酸鋁鹽可以與水體磷反應生成 AlPO4;隨之AlPO4吸附到 Al(OH)3絮狀物上沉淀到底部,然后經處理而被去除(Rott et al.,2017)。在湖泊中,Al(OH)3絮狀物沉積底質上覆蓋一層,抑制底質中磷向水體的釋放。在水處理過程中,沉淀、氣浮等許多工藝都要投加混凝劑,這樣雖然去除了某些雜質,但是水中的鋁濃度很高,一般即使經過沉淀大約仍有11%的鋁殘留于水中(劉言正等,2012)。
鋁作為一種兩性元素,在強酸性(pH<4)環境中,水合陽離子主要以[Al(H2O)6]3+存在,但在堿性條件下主要以[Al(OH4)(H2O)2]2-形式存在(Clarke et al.,1996)。pH 4.5-5.5 時,[Al(H2O)6]3+離子會與水體中的有機或無機污染物的配體結合形成混合絡合物。pH 6.0左右條件下,Al(OH)3略有可溶性。pH 6.2-7.0時,鋁形成一系列的中間產物,如[Al(OH)2(H2O)4]+和[Al(OH)(H2O)5]2+,但是堿性環境中,生成[Al(OH)4(H2O)2]-和[Al(OH)5(H2O)]2-(Namiesnik et al.,2010)。相當一部分鋁還會與氨基酸、胺類、糖類和有機酸,及聚合大分子化合物腐殖酸(HA)、富里酸,以及含氟、氮、硫的化合物相結合。因此,自然水體中的鋁通常以氫氧化物、硫酸鹽、氟化物、氟鋁酸鹽混合物以及水解產生的許多大分子水合復合物形式存在,如[Al2(OH)2]4+,[Al3(OH)4]5+,[Al6(OH)15]3+,[Al8(OH)20]4+,[Al(OH)2(H2O)4]+,[Al(OH)(H2O)5]2+和[Al13O4(OH)24]7+,它們之間相互平衡(Burgess,1992)。
污水成分日趨復雜,隨著人類對生態環境要求的不斷提高,傳統鋁鹽絮凝劑已不能滿足使用要求,開發采用新型、高效環保、低殘留的天然高分子絮凝劑勢在必行(張亞文等,2009;Almubaddall et al.,2009;Harrelkas et al.,2009)。微生物和復合絮凝劑在今后的廢水處理中將具有廣大前景(Ahmad et al.,2008;Liu et al.,2017;Peng et al.,2017)。
2 鋁鹽的毒性效應及作用機制
鋁在低濃度下(<0.2 mg·L-1)是無毒的,但是隨著鋁的應用、富集越來越多,環境逐漸酸化,其毒性也被關注。況且越來越多的鋁進入水生態系統,由于生物富集和放大效應可能會帶來生態系統風險,而且對動物和人體健康產生一定的劑量毒性效應(孔繁翔等,2000;Jiri et al.,2005)。美國關于鋁的急性毒性國家環境水質標準為 Al 750 μg·L-1,旨在保護所有的水生物種(除5%短時間接觸鋁的水生物種)(United States Environmental Protection Agency,1988)。限制鋁濃度的慢性毒性值為Al 87 μg·L-1,旨在防止鋁長期暴露時的毒害(United States Environmental Protection Agency,1985)。同時,一些學者也建議,明礬劑量應使溶解鋁濃度保持在 50 μg·L-1以下(Robert et al.,1999)。可以說鋁污染是一個伴隨著人類工業文明的進展而逐步受到關注的問題。
目前關于鋁鹽對淡水藻類、水生無脊椎動物、魚類毒害研究較多,但局限在實驗室模擬研究(Michelena et al.,2016),關于植物鋁毒的研究主要集中在陸生植物上,尤其是農作物,而對沉水植物的影響研究鮮有報道。
2.1 對藻類的毒性效應
水生生物因其所處環境特殊,鋁毒的程度完全依賴于地表水體中活性鋁的濃度。對淡水藻類的研究(Gensemer et al.,1999;Golding et al.,2015)表明,鋁作用會引起浮游藻類和底棲藻類群落結構組成顯著變化,鼓藻(Cosmarium)和硅藻(Bacillariophyta)對鋁敏感,而金藻(Chrysophyta)和一些綠藻(Chlorophyta)對鋁相對耐受。關于浮游植物對南海鋁富集的響應研究表明,單獨添加鋁能促進硅藻和束毛藻屬(Trichodesmium)的生長和固氮作用,但抑制腰鞭毛蟲(Dinoflagellates)和聚球菌屬(Synechococcus)的生長。然而,單獨添加鋁對整個浮游植物群落的葉綠素 a濃度沒有影響(Zhou et al.,2018)。浮游植物對鋁富集的反應機制可能與環境中共存的營養物質有關,特別是有限的營養物質,主要原因為鋁可能通過抑制酸性磷酸酶活性而降低藻類對磷的吸收速率,也可能通過Al-P結合物將P元素沉淀至沉積物中而降低磷營養可利用性(Gensemer,1991)。此外,鋁也影響硅藻對SiO2的吸收和利用。
在近中性湖泊中明礬處理控制藻化可以致使磷供應和藻類生長長期降低,尤其是在具有良好分層的堿性湖泊中。而鋁在偏酸條件下(pH 6.0左右)對藻類毒性最強,盡管聚合鋁形態在pH 6.0時可能也具有一定的毒性,Al3+或無機單體鋁是對藻類毒性最大的鋁形態,Ca2+和H+可能通過在藻類體表競爭陽離子結合位點削減其受鋁毒(Gensemer et al.,1995)。在pH 6時,水體硬度增加可以減弱鋁毒對月牙藻(Pseudokir-chneriella subcapitata)的毒性強度,而pH 8時,硬度增加可能增強月牙藻對鋁的敏感性(Robert et al.,2018)。此外,Al2(SO4)3絮凝劑可以均勻地單層分布吸附在小球藻表面,吸附絮凝劑后,微藻對 Al2(SO4)3的靜電排斥作用降低,絮凝收獲微藻的效率達到60%-80%(Wen et al.,2018)。
2.2 對魚類的毒性效應
鋁對成魚是一種鰓毒性物質,可引起離子調節和呼吸紊亂。鋁的離子調節作用在低pH值時占優勢,通常被認為與H+單獨的毒性機制相同。而鋁對魚類呼吸作用的影響在中酸性水中占主導,其影響機制是鋁的沉淀或聚合,因為酸性、富鋁的水經過魚鰓會積累到最基本的鰓微環境。魚可以適應鋁,但需要消耗代謝能力(Robert et al.,1999)。
有學者(Sutela et al.,2017)發現,在芬蘭的沃林喬基,最低平均pH值為4.55時,最高平均鋁濃度為7.4 mg·L-1,幾乎沒有魚,在pH值<5的河流中,59%的監測位點未檢測到魚的出現。室內研究中,羅非魚(Oreochromis mossambicus)暴露在亞致死濃度(120、150和 180 mg·L-1)Al2O3納米粒子下96 h,對照組魚器官未見組織學異常,而處理組魚的腦、鰓、腸、腎和肌肉組織有嚴重損傷和廣泛的結構丟失,尤其在 180 mg·L-1時效果明顯(Murali et al.,2018)。此外,鋁對魚肝臟酶活性也產生影響,在不同pH(7,5)和不同濃度鋁(0,0.8 μg·L-1)混合溶液中培養鯉魚(Cyprinus carpio)幼魚 1、3、9 d,發現暴露 3、9 d后,鯉魚肝臟Na+/K+-ATP酶和Ca2+-ATP酶活性明顯下降,而且血液學指標失調,紅細胞增加,白細胞減少(Sun et al.,2018)。Miri et al.(2017)研究也表明鋁的出現干擾鯉魚魚鰓、肝臟和肌肉中天冬氨酸轉氨酶、丙氨酸轉氨酶和堿性磷酸酶的轉氨作用和代謝過程。Ramirez-Duarte et al.(2017)在軟水中pH5.3的條件下,將日本青鳉(Oryzias latipes)仔魚暴露于不同濃度的溶解鋁4 d,6.2和16.7 pg·L-1鋁使全機體組織勻漿中谷胱甘肽過氧化物酶活性顯著降低,16.7 pg·L-1鋁使谷胱甘肽還原酶活性顯著降低;雖然過氧化氫酶活性和谷胱甘肽濃度整體下降,但與對照組相比差異不顯著。此外,Chen et al.(2017)發現AlCl3暴露可能導致斑馬魚(Barchydanio rerio)胚胎發育障礙以及幼魚神經行為異常。
早期文獻(Freeman,1978)報道,在pH 8-9偏堿的水中,鋁酸根離子>0.5 mg·L-1時可使鮭魚(Oncorhynchus keta)致死;沉淀的Al(OH)3不會使鮭魚急性中毒,卻能引起慢性中毒。鋁對鮭魚魚苗的毒性可能主要來自鋁的無機態化合物,用檸檬酸與鋁鹽反應能大大地降低鋁的毒性(Driscoll et al.,1980)。在硬水中當鋁的有效濃度為2 mg·L-1以上時,就產生絮凝作用,由于鋁鹽絮凝沉淀作用,仔魚在高鋁濃度(16 mg·L-1)中4日以上也未出現死亡。因此,鋁的毒性除與其濃度和價態有關外,還高度取決于水的 pH值與硬度(Ca2+含量)(張凱松等,2003;石慧,2016;Gensemer et al.,2018)。在酸性土壤中,Ca2+、Mg2+和Al3+會交換H+,土壤溶液中更多Al3+、H+溶出隨徑流或土壤間隙水進入湖泊河流,使水中的Al3+與H+高度正相關,并且可能達到對水生生物的毒性水平(>0.2 mg·L-1。Evans et al.,1981)。草魚仔魚在pH 5.0的軟水中鋁致死閾濃度為0.1 mg·L-1,96 h的半致死濃度LC50為0.26 mg·L-1(李威等,2007)。
2.3 對植物的毒性效應
目前關于鋁鹽對植物的毒性影響研究主要集中于陸生植物,尤其是農作物,比如玉米、小麥、高粱、水稻、大豆等(Poschenrieder et al.,2008;Maron et al.,2010;Delhaize et al.,2012;Tovkach et al.,2013;李婷等,2017;Chen et al.,2018),而對水生植物的鋁毒影響研究還很缺乏,尤其是對沉水植物的毒性研究。已有研究表明鋁毒首要毒害目標為植物的根系(Robert et al.,1999;Chen et al.,2018),鋁毒抑制其根尖細胞的分裂和發育伸長,使得根端組織變得粗短和扭曲;影響植物對營養鹽及水分的吸收(Liu et al.,2014a);而且抑制代謝過程中關鍵酶的活性(劉鵬等,2004),對細胞結構造成傷害等(Poschenrieder et al.,2008),進而使植物抵御外來侵害的功能變得十分脆弱。另外,鋁鹽對植物有直接毒害作用,也存在鈍化磷從而降低植物可利用性磷供給的影響,土壤中的鋁被活化而成為溶解態進入土壤溶液,與磷酸鹽結合生成AlPO4,土壤中的磷被固定而不易被植物吸收,使植物缺磷而影響生長。
姬婭嬋等(2013)研究不同濃度鋁鹽對苦草(Vallisneria natans)生長的影響,表明高劑量使用鋁鹽(45 mg·L-1)顯著抑制苦草生長速率,其塊莖和分株數小于低劑量組(15 mg·L-1)。有研究表明高于 700 μg·L-1的鋁鹽濃度對五刺金魚藻(Ceratophyllum oryzetorum)的生長產生明顯損害,其葉綠素含量顯著降低,SOD活性、POD活性、可溶性蛋白及MDA含量變化表現出受脅迫特征,且導致剛毛藻體的死亡(張玥等,2016a)。菹草(Potamogeton crispus)可能對鋁鹽具有較高的耐受性,(350±50)-(1100±150) μg·L-1Al劑量組的明礬溶液對菹草葉綠素、可溶性蛋白含量、POD活性、游離脯氨酸含量無顯著影響,不同處理濃度的鋁鹽投加對菹草的生長沒有造成明顯損害(張玥等,2016b)。Lin et al.(2017a)研究表明水體殘余鋁鹽顯著抑制苦草和黑藻(Hydrilla verticillata)生長形態學發展,其生理指標葉綠素、蛋白含量和丙二醛含量變化也顯示受鋁鹽的脅迫。長期≥1.2 mg·L-1的 Al顯著抑制菹草石芽的萌發且影響其幼苗的生長,葉綠素含量和根系活力隨著鋁鹽濃度升高而降低(Lin et al.,2017b)。
在器官、組織和細胞水平上鋁對植物均產生毒性作用(Liu et al.,2014b),降低農作物產量(Poschenrieder et al.,2008;Ribeiro et al.,2013)。前期研究表明鋁對植物的毒性效應主要體現在以下幾個方面(表1)。
植物遭受鋁毒后,不僅在形態上和細胞學上變化明顯,而且在生理生化方面的影響也很顯著。鋁可以與植物細胞中的蛋白質、脂質、糖類結合,還能與有機酸、三磷酸腺苷及脫氧核糖核酸等主要的生長分子發生螯合,嚴重干擾植物細胞內離子的正常代謝,引起代謝紊亂,影響各種生理生化過程的正常進行,出現細胞、組織傷害的綜合癥狀,從而抑制植物的生長(王志穎等,2010)。體現如表2。
2.4 對人體的毒性效應
一定濃度范圍下鋁對人體可能是有益的,可以抵抗鉛的毒害作用,氫氧化鋁曾用來治療胃腸疾病(崔蘊霞等,1998)。WHO和糧農組織1989年確定鋁為食品污染物并進行了管理, 指出人體攝入鋁的含量為 0.7 mg·kg-1。正常人體總含鋁量是 50-100 mg,人體允許每日鋁攝入量不能超過 0.7 mg·kg-1(賀婷婷,2013),進入胃腸道的鋁吸收率為0.1%,10%左右隨糞便排出體外,剩余鋁經腸道吸收進入人體后,很難再從體內排出,且分布于體內各器官,肝、胃、脾、腦和甲狀腺是積蓄較多的器官,如果積累過多會造成早衰和老年癡呆癥(鄭倩,2017)。在細胞培養中發現,鋁可使細胞形態發生變化,鋁一旦進入細胞,可以與某些蛋白質結合,與酶、核酸、三磷酸腺苷等重要的物質相互作用,干擾體內的多種生化反應,影響某些器官和細胞的物質代謝,導致其功能障礙(Ramirez-duarte et al.,2017)。
許多研究表明,臨床上鋁中毒表現主要有三大癥狀:鋁性腦病、鋁性骨病和鋁貧血等(Namiesnik et al.,2010)。鋁過量會造成骨質疏松軟化、骨骼及肌肉變形、腎功能失調,甚至引起阿爾茨海默癥、唐氏綜合癥等癥狀(杜鵬,2018;World Health Organization,2017)。鋁抑制膽堿乙酰轉移酶活性和合成,提高膽堿酯酶活性,破壞膽堿能神經元和影響鈣離子釋放等使得學習記憶功能減退。此外,鋁影響細胞形態、神經遞質及有關酶類在內的神經活動的多個環節,造成腦組織氧化損傷,促進脂質過氧化或還原型輔I氧化,導致超氧陰離子等活性氧的產生,對細胞造成損害(孫中蕾等,2013)。鋁對神經細胞凋亡、Tau蛋白異常、神經細胞鈣離子系統平衡等也有影響(夏佳蕊等,2018)。鋁抑制Ca2+吸收,使甲狀旁腺激素下降,影響骨鈣吸收;與膠原蛋白結合沉積于骨,抑制成骨細胞與破骨細胞增殖;還可干擾骨磷酸酶產生及骨內鈣磷結晶的形成(孫中蕾等,2013)。進入機體的鋁能夠快速在肝臟蓄積并且抑制肝臟的正常機能,低劑量的鋁毒將導致肝膽部分炎癥等機能障礙。此外,鋁對生殖系統、免疫器官、細胞免疫、體液免疫、細胞因子等免疫系統均有不同程度的毒性(孫浩,2011;劉福堂等,2007)。
由于過去對鋁毒無認識,許多國家對飲用水中鋁含量沒有限制要求。近 30年來,鋁的毒性被發現并引起重視,一些國家先后制訂了飲用水鋁含量限制標準,但標準間差別較大,如前蘇聯對鋁的限值為 0.5 mg·L-1,美國環保局為 0.05 mg·L-1(United States Environmental Protection Agency,2009),世界衛生組織為0.2 mg·L-1,中國新制定的飲用水鋁濃度限值為0.2 mg·L-1(國家衛生部,2006)。世界衛生組織指出鋁的最高攝入量,每人每周每千克體重不超過2 mg,相當于一名60 kg的成年人每周攝取鋁含量不得高于 120 mg(World Health Organization,2010)。鋁危害問題已引起社會廣泛關注,美國國家標準協會將用于食品添加劑和水處理劑的鋁化合物列入劇毒物品,但中國關于鋁對人體毒性問題的研究,尚未作出明確的定論,控制食品及飲用水中鋁含量應是改善中國鋁攝入狀況的有效途徑之一。
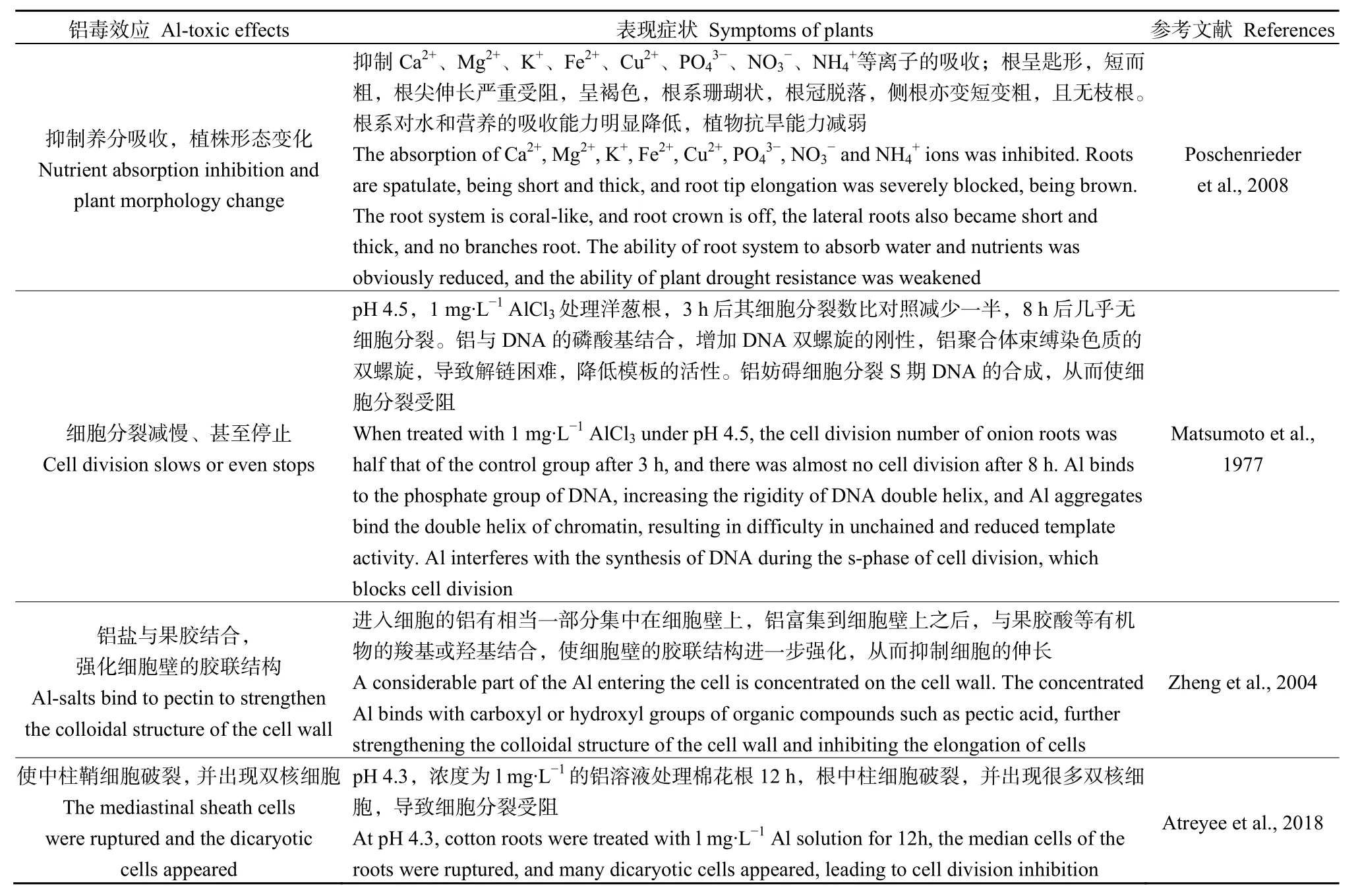
表1 鋁對植物的毒性效應及癥狀Table 1 Toxic effects and symptoms of aluminum on plants
3 影響鋁鹽遷移轉化及毒性的因素
大量不同形態的鋁通過不同的時空方式分散進入到水生態系統中,由于富集和反應導致毒害,鋁毒對飲水安全的影響受到越來越多的關注。已有研究表明,諸多外在的化學因子影響鋁的遷移轉化及其毒性,主要的有 pH、溫度、陽/陰離子、磷結合物、有機酸種類及濃度、水體硬度、流速等(Robert et al.,1999;Namiesnik et al.,2010;Sun et al.,2018)。鋁鹽進入水體后會發生一系列的化學反應和物理轉化遷移,諸如水解作用、螯合作用、絮凝和沉淀等(Kasper et al.,2005),因此鋁的形態對其遷移轉化非常重要,溶解性單體鋁包括自由含水離子、氫氧化鋁、硫酸鹽、氟化物和小分子質量的HA和富里酸結合物。
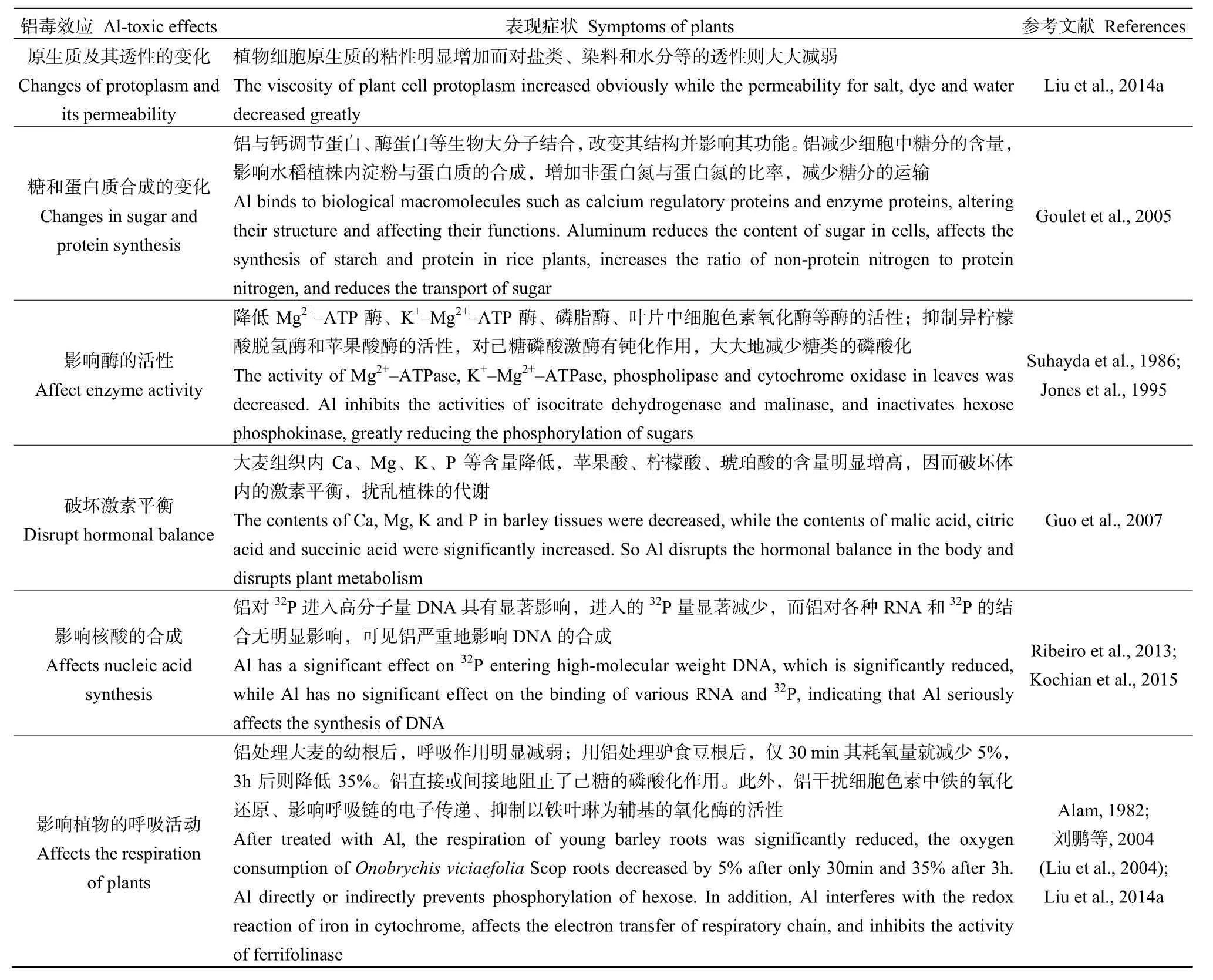
表2 鋁對植物生理生化特征的影響Table 2 Effects of aluminum on plant physiological and biochemical characteristics

圖2 模擬研究水體pH 4-10變化下鋁形態轉化(Robert et al.,1999)Fig. 2 Aluminum speciation from simulation experiment under water pH varying 4-10 (Robert et al., 1999)
3.1 pH和陰陽離子
在鋁鹽水解反應中,會生成多種小分子的鋁復合物,它們彼此間存在平衡:Al3+lOHAl2(OAl3(OAl8(OAl13O4(OH)Al(OH)3(Burgess,1992),這些平衡,即鋁的溶解性和形態形式受pH直接控制,因此極少量的溶解鋁也會因pH作用而改變(圖2)。因pH與H+濃度相關,因此自由Al3+與H+活性之間存在顯著相關性。鋁的毒性主要表現為活性鋁的毒性,由于鋁是兩性元素,因此,水中殘留活性鋁的量與 pH值和投加量密切相關。水體pH越低,溶解態的鋁濃度越高,其毒性也越強(Stodart et al.,2007),鋁毒在pH 5.5-6.0最強,在pH 7.0最弱。但是鋁毒的受體不同,其對鋁毒性的耐受力也強弱不一,此外實驗條件下不同培養基和生長條件對鋁毒也存在影響。
與 H+保護自由 Al3+活性相似,其他陽離子(Ca2+、Na+、Mg2+、K+)也保護鋁毒對高等植物和耐酸藻類的毒害(Guo et al.,2007;Sun et al.,2018),相反,鋁也干擾Ca2+的吸收和代謝。除了H+和其他陽離子外,溶解性陰離子也會通過改變 Al的形態形成而影響其毒性,包括氟化物、硫酸鹽、磷酸鹽、硝酸鹽和硅酸鹽等,這些結合物的形成會降低Al3+活性從而降低其毒性。
3.2 有機物種類及濃度
水體、湖泊底泥、土壤等都含有腐殖質,該物質帶有羧基、酚基、酮基、氨基等活性基團,在環境重金屬的遷移中具有重要作用(Niu et al.,2018)。其中的HA是金屬離子和微量元素的絡合劑,水體中的HA類物質還是鹵化副產品的重要前驅物。此外,水體酸化引起腐殖質特性改變,從而對環境造成影響。鋁可與包括合成的和自然的溶解性有機物(DOM)(HA和富里酸)形成或弱或強的結合物,使溶解態鋁處于固化狀態降低Al3+活性,而由于影響生物膜的可利用性無機鋁含量下降其對生物的毒性也減弱(Robert et al.,1999;Niu et al.,2018)。
DOM 可通過降低溶液中對魚鰓產生毒性作用的鋁含量來防止鋁的生理和毒理學效應。DOM 濃度越高,越多的 Al會結合到有機物,其去鋁毒能力與OH/COOH基團在主鏈上的相對位置及它們與鋁形成穩定環形結構的能力直接相關(Provenzano et al.,2004;Tamer et al.,2015)。HA不僅在自然水體中的金屬形態形成方面發揮重要作用(Chang et al.,2004),而且HA能夠阻擋Al3+對營養吸收的毒性影響,從而中和Al3+對植物主根和側根生長的毒害(Schindler et al.,1992;Tamer et al.,2015)。
3.3 磷結合物
鋁鹽水解作用形成Al(OH)3絮狀物沉淀到湖泊底質,或鋁鹽結合磷營養使其鈍化降低植物和藻類可利用性P的供給,其絮狀物覆蓋在沉積物表層亦可阻止沉積物下層氮磷營養鹽的釋放(Agarwal et al.,2016)。磷被結合以磷酸鋁鹽形式沉淀是致使磷低可利用性和磷去除的主要機制(Cooke et al.,2005;Nogaro et al.,2013;Rott et al.,2017),水體中存在兩種溶解性無機單體 Al-P形態(AlH2和 AlH)和一種不溶的 AlPO4(Namiesnik et al.,2010;Rott et al.,2017)。
3.4 其他因子
溫度影響鋁形態的變化和鋁的溶解性。Lydersen(1990)研究表明溫度降低15 ℃對鋁形態的變化影響相當于 pH值降低 1個單位的影響。Poleo et al.(1991)也發現 270-400 μg·L-1的鋁溶液對大西洋鮭魚仔魚的毒性隨溫度升高(1-19 ℃,pH 5.0)而升高。流速和人為干擾影響鋁鹽在水體中的遷移,從而影響其空間分布,鋁鹽毒性因濃度不同而產生差異。當然,鋁并不是水體中唯一的潛在有毒金屬,其他金屬的存在對鋁毒可能具有增強或降低作用,或具有協同作用(Grippo et al.,1996)。
4 結論與展望
自然條件下,鋁主要以金屬鋁、氧化鋁、鋁鹽化合物、含鋁礦石等形態存在于陸地生態系統;水生生態系統中,鋁主要以無機單體鋁(Al3+,AlOH2+,Al(O,Al(O)、無定型絮狀物 Al(OH)3和聚合鋁(如 Al13O4(OH)24(H2)等形態存在。隨著經濟和社會的發展,人為原因加快了鋁進入生態系統的速度,也加劇了鋁對生命組分的毒害作用與危害。鋁通過抑制酸性磷酸酶活性或影響營養物質的利用對藻類群落結構組成和藻細胞產生影響。鋁是鰓毒性物質,引起離子調節和呼吸紊亂,對魚類器官組織、生長發育和生理代謝具有劑量毒性作用。而且鋁在人體蓄積后對神經、骨骼、肝臟、免疫等產生不同程度的損害。植物鋁毒機制主要包括:(1)對根系細胞分裂及伸長的抑制;(2)對植物營養物質吸收的抑制;(3)對植物體內關鍵酶代謝的抑制;(4)對遺傳物質及細胞結構的損傷等。不同形態的殘留鋁具有不同的毒性效應,尤其以溶解性單體鋁毒性最強。影響鋁毒的因子主要包括pH、Al3+形態及濃度、環境溫度、水體硬度、腐殖酸/有機酸含量,結合配體濃度等。
鋁的優越特性賦予其廣泛的用途,但其作用和毒性效應與其形態、濃度及環境條件有密切關系,鋁制品在使用中存在的潛在環境問題倍受人們關注(李威等,2007;World Health Organization,2017),因此,在人類生產生活中應合理科學使用鋁制品,嚴格把控飲用水及食品中鋁濃度標準。綜觀鋁鹽絮凝劑的發展過程,高分子、復合性鋁鹽絮凝劑比低分子、單一型的用量小、殘留量低(劉睿等,2005;張亞文等,2009),聚合型的鋁較單體鋁和離子態的鋁毒性弱,所以工業水處理中應加快研發應用高效環保的大分子聚合/微生物絮凝劑,控制水處理廠出水中殘余鋁濃度。
由于環境酸化越來越嚴重,且水環境中鋁越來越多,因此,研究生態系統中鋁的含量對環境的影響、產生的危害等有極其重要的實際意義,對湖泊生態系統中鋁含量分布和生態風險進行調研和評估,是目前水環境保護和治理的緊迫和必要任務之一。且由于鋁為兩性元素,建議進一步研究鋁鹽在堿性環境中的毒性作用以及鋁鹽對水生植物、底棲動物等的毒性作用。

