槲皮素對Aβ25-35致PC12細胞損傷的雌激素樣保護作用及分子機制
王 翠,郭童林,沈麗霞
(河北北方學院藥學系,河北省神經藥理學重點實驗室,河北 張家口 075000)
阿爾茨海默病(Alzheimer’s disease,AD)是一種起病隱匿、進行性發展的神經退行性疾病。AD的病因和發病非常復雜,至今仍未明確,淀粉級聯假說認為,β淀粉樣蛋白(β-amyloid,Aβ)在大腦皮層的堆積是AD早期病理發生的關鍵,并最終導致AD其它的病理表現[1]。此外,Aβ的沉積是tau蛋白病變的上游機制,在Aβ引起的級聯反應下游,tau蛋白代謝異常是引起神經元功能退化,甚至凋亡的重要原因之一[2]。其中,糖原合成酶激酶-3β(glycogen snythase kinase 3β,GSK-3β)是主要的tau蛋白激酶,并且與tau蛋白的異常磷酸化聯系最為密切,參與機體多個細胞信號轉導通路,是PI3K/Akt信號通路的下游分子[3]。PI3K/Akt信號通路具有磷酸化GSK-3αSer-21、GSK-3βSer-9的作用,磷酸化GSK-3β可以引起促細胞存活基因的表達,從而促進細胞存活[4]。近年來研究表明,雌激素不僅調節生殖系統的生長發育,而且參與AD的病理生理過程,發揮著重要的神經保護作用[5]。雌激素不僅能夠調節基因轉錄,也能與細胞膜上的雌激素受體(estrogen receptor,ER)、G蛋白偶聯受體30結合,激活PI3K和MAPK信號通路[6]。因此,GSK-3β以及相關的PI3K/Akt信號通路已成為以tau蛋白病理學為特征的神經退行性疾病的早期診斷和治療的重要靶點。
為避免雌激素長期應用引起的不良反應,植物雌激素受到廣泛關注。許多研究顯示,植物雌激素能與細胞膜及細胞核內的ER結合,發揮神經保護、抗氧化和抗凋亡作用[7-8]。課題組以往的實驗證實,槲皮素(quercetin,Que)對原代培養的初生大鼠海馬和皮層神經元具有雌激素樣保護作用。本實驗以Aβ25-35誘導PC12細胞損傷為模型,通過ER介導的相關信號轉導通路,探討槲皮素雌激素樣保護作用的分子機制,進而探索植物雌激素替代雌激素作為AD治療性藥物的可行性。
1 材料與方法
1.1 材料
1.1.1細胞株 大鼠腎上腺嗜鉻細胞瘤細胞(PC12,高分化型),購自中國科學院典型培養物保藏中心昆明細胞庫。
1.1.2藥物與試劑 槲皮素(純度98%,批號:100081-200907)、金雀異黃素(純度99.1%,批號:111704-201302),均購自中國藥品生物制品檢定研究院;17β-雌二醇(Abcam公司,批號:APN11282-1-1);Aβ25-35(Sigma公司,批號:A4559);ER拮抗劑ICI182,780(Abcam公司,批號ab120131);DMEM高糖培養基(HyClone公司,批號:SH30284.01);四季青無噬菌體低內毒素特級胎牛血清(浙江天杭科技公司,批號:11011-8611);MTT(Biosharp生物科技公司,批號:BS030A);β-actin抗體(Santa Cruz公司,批號:SC47778);抗體ERα(批號:ab32063)、ERβ(批號:ab3576)、p-Akt(Ser473)(批號:ab81283)、total-Akt(批號:ab32505),均購自Abcam公司;抗體p-GSK-3β(Ser9)(批號:5558S);GSK-3β(批號:12456T),購自CST公司;IRDye 680RD羊抗鼠二抗(批號:926-68170)、IRDye 800CW羊抗兔二抗(批號:827-08365),均購自Odyssey公司;Alexa Fluor?594羊抗兔二抗(Abcam公司,批號:ab150080)。
1.1.3儀器 CO2培養箱(Thermo公司);倒置顯微鏡(Nikon公司);超速冷凍離心機(Sigma公司);Cytation5細胞成像微孔板檢測儀(BioTek公司);Odyssey CLy紅外熒光掃描成像系統(LI-COR公司);FV3000共聚焦激光掃描顯微鏡(OLYMPUS公司)。
1.2 方法
1.2.1細胞培養 PC12細胞用無酚紅的DMEM高糖培養基(含10%胎牛血清、100 kU·L-1青霉素、0.1 g·L-1的鏈霉素),置于37 ℃、5% CO2培養箱中培養,每2~3 d傳代1次。
1.2.2MTT法檢測細胞存活率
1.2.2.1Aβ25-35致PC12細胞損傷模型的建立 將細胞以8×107·L-1的密度接種于96孔板中,每孔100 μL培養液,細胞培養24 h后,吸出培養基,加入不同濃度的Aβ25-35(終濃度1、5、10、20、30 μmol·L-1)繼續培養24 h,每組設4個復孔。
1.2.2.2不同濃度Que對PC12細胞的影響 實驗分為正常對照組、Que組(終濃度1.25、2.5、5、10、20、40、50、60、80、100、200 μmol·L-1),加藥培養24 h,每組設4個復孔。
1.2.2.3不同藥物對細胞損傷模型的影響 本課題組及其他研究結果均已證實[9-10],17β-雌二醇(17β-estradiol,17β-E2)與金雀異黃素(genistein,Gen)均可以對Aβ25-35誘導的PC12細胞損傷起到保護作用。因此,本實驗選擇17β-E2與Gen作為陽性對照藥。實驗分組為:正常對照組、模型組(Aβ25-3520 μmol·L-1)、17β-E2 0.1 μmol·L-1組、Gen 50 μmol·L-1組、Que組(40、60、80 μmol·L-1),MTT法檢測細胞存活率。同時,設置ER拮抗劑ICI182,780組,將終濃度為1 μmol·L-1的ICI182,780在培養箱中預孵育1 h,然后棄去培養基,按照正常對照組、Aβ25-35組、Que組、ICI組、ICI+Que組分別給藥。
1.2.3細胞免疫熒光染色檢測ERα和ERβ的表達 取對數期細胞,以2×108·L-1的密度接種到激光共聚焦專用的細胞培養皿中,按照“1.2.2.3”的分組分別加藥培養24 h后,棄去含藥培養基,依次用4%多聚甲醛室溫固定15 min,0.1% TritonX-100透化液室溫下處理細胞10 min,5%牛血清白蛋白室溫作用細胞2 h,分別加入一抗ERα(1 ∶200)、ERβ(1 ∶200)4 ℃過夜,根據一抗性質加入Cy3標記的山羊抗兔二抗(1 ∶500,PBST稀釋),室溫避光孵育1 h,滴加DAPI染色液避光作用15 min,對細胞核進行復染,激光共聚焦顯微鏡下觀察,采集圖像,使用Image-Pro Plus6.0軟件分析結果,實驗重復3次。
1.2.4Western blot檢測相關蛋白的表達 將細胞以6×108·L-1的密度,每皿加入6 mL細胞懸液,按照“1.2.2.3”的分組分別作用PC12細胞24 h,收集細胞,加入裂解液,冰上裂解30 min后,4 ℃、12 000 r·min-1離心30 min,吸取上清,BCA法測定蛋白含量,95 ℃蛋白變性10 min。確保蛋白上樣量在30 μg以上,采用10% SDS-PAGE凝膠電泳分離蛋白,轉膜,5%脫脂奶粉室溫搖床封閉2 h,加入一抗β-actin、ERα和ERβ(1 ∶500)、p-Akt(1 ∶1 000)、total-Akt(1 ∶2 000)、p-GSK-3β(1 ∶500)、total-GSK-3β(1 ∶1 000),4 ℃孵育過夜,TBST洗膜4次,每次5 min,室溫搖床孵育熒光二抗1 h(1 ∶15 000),TBST洗膜4次,每次5 min,紅外熒光掃描成像系統檢測分析條帶灰度值。
2 結果
2.1 Aβ25-35致PC12細胞損傷模型的鑒定Fig 1的MTT結果顯示,Aβ25-35(1、5、10、20、30 μmol·L-1)作用細胞24 h,細胞存活率逐漸降低,與濃度呈正相關,表明細胞的增殖受到明顯抑制,與對照組相比差異有統計學意義(P<0.05)。Aβ25-35作用PC12細胞24 h的半數致死濃度(IC50)為27.34 μmol·L-1,故選擇20 μmol·L-1的Aβ25-35作用PC12細胞24 h,建立AD體外細胞損傷模型。
2.2 槲皮素對Aβ25-35致PC12細胞損傷模型的影響本課題組前期研究結果表明,槲皮素濃度低于80 μmol·L-1時不會對細胞造成毒性損傷,故選擇槲皮素(40、60、80 μmol·L-1)用于后續實驗。大量實驗結果均表明,17β-雌二醇和金雀異黃素通過ER參與并激活其它信號途徑,發揮神經保護作用,故選擇其為陽性對照藥,MTT結果顯示,0.1 μmol·L-1的17β-E2和50 μmol·L-1Gen與Aβ25-35共同作用細胞的存活率最高,故用于后續實驗中的陽性對照藥給藥劑量。低、中、高濃度的槲皮素與Aβ25-35共同作用細胞24 h后,17β-E2(0.1 μmol·L-1)組、Gen(50 μmol·L-1)組、Que(40、60、80 μmol·L-1)組與模型組相比,細胞存活率均明顯升高(P<0.05),表明槲皮素可以保護Aβ25-35誘導的PC12細胞損傷(Fig 2A)。為進一步探討這種保護作用是否通過ER發揮作用,同時加入ICI182,780(1 μmol·L-1),結果發現,Que(60 μmol·L-1)組細胞的存活率明顯高于模型組(P<0.01),Aβ+Que+ICI組與Aβ+Que組相比,能明顯抑制細胞的存活率(P<0.01),表明槲皮素對細胞的保護作用可被ER拮抗劑ICI182,780所拮抗(Fig 2B)。

Fig 1 Effect of Aβ25-35 on viability of PC12 cells n=4)
*P<0.05,**P<0.01vscontrol
2.3 細胞免疫熒光染色檢測ER表達免疫熒光染色結果表明(Fig 3),與對照組相比,模型組ERα蛋白表達的熒光強度明顯減弱(P<0.01);與模型組相比,17β-E2組、Gen組、Que(40、60、80 μmol·L-1)組中,ERα蛋白表達的熒光強度明顯增加(P<0.01)。各組ERβ蛋白與模型組相比熒光強度均有所增加,但差異無顯著性(P>0.05),見Fig 4。
2.4 槲皮素對Aβ25-35致PC12細胞相關蛋白表達的影響Fig 5、6結果表明,與對照組相比,模型組ERα、p-Akt、p-GSK-3β蛋白的表達均明顯降低(P<0.01);陽性藥物17β-E2組、Gen組和Que組均明顯上調了上述3種蛋白的表達量(P<0.01),而模型組和不同給藥組對ERβ、total-Akt和total-GSK-3β蛋白表達的影響并不明顯(P>0.05)。

Fig 2 Effect of quercetin on PC12 cells
A: Effect of different concentrations of quercetin on PC12 cells viability induced by Aβ25-35; B: Effect of quercetin on PC12 cells viability induced by ICI182,780.**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35;△△P<0.01vsAβ25-35+Que.
2.5 槲皮素與ICI182,780共同孵育后相關蛋白表達的變化如Fig 7所示,與對照組相比,各實驗組total-Akt和total-GSK-3β蛋白表達基本無變化(P>0.05)。Aβ+Que組與模型組相比,p-Akt、p-GSK-3β蛋白水平明顯升高(P<0.01);而Aβ+Que+ICI與Aβ+Que組相比,p-Akt、p-GSK-3β蛋白水平明顯降低(P<0.01)。提示槲皮素上調上述蛋白水平的作用可被ER抑制劑所拮抗。
3 討論
迄今為止,AD的病因和發病機制仍未完全闡明,普遍被認可的發病機制是β-淀粉樣蛋白學說。研究認為,Aβ沉積是AD發病的中心環節,Aβ的神經毒性是多種因素導致AD發病的共同通路[11-12]。PC12細胞廣泛用于神經藥理學的體外實驗研究,受神經生長因子(nerve growth factor,NGF)處理時間長短或劑量大小影響,當PC12細胞處于未分化狀態,或NGF處理時間短或劑量小時,不表達ER蛋白,故本課題組選用高分化狀態的PC12細胞用于AD體外模型的研究。本實驗結果表明, 20 μmol·L-1的Aβ25-35作用PC12細胞24 h時,細胞活力明顯降低,因此,用于建立AD體外損傷模型,探討槲皮素對AD發揮雌激素樣保護作用的分子機制。

Fig 3 ERα expression by immunofluorescence staining(×400)
A: Immunofluorescence staining of positive ERα protein; B: ERα mean fluorescent intensity.**P<0.01vscontrol;##P<0.01vsAβ25-35.

Fig 4 ERβ expression by immunofluorescence staining(×400)
A: Immunofluorescence staining of positive ERβ protein; B: ERβ mean fluorescent intensity.

Fig 5 Effects of quercetin on ERα, ERβ protein expression in PC12 cells induced by Aβ25-35 n=3)
**P<0.01vscontrol;##P<0.01vsAβ25-35

Fig 6 Effects of quercetin on expression of p-Akt, p-GSK-3β in PC12 cells induced by Aβ25-35 n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35

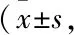
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35;△△P<0.01vsAβ25-35+Que
本實驗用Aβ25-35誘導PC12細胞24 h后,MTT法檢測細胞活力,結果顯示,與模型組相比,槲皮素藥物組與17β-雌二醇、金雀異黃素陽性藥物組類似,在一定劑量范圍內可以提高PC12細胞活性,初步驗證了槲皮素的神經保護作用。為探討槲皮素神經保護效應與ER的關系,使用ER完全拮抗劑ICI182,780,其能夠阻斷雌激素類物質通過ER介導的生物學活性。MTT結果表明,加入抑制劑預孵育細胞后,槲皮素對細胞的保護作用受到明顯抑制。而細胞免疫熒光和Western blot的結果也發現,槲皮素可以明顯提高ERα蛋白的表達,對于ERβ蛋白,槲皮素和模型組的蛋白表達量之間差異無顯著性;當加入ICI182,780時,槲皮素的神經保護作用減弱,表明槲皮素具有一定的雌激素樣作用,且可能是由ERα介導的。
植物雌激素同雌激素類似,除了在基因組作用下,與位于細胞質和細胞核上的ER結合,與目標基因啟動子上的雌激素反應元件(estrogen response element,ERE)結合發揮效應,還能與膜上ER結合,通過第二信使,激活一系列信號通路,間接調節基因轉錄,可以在幾秒到幾分鐘內產生快速的生物學效應[13]。本研究表明,槲皮素不僅通過與ERα結合發揮雌激素樣神經保護作用,還可快速激活細胞內PI3K/Akt/GSK-3β信號轉導通路。Western blot結果顯示,槲皮素藥物組、17β-雌二醇和金雀異黃素陽性藥物組p-Akt、p-GSK-3β蛋白表達量明顯高于模型組。表明槲皮素可以拮抗Aβ25-35誘導的PC12細胞損傷,其機制為通過激活PI3K/Akt信號通路,抑制下游靶分子GSK-3β活性,發揮神經保護作用。為進一步探討ER與PI3K/Akt信號通路的關系,使用工具藥ICI182,780干預PC12細胞后,檢測細胞中p-Akt、p-GSK-3β蛋白的表達,結果表明,當ICI182,780存在時,上述蛋白的表達均被明顯抑制,表明槲皮素提高p-Akt、p-GSK-3β的表達可能有ER參與。因此,槲皮素通過經典的ER通路及PI3K/Akt/GSK-3β信號通路發揮保護作用,兩種途徑存在交叉和相互影響。
ER是核激素受體超家族成員,與DNA應答元件結合的配體依賴型轉錄調控因子。經典的ER包含ERα和ERβ兩種亞型。有研究表明,植物雌激素具有類雌激素和/或抗雌激素活性的雙向作用,不同類型的植物雌激素與ER結合的親和力不同而表現出不同的作用效能,金雀異黃素等對ERβ親和力更強[14]。本課題組之前的研究結果發現,金雀異黃素和槲皮素可以通過ER促進MCF-7和T47D細胞的增殖,提高細胞分裂增殖指數,從而表現出雌激素樣活性。我們前期的研究也證實,與其他植物雌激素不同的是,槲皮素對海馬或皮層神經元的保護作用主要是通過ERα受體介導的。綜上所述,通過雌激素耗竭條件下建立穩定的AD體外損傷模型,證實槲皮素具有雌激素樣作用,對Aβ25-35誘導的PC12細胞的損傷具有保護作用,其通過經典的ER途徑,影響PI3K/Akt/GSK-3β信號通路的激活。這也為我們后續對槲皮素是否通過抑制tau蛋白的過度磷酸化,發揮神經保護作用的分子機制研究奠定了理論基礎,以期更好地發揮槲皮素此類植物雌激素在退行性神經疾病中的應用價值。