雌激素對一氧化碳中毒遲發型腦病大鼠海馬的影響
明 利,辜剛鳳,紅 艷,雷蕊綺,蔣 力,李經倫
(1.成都天府新區人民醫院神經內科,四川 成都 610213;2.西南醫科大學臨床醫學院,四川 瀘州 646000;3.西南醫科大學附屬醫院神經內科,四川 瀘州 646000)
一氧化碳(CO)中毒是最為常見的致命性空氣中毒,因其神經損害嚴重,臨床癥狀多且復雜,治療及預后不佳,造成了一系列嚴重的健康問題[1]。部分患者在發生CO中毒癥狀恢復后經過約2周左右的無癥狀期后,可出一系列神經系統癥狀和體征,主要為表現為記憶、認知功能、內臟自主神經系統功能障礙等,稱為急性CO中毒遲發性腦病(DEACMP)[2]。雌激素是人體內常見甾體類固醇激素,具有抗氧化應激、抑制細胞凋亡、改善線粒體功能、協調神經營養因子表達等功能[3]。在阿爾茨海默病、帕金森病等神經系統疾病中具有一定的保護作用。胡慧軍等在CO中毒遲發型腦病臨床實驗中發現,在相同的中毒環境下,絕經前女性中毒程度更輕、預后更好,并首次提出女性生殖激素可能在CO中毒后的腦損傷中具有保護作用[4]。髓鞘堿性蛋白(MBP)及髓過氧化物酶(MPO)與多種神經系統疾病的發生密切相關,可作為炎癥、應激指標評估神經系統損傷的程度。本文探討雌激素在CO中毒遲發性腦病中的作用,在實驗中建立了DEACMP大鼠模型,測定雌激素在DEACMP中對大鼠血清 MBP、MPO的表達影響,為雌激素在CO中毒遲發型腦病的臨床治療中提供理論依據。
1 材料與方法
1.1 實驗動物及分組2017年10月,西南醫科大學選用雄性SD鼠(250-300 g)72只隨機分為空氣組、CO組和雌激素組,每組各設置3個亞組,每個亞組8只大鼠。大鼠由西南醫科大學動物中心提供,飼養在恒溫干凈的房間,溫度(22±2) ℃,設置為12 h光暗周期。
1.2 急性CO中毒大鼠模型的制作及檢測將實驗大鼠按首劑100 ml/kg腹腔注射CO氣體,后分別間隔4、8、12小時追加注射首劑的一半。隨后隨機抽取每個亞組大鼠1只,分別于染毒前及首次染毒后15 min及每隔兩小時至20 h時分別取鼠尾靜脈血0.5 ml血氣分析測定HbCO濃度。于造模結束后,雌激素組大鼠每天9:00-10:00時皮下注射溶有10 μg 17β一雌二醇的0.1 ml大豆油。CO組空氣組和對照組皮下注射0.1 ml大豆油,直至處死。
1.3 Morris水迷宮將水迷宮放在避光避聲的房間,水溫保持在(20±1) ℃。大鼠每天訓練2次,設定最長游動時限為120秒,以記錄大鼠找到平臺時間稱逃避潛伏期。考慮大鼠中毒后短時間內不能進行水迷宮實驗,我們的水迷宮實驗選擇造模前及從第3天開始進行,因嚴重急性CO中毒會導致大鼠無法進行水迷宮試驗的大鼠將被淘汰。訓練6天,第7天正式進行定位導航和空間探索,造模前淘汰有認知功能障礙大鼠,造模后篩查出發生遲發型腦病大鼠并做標記。
1.4 酶聯免疫吸附試驗(ELISA)在大鼠染毒后2小時、7天、14天、21天各亞組大鼠鼠尾靜脈取血5 ml進行MBP和MPO血清濃度測定。
1.5 標本制作各亞組大鼠在相應時間點,使用10%水合氯醛(0.3 ml/100 g)腹腔注射將大鼠深度麻醉迅速進行心臟灌洗固定后取腦行HE染色。
1.6 統計學方法采用SPSS 23.0統計軟件分析數據。計量資料以均數±標準差表示,重復測量數據比較采用方差分析及LSD-t檢驗;穿越平臺次數用非參數秩和檢驗,檢驗水準α=0.05。
2 結果
2.1 動物中毒改變行為學大鼠腹腔注射CO后出現輕度活躍,煩躁,呼吸急促,部分大鼠出現明顯躁狂、角弓反張。再次追加CO時大鼠表現為四肢癱軟、口唇黏膜發紺及肢體末端出現明顯櫻桃紅色,甚至出現昏迷及死亡(圖1,圖2)。整個染毒過程,CO組大鼠死亡11只,雌激素組死亡4只,空氣組大鼠全部存活,死亡大鼠及時用備用大鼠補充。CO組大鼠16小時內檢測其COHb濃度為(54.09±3.67)%,而空氣組COHb濃度為(0.65±0.28)%。
圖1 大鼠CO中毒后出現昏迷
圖2 大鼠CO中毒后口唇粘膜出現櫻桃紅色
2.2 水迷宮試驗結果在水迷宮試驗中,CO組大鼠逃避潛伏期在第3~21天均大于空氣組(P<0.05);CO組與雌激素組大鼠分別在14天和7天相比逃避潛伏期明顯延遲(P<0.05),空氣組在各時間點逃避潛伏期無明顯延遲(P> 0.05),見表1。在空間探索實驗中,CO組較空氣組及雌激素組在第14天時穿過平臺次數明顯減少,差異有統計學意義(P<0.05)。
2.3 HE染色結果空氣組大鼠在各時間點海馬CA1區細胞排列整齊,細胞結構完整;CO中毒組海馬組織神經元腫脹,細胞核出現固縮、破碎,染色質碎裂,胞質和胞核界限不清;雌激素處理組在各時間點神經元細胞壞死和CO中毒組相比一定程度上減輕。見圖1。
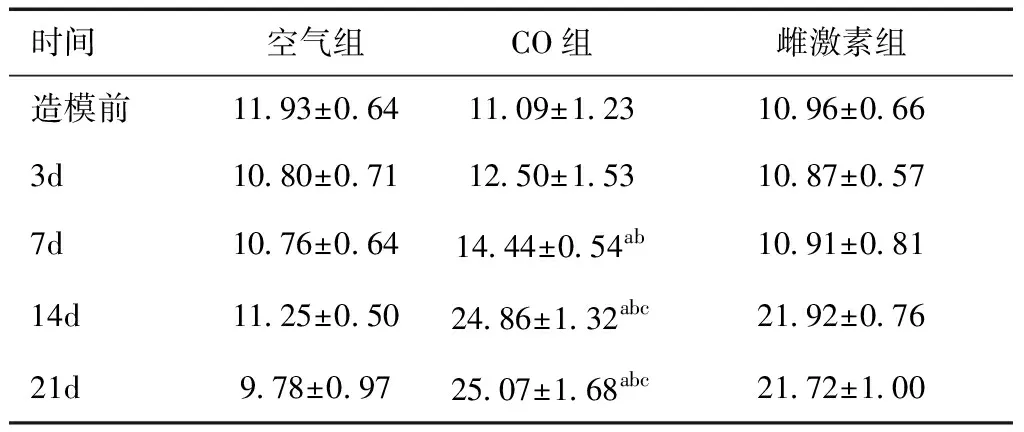
表1 三組大鼠各時間點逃避潛伏期比較 (s)
a與空氣組比較,P<0.05;b與雌激素組比較,P<0.05;c與造模前及3d、7d比較,P<0.05
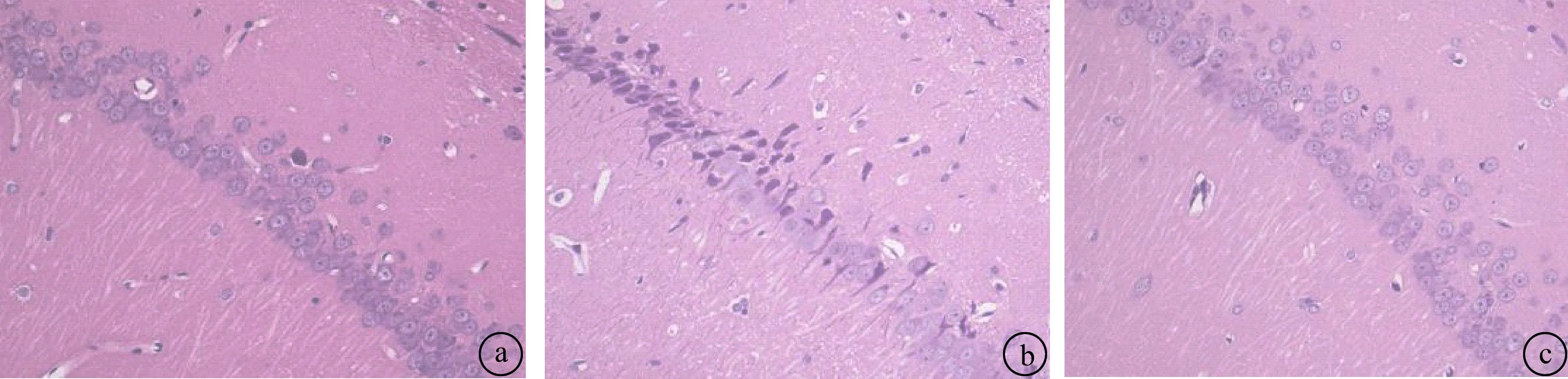
圖1 各組海馬組織在14天HE染色(×400倍) a:空氣組海馬CA1正常細胞;b:CO組海馬CA1細胞壞死明顯;c:雌激素海馬CA1細胞。
2.4 酶聯免疫法空氣組大鼠血清MBP、MPO濃度無明顯差異,差異無統計學意義(P> 0.05)。CO組MBP水平明顯高于空氣組和雌激素組(P<0.05)(表2)。CO組在第14天MPO濃度水平較空氣組及雌激素組也明顯增加(表3)。
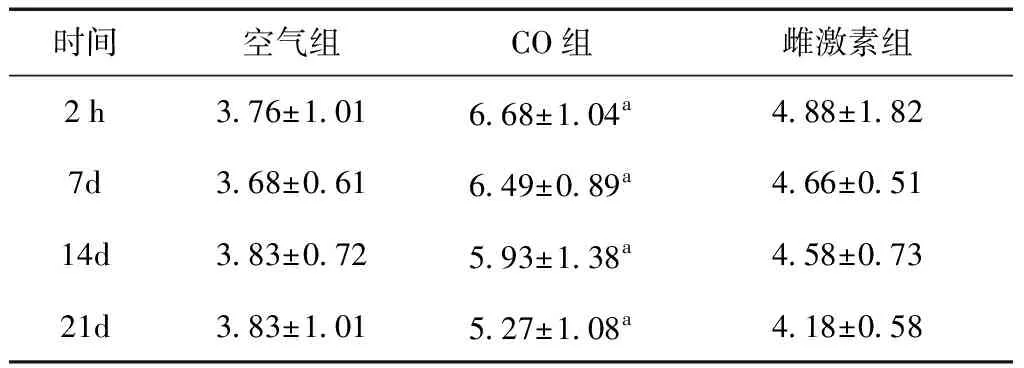
表2 三組大鼠各時間點MBP水平 (μg/L)
a與空氣組及雌激素組比較,P<0.05
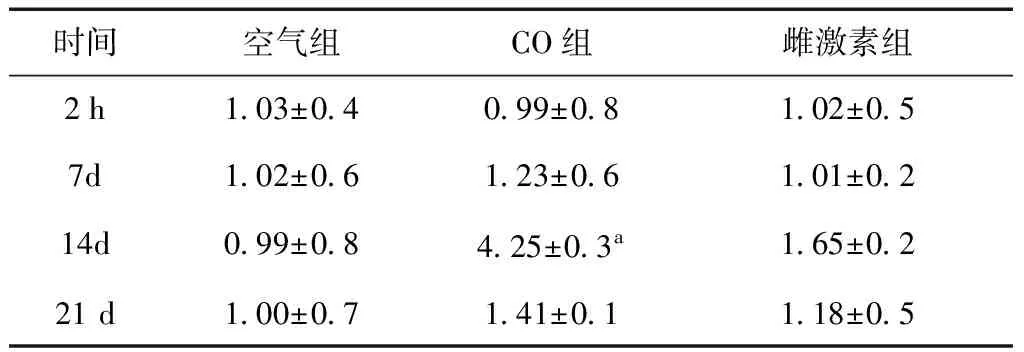
表3 三組大鼠各時間點MPO水平 (μg/L)
a與空氣組及雌激素組比較,p<0.05
3 討論
目前DEACMP的發病機制尚不明確,很多臨床及動物實驗發現其發病與炎癥反應、免疫損傷、氧化應激、細胞凋亡、腦白質脫髓鞘等可能存在關系[5,6]。既往研究證實海馬發揮著認知、學習、記憶等重要功能,其損傷和多種疾病的發生密切相關[7]。我們的實驗結果顯示,CO中毒后大鼠海馬組織出現了嚴重的病理損傷,主要表現為出現大量變性和壞死的神經元,在中毒第14天時達到高峰。Morris水迷宮主要檢測大鼠的空間記憶能力,主要涉及海馬相關腦區,在本實驗水迷宮實驗中結果中大鼠在CO中毒后的14~21天,逃避潛伏期出現明顯延遲,空間探索中經過目標象限的次數也明顯減少,說明大鼠在第14~21天發生了遲發型腦病導致的記憶認知功能損傷。因此我們通過水迷宮實驗和海馬組織學分析篩選出在急性CO中毒后出現了遲發型腦病的大鼠用于實驗研究是有效的。
美國學者在研究中發現CO中毒后,腦內自由基生成增加可引起脂質過氧化,導致腦內MBP的改變[8]。MBP作為髓鞘中抗原活性最強的蛋白質,位于髓鞘漿膜面,能夠維持髓鞘結構和功能的穩定[9]。當中樞神經系統遭受損傷時,髓鞘受到破壞,血腦屏障及通透性改變,可造成MBP在血清中濃度增高[10]。研究表明,MBP在腦損傷、脫髓鞘疾病、缺血性腦血管病、神經退行性疾病及慢性神經性疼痛疾病中廣泛存在,可作為神經系統相關性損傷標志物[11,12]。本文實驗結果可以看出,急性CO中毒后血清MBP明顯增加,說明在CO中毒后大鼠存在脫髓鞘改變,發生了MBP的降解,導致血清MBP濃度的增加,進一步證明MBP可能參與了急性CO中毒后遲發性腦病的發病過程。而MPO作為一種獨立于其他炎癥因子的一種新的炎癥因子,與人類多種疾病的發生、發展密切相關,是炎癥和氧化應激的標志物[13]。MPO能通過氧化作用產生的自由基,造成與神經元損傷,因其水平與中性粒細胞的活化密切相關,可作為中性粒細胞功能和活化的標志[14]。本研究表明急性CO中毒后可能出現逐漸加重的炎癥反應,MPO增高可能激活中性粒細胞并引發炎性反應,限制紅細胞中的氧轉運,導致組織缺氧,進一步出現遲發型腦病。
近年來很多實驗發現雌激素在腦外傷、卒中、神經變性疾病中發揮重要的保護作用[15]。其能透過血腦屏障,聚集在腦組織的不同部位,如皮質及海馬區、下丘腦等,與細胞內受體結合,通過抑制細胞凋亡、抗氧化應激、抗炎、加速病理性蛋白的清除起到神經保護以及提高認知的目的[16]。人體雌激素有三種類型,17-β雌二醇(17-βestradio,17-βE2)、雌酮(Estrone)和代謝產物雌三醇(estriol),其中17-β雌二醇生物效能最強。因此在我們實驗中選擇17-βE2治療CO中毒大鼠,并評估其療效。實驗結果顯示與CO中毒組相比,雌激素治療組大鼠在中毒后7天和14天的逃避潛伏期明顯縮短,在空間探索實驗中,在第21天時穿過平臺次數明顯增多。在HE染色結果中,雌激素治療組在各時間點海馬組織水腫和神經元細胞壞死減輕,正常神經元細胞數目增多。而在對血清MBP、MPO測定結果中顯示,雌激素治療組各時間點MBP水平明顯于低于CO組。與CO中毒組相比,雌激素組MPO水平在第14天也明顯減少。說明大鼠發生急性CO中毒后,出現脫髓鞘改變、免疫炎癥反應等,而雌激素雌激素可通過多種途徑改善代謝,減輕氧化應激誘導的免疫炎癥反應損傷,有效保護神經細胞和組織。
本實驗中,CO中毒后,MBP及MPO的表達均明顯增加,而在使用雌激素治療后MBP及MPO的表達減少。雌激素可能通過抑制CO中毒大鼠后MBP、MPO的表達,阻斷中性粒細胞的活化和炎癥反應介導的神經損傷,減少細胞壞死,減輕脫髓鞘損傷,維持髓鞘結構和功能的穩定,一定程度上阻斷了遲發型腦病的發生,從而起到保護作用。但目前其具體發病機制尚不明確,還需進一步實驗研究。

