影像組學評估乳腺增強MRI非腫塊型強化惡性風險的價值
單嫣娜,沈起鈞,徐 雯,王 煒,項晶晶
(浙江大學醫學院附屬杭州市第一人民醫院 1.放射科;2.超聲影像科;3.病理科,浙江 杭州 310006)
約57%無法觸及的浸潤性乳腺癌MRI表現為非腫塊型強化(non-mass enhancement, NME)[1-2],而乳腺導管內惡性病變、纖維囊性腺病、炎癥等良性病變和正常乳腺實質不對稱背景強化均可表現為NME[3]。目前美國放射學院(Breast Imaging Reporting and Data System,BI-RADS)分類標準對NME良惡性的判斷有效性欠佳[4-5]。影像組學方法采用數據特征化算法將醫學灰度圖像轉化為可挖掘的特征空間數據,量化病灶形態學特征及內部的異質性[6-7]。本研究旨在通過對乳腺NME進行影像組學分析,尋找評估NME風險的定量參數,構建預測模型,以期提高NME風險評估的準確性及客觀性、指導臨床診療決策。
1 資料與方法
1.1 一般資料 回顧性分析浙江大學醫學院附屬杭州市第一人民醫院2017年1月—2018年12月乳腺增強MRI圖像,根據2013年美國放射學院第5版BI-RADS分類對乳腺MRI的NME定義[8]共收集NME患者106例。排除MRI檢查后失訪患者,有同側乳房穿刺、手術史患者,同側乳房隆胸術后患者,最終納入乳腺NME患者62例。超聲引導下粗針穿刺或外科手術切除病理結果為惡性或不典型增生患者歸入高風險組,病理結果為良性或對照2年前乳腺增強MRI結果基本穩定/退縮的患者歸入低風險組。超聲引導下粗針穿刺或外科手術均在完成乳腺MRI檢查兩周內進行。本研究經醫院倫理委員會批準。
1.2 MRI檢查 設備及研究序列掃描技術采用Siemens Verio 3.0T超導型全身磁共振掃描系統,8通道專用乳腺表面線圈。患者俯臥位,雙側乳腺自然懸垂于線圈內。對比劑采用釓噴酸葡胺注射液(Gd-DTPA),劑量0.1 mmol/kg,以2.0 mL/s速度注入肘前靜脈,再以相同流速注射生理鹽水15 mL。增強序列采用橫斷位T1WI三維小角度激發梯度回波序列(T1WI_FLAIR_3D)進行動態增強掃描(TR/TE:4.51 ms/1.61 ms,翻轉角度:10°,層厚:1.0 mm,層間距:0 mm,FOV:340×340,矩陣:420×420,增強前掃描1次,開始注入對比劑25 s后連續掃描6次,每次掃描時間為58 s)。
1.3 圖像評估 在注入對比劑后的第2次掃描序列,從乳腺背景強化中對乳腺NME進行識別,并勾勒感興趣區(region of interest,ROI)。使用ITK-SNAP (Version 3.6)軟件,基于像素點沿NME主體內緣手工逐層勾勒ROI,并融合保存成一個3D圖像,見圖1。勾勒者對臨床及病理結果采取盲法。隨機抽取30個病例,分別由一名有3年工作經驗的住院醫師和一名有15年工作經驗的副主任醫師勾勒ROI,并進行組間一致性分析。

A:從橫斷面基于像素沿NME病灶內緣勾勒感興趣區;B:從矢狀面基于像素沿NME病灶內緣勾勒感興趣區;C:從冠狀面基于像素沿NME病灶內緣勾勒感興趣區;D:各層感興趣區融合后的NME三維立體圖像。圖1 乳腺MRI非腫塊型強化感興趣區勾勒及三維融合圖像
1.4 影像組學特征提取和分析 每個病例的MRI增強圖像及對應的ROI 3D圖像批量導入Artificial Intelligent Kit(AK)軟件(GE healthcare,美國),定量計算6類影像組學特征,包括直方圖參數(histogram parameters)、形態學參數(form factor parameters)、紋理特征參數(texture parameters)、灰度共生矩陣參數(gray level co-occurrence matrix parameters, GLCM)、游程矩陣參數(run-length matrix parameters, RLM)、灰度區域大小矩陣參數(grey level zone size matrix parameters, GLSZM)。①數據預處理:AK軟件提取的影像組學特征數據中的異常值使用中位數替代。通過分層抽樣的方法將兩組病例分為訓練集及驗證集,并對數據進行標準化處理。②特征降維選擇:在訓練集中通過單因素方差分析和Wilcoxon秩和檢驗(ANOVA+MW)、相關性檢驗(Spearman相關系數0.9)、Lasso算法對特征進行降維選擇。③對降維選擇所得的具有統計學意義的特征參數進行受試者工作特征曲線(receiver operating characteristic curve, ROC)分析,評估各參數在訓練集判斷非腫塊強化病灶性質的診斷效能。④使用訓練集數據建立二分類多因素Logistic 回歸分析預測模型,通過混淆矩陣的方法對驗證集進行驗證,采用ROC分析評價模型的診斷效能,并計算特異度和敏感度。
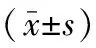
2 結果
2.2 一致性分析 像素灰度范圍(Range)、和均值(sumAverage)、集群突出(ClusterProminence_angle45_offset4)、灰度共生矩陣能量(GLCMEnergy_AllDirection_offset7)、灰度共生矩陣熵(GLCMEntropy_angle135_offset)、長行程高灰度優勢(LongRunHighGreyLevelEmphasis_angle45_offset7)、最大直徑(Maximum3DDiameter)、緊致性(Compactness)參數ICC均>0.75,見表1。

表1 MRI影像組學特征一致性分析
2.3 訓練集影像組學特征比較 62例患者通過分層抽樣法分為訓練集46例和驗證集16例,其中訓練集低風險組20例,高風險組26例。應用AK軟件計算得到訓練集396個影像組學參數,降維選擇后得到具有統計學意義的參數8個,分別是:(1)直方圖參數:特征1-Range;(2)灰度共生矩陣參數:特征2-sumAverage、特征3-ClusterProminence_angle45_offset4、特征4-GLCMEnergy_AllDirection_offset7及特征5-GLCMEntropy_angle135_offset;(3)游程矩陣參數:特征6-LongRunHighGreyLevelEmphasis_angle45_offset7;(4)形態學參數:特征7-Maximum3DDiameter、特征8-Compactness;見表2。

表2 訓練集NME影像組學特征比較
注:特征1:Range;特征2:sumAverage;特征3:ClusterProminence_angle45_offset4;特征4:GLCMEnergy_AllDirection_offset7;特征5:GLCMEntropy_angle135_offset;特征6:LongRunHighGreyLevelEmphasis_angle45_offset7;特征7:Maximum3DDiameter;特征8:Compactness;下同。
2.4 ROC曲線分析 ROC曲線分析評估8個影像組學特征參數預測高風險NME的效能,特征8-Compactness的ROC下面積最大(0.876),特征6-LongRunHighGreyLevelEmphasis_angle45_offset7的敏感性最高(88.5%),特征5-GLCMEntropy_angle135_offset的特異性最高(95.0%),見表3。
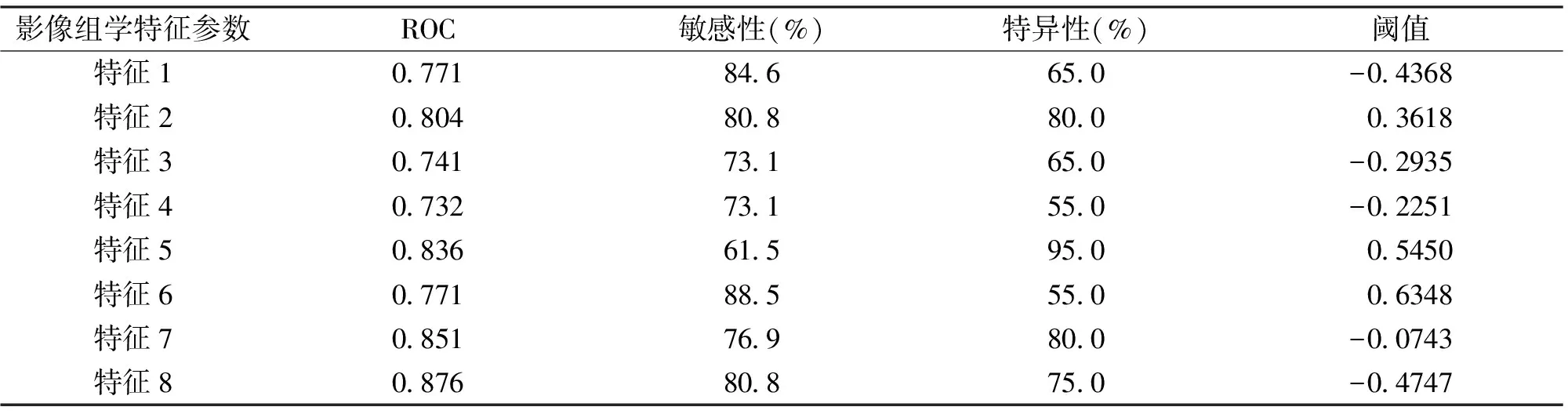
表3 影像組學特征預測高風險NME的效能
2.5 高風險NME預測模型構建 基于降維選擇所得8個影像組學特征,經二分類Logistic 回歸分析構建高風險NME預測模型,回歸方程為Logit(P)= 0.984+0.248特征1+3.288特征2+1.237特征3-0.809特征4+0.156特征5-3.136特征6+3.994特征7-0.224特征8,對上述方程進行似然比檢驗,χ2=37.298,P<0.001。該模型預測高風險NME的ROC下面積、敏感度、特異度、準確度分別為0.942、88.7%、85.0%、83.3%。通過混淆矩陣對驗證集進行驗證,得到ROC下面積、敏感度、特異度、準確度分別為0.794、77.8%、85.7%、81.3%。
3 討論
本研究中的低風險組NME以乳腺腺病為主,病理特點是乳腺腺體呈病理性增加,但保持上皮和肌上皮成分正常排列結構,其中硬化性腺病伴有間質增生,使腺體擠壓變形;導管內乳頭狀瘤及纖維腺瘤等良性腫瘤細胞成分排列結構相對單一,出血壞死少見。高風險組NME以導管原位癌及浸潤性導管癌為主,腫瘤細胞排列方式多樣,壞死、鈣化常見,并伴有異常腫瘤血管增生[9-10]。病理學差異使低風險組與高風險組NME在MRI增強掃描的強化方式、強化程度存在差異。NME是乳腺增強MRI內除灶點狀及腫塊型強化以外的異常強化,不具有空間占位效應。既往文獻基于NME的分布及強化方式,對乳腺NME良惡性進行定性或半定量分析,但結果存在一定差異[11-14]。Shao等[15]meta分析顯示,增強MRI診斷惡性NME的合并加權估計敏感度為50% (95%CI: 46%53%) 、特異度為 80% (95%CI: 77%83%),部分良性與惡性NME病灶在分布、強化方式上存在重疊[16]。
本研究共提取8個影像組學特征用以評估NME的惡性風險。直方圖特征考察病灶部位灰度強度信息的整體分布情況。Range表示病灶內像素灰度值的差距,Range值與病灶的異質性呈正比。灰度共生矩陣參數及游程矩陣參數具有方向性,反映圖像中不同灰度像素分布的相似性、對稱性以及各像素之間的空間位置關系。sumAverage是圖像區域內像素點平均灰度值的度量,反映圖像整體色調的明暗。ClusterProminence值越大表示圖像灰度峰值越高、像素之間灰度差別越大,對稱性越差。GLCMEnergy描述圖像灰度強度變化的劇烈程度,GLCMEnergy值越大,變化越小。GLCMEntropy衡量圖像中像素灰度強度分布的復雜程度,GLCMEntropy值越大,圖像越復雜。游程矩陣參數LongRunHighGreyLevelEmphasis值越大,圖像灰度整體越偏高、紋理越光滑。病灶異質性與ClusterProminence、GLCMEntropy的值呈正比,與sumAverage、GLCMEnergy、LongRunHighGreyLevelEmphasis的值呈反比。本研究結果顯示,以上特征參數值在低風險組與高風險組NME中的差異符合上述規律。形態學參數Maximum3DDiameter及Compactness提示低風險組NME病灶分布的形態更趨向于局灶、區域性,而高風險組NME病灶分布的范圍相對更廣,比如段樣、彌漫性分布,與Aydin[11]研究結果一致。基于上述參數構建評估NME高風險的預測模型,訓練集準確度為83.3%,經驗證集驗證該模型準確度為81.3%,提示該模型對NME的惡性風險具有一定的預測價值。
本研究采用2名有工作經驗差距的影像診斷醫師獨立診斷,結果顯示,手工提取ROI的影像組學特征各參數ICC均>0.75,提示影像組學能夠量化圖像信息,識別肉眼無法識別的灰度空間差異,客觀評估NME的異質性,減少觀察者的主觀性影響。目前臨床對乳腺NME惡性風險的評估以及對病灶穿刺、定位的選擇主要依賴醫生的個人主觀經驗。部分NME由于普通超聲無法識別,需要進行MRI引導下或MRI虛擬導航超聲引導下進行穿刺定位。上述兩種方法價格昂貴、操作過程復雜,只有少數醫院擁有相應設備和技術。本研究建立的高風險NME預測模型通過影像組學無創地對乳腺NME進行三維立體分析及風險預測,為臨床處理乳腺NME提供決策依據。對于風險較低的患者可以減少或避免不必要的穿刺,可進行定期隨訪,一定程度上緩解患者的焦慮情緒;對風險較高的患者則應積極明確病理性質。
綜上所述,影像組學分析能定量客觀評估乳腺增強MRI圖像中NME內部的異質性,對NME惡性風險做出預測,為臨床處理乳腺NME提供決策依據。后續還需進行多型號MRI掃描、大樣本量、多中心研究的進一步驗證。

