備受高考命題青睞的氧族物質
北京
由于氧族元素組成的化合物種類多,化學性質活潑,應用的范圍廣,因此一直受高考命題的青睞,尤其是O3、H2O2、H2S、Na2S2O3等物質一直穿插在高考題中,因此氧族元素及其代表物應引起教師足夠的重視。因為這些物質能穿插在各個知識模塊中,充分體現學生運用知識解決實際問題的能力,同時還能培養學生的“科學探究與創新意識”“變化觀點與平衡思想”以及“科學態度與社會責任”的學科核心素養。因此在教學中要注意知識的寬度和深度,這樣才能贏得新高考,符合教育改革的發展方向。
一、臭氧
臭氧因其具有一種特殊的腥臭味而得名,液態臭氧呈藍紫色。
1.不穩定性

2.強氧化性



(3)能殺滅細菌,可用作消毒殺菌劑
由于臭氧具有強氧化性,在工業生產中廣泛應用于水處理系統,此應用體現了“科學態度與社會責任”的學科素養。化學知識以“散”著稱,在教學中要靈活運用生活實例來幫助學生復習化學知識。
【例1】臭氧是常見的強氧化劑,廣泛用于水處理系統。制取臭氧的方法很多,其中高壓放電法和電解純水法原理如圖所示,下列有關說法不正確的是
( )


B.高壓放電出來的空氣中,除含臭氧外還含有氮的氧化物
C.電解時,H+由電極a經聚合固體電解質膜流向電極b

【答案】C

二、過氧化氫
過氧化氫(H2O2)是一種淡藍色的黏稠液體,熔點為-0.43℃,沸點為150.2℃,可以與水任意比例混合,常用的H2O2水溶液有含H2O2質量分數為3%,在醫藥上稱為雙氧水,具有消毒殺菌的作用。
1.化學性質
(1)不穩定性

(2)強氧化性

②油畫中鉛白(堿式碳酸鉛)會與空氣中的硫化氫反應生成黑色硫化鉛,可用過氧化氫洗滌(需堿性介質)。
(3)還原性


(4)弱酸性
2.過氧化氫的制備
(1)實驗室制法

(2)工業制法


由于過氧化氫性質活潑,能與多種物質發生化學反應,尤其是涉及氧化還原反應的實驗更離不開雙氧水,培養學生運用知識解決實際問題的能力,同時還能培養學生的“科學探究與創新意識”化學學科核心素養。在當前深化教育改革的大環境下,要帶領學生親自到實驗室里去,讓學生親身感受“科學探究與創新意識”,只有這樣身臨其境,在考試中遇到實驗探究題才能做到以不變應萬變。
【例2】某小組同學設計如下實驗,研究亞鐵鹽與H2O2溶液的反應。
【實驗Ⅰ】試劑:酸化的0.5 mol·L-1FeSO4溶液(pH=0.2),5% H2O2溶液(pH=5)。

操作現象取2 mL上述FeSO4溶液于試管中,加入5滴5% H2O2溶液溶液立即變為棕黃色,稍后,產生氣泡,測得反應后溶液pH=0.9向反應后的溶液中加入KSCN溶液溶液變紅
(1)上述實驗中H2O2溶液與FeSO4溶液反應的離子方程式是____________________。
(2)產生氣泡的原因是____________________。
【實驗Ⅱ】試劑:未酸化的0.5 mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)。

操作現象取2 mL 5% H2O2溶液于試管中,加入5滴上述FeSO4溶液溶液立即變為棕黃色,產生大量氣泡,并放熱,反應混合物顏色加深且有渾濁,測得反應后溶液pH=1.4

(4)對于生成紅褐色膠體的原因,提出兩種假設:
A.H2O2溶液氧化Fe2+消耗H+
B.Fe2+氧化的產物發生了水解
①根據實驗Ⅱ記錄否定假設A,理由是。
②實驗驗證假B:取________,加熱,溶液變為紅褐色,pH下降,證明假設B成立。
(5)將FeSO4溶液加入H2O2溶液后,產生紅褐色膠體,反應的離子方程式是____________________。
【實驗Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作與實驗Ⅱ相同,除了產生與Ⅱ相同的現象外,還生成刺激性氣味氣體,該氣體能使濕潤的藍色石蕊試紙變紅但不褪色。
(6)產生刺激性氣味氣體的原因是。
(7)由實驗Ⅰ、Ⅱ、Ⅲ可知,亞鐵鹽與H2O2反應的現象與(至少寫兩點)有關。

(2)在Fe3+催化下H2O2分解生成O2
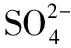
(4)①反應后溶液的pH降低 ②Fe2(SO4)3溶液

(6)H2O2分解反應放熱,促進Fe3+的水解平衡正向移動,產生的HCl受熱揮發
(7)pH、陰離子種類、溫度、反應物用量

三、硫化氫(H2S)
硫化氫通常是一種無色、易燃、有臭雞蛋氣味的氣體,有毒,空氣中含有體積分數為0.1%的H2S會引起頭痛暈眩等癥狀,吸入大量H2S會造成昏迷或死亡。
1.化學性質
(1)不穩定性
(2)弱酸性

(3)可燃性

(4)還原性

(5)沉淀反應

2.制備方法

硫化氫的性質很活潑,能與很多物質發生化學反應,并且在工農業生產中有很廣泛的用途。在很多知識模塊中都能見到硫化氫這種物質,因此在教學中要注意知識的橫向聯系,望廣大教師給予足夠的重視。
【例3】H2S存在于多種燃氣中,脫除燃氣中H2S的方法很多。
(1)2019年3月sciencedirect介紹的化學鏈技術脫除H2S的原理如圖所示。

①“H2S氧化”反應中氧化劑與還原劑的物質的量之比為________。
②“HI分解”時,每1 mol HI分解生成碘蒸氣和氫氣時,吸收13 kJ的熱量,寫出該反應的熱化學方程式:____________________。
③“Bunsen反應”的離子方程式為____________________。
(2)電化學干法氧化法脫除H2S的原理如圖所示。陽極發生的電極反應為________;陰極上COS發生的電極反應為________。

(3)用Fe2(SO4)3吸收液脫除H2S法包含的反應如下:



一定條件下測得脫硫率與Fe3+濃度的關系如圖所示。

①吸收液經過濾出S后,濾液需進行再生,較經濟的再生方法是____________________。
②圖中當Fe3+的濃度大于10 g·L-1時,濃度越大,脫硫率越低,這是由于____________________。


(3)①通入足量O2(或空氣) ②Fe3+濃度增大,pH減小,使反應(Ⅰ)、(Ⅱ)向逆反應方向移動且pH減小因素超過反應(Ⅲ)Fe3+濃度增大因素

四、硫代硫酸鈉(Na2S2O3)
Na2S2O3·5H2O俗名大蘇打,它是無色透明的晶體,易溶于水,溶于水后呈堿性。
1.化學性質

(2)Na2S2O3是中等強度的還原劑,能被I2、Cl2、KMnO4等氧化劑氧化。



2.Na2S2O3的制備
將Na2S和Na2CO3以2∶1的物質的量比配成溶液,然后通入SO2,反應大致可分三步進行:




溶液蒸發濃縮后,冷卻至293~303 K時即析出Na2S2O3·5H2O,用上述方法制得的Na2S2O3中常含有Na2SO4和Na2SO3等雜質。

硫代硫酸鈉在工農業生產上具有很重要的作用,經常以實驗題的形式考查硫代硫酸鈉的性質,以培養學生運用知識解決實際問題的能力,同時還能培養學生的“科學探究與創新意識”化學學科核心素養。硫代硫酸鈉的考題比較多,在教學中我們可以選擇一些經典的實驗作為案例,讓學生走進實驗室親身感受“科學探究與創新意識”的理念和化學的魅力所在。
【例4】硫代硫酸鈉的部分性質和數據如下表:

熔點/℃沸點/℃性質48100①強還原性;②水溶液中,H2S2O3分解生成S和SO2
如圖是制備硫代硫酸鈉的裝置,回答下列問題:

(1)儀器a中的80%的硫酸不能用濃硫酸代替,原因是____________________。
(2)儀器b的名稱是__________,裝置乙中在實驗中的作用是________________。裝置乙的三頸燒瓶中盛裝的液體可以是________(填序號)。
A.濃硫酸 B.蒸餾水 C.CCl4D.NaOH溶液
(3)裝置丙的三頸燒瓶中盛有Na2S和Na2SO3溶液(后者稍微過量)。
①裝置丙中發生反應的離子方程式是____________________。
②制備過程中,裝置丙中的液體要保持堿性環境,結合離子方程式解釋其原因____________________。
③測得該制備方法制備的目標產品中含有Na2SO4,可能的原因是____________________。
(4)指出該實驗裝置存在的缺點及改正方法:____________________。
【答案】(1)濃硫酸不能電離出氫離子,無法與亞硫酸鈉反應
(2)長頸漏斗 保持裝置恒壓、觀察產生二氧化硫的速率 AC

(4)無尾氣處理裝置,裝置丙中的尾氣通入堿液中

總之,由于氧族元素組成的物質性質活潑,很多物質在工農業生產中具有很重要的用途,因此也是考試命題的熱點之一,幾乎每年高考都能見到氧族元素的身影,如2019年全國卷Ⅰ第27題考查硫化物及雙氧水、全國卷Ⅱ第10題C選項考查硫代硫酸鈉、26題(3)考查硫代硫酸鈉滴定、北京卷第26題考查處理廢水中的苯酚含量也是用硫代硫酸鈉做滴定液、第28題考查SO2的性質;2018年全國卷Ⅰ第27題考查的焦亞硫酸鈉,全國卷Ⅲ第26題考查硫代硫酸鈉晶體,北京卷第27題考查硫的循環等等,因此對氧族元素及其物質復習時,要注意知識的深度、寬度,并且還要把知識橫向聯系起來,形成知識網,以局部帶動整體的復習策略,提高學生的運用知識解決實際問題的能力。
——硫代硫酸鈉

