化學與數學的有效碰撞——以函數表征平衡常數為例
云南
本文以函數表征平衡常數為例,介紹了以反比例函數、一次函數為載體表征化學平衡常數表達式中化學量的關系,以及用平衡常數表達式推導反比例函數型和一次函數型平衡圖象,旨在促進學生對反比例函數型、一次函數型平衡圖象的本質和平衡常數表達式的理解,由此通過化學與數學的有效碰撞,有效提高學生解題的速率和正確率,促進學生推理、遷移、分析能力的提升。
縱覽近幾年高考化學試題,考查平衡常數時,經常以反比例函數和一次函數為載體的圖象形式來表征,是近年高考熱衷的重難點之一,題目綜合性、靈活性、直觀性、技巧性較強,為把握這類題的解題策略和命題方向,可通過化學與數學的有效碰撞,筆者從二者互推加以研究,以期達到透過平衡常數繪圖象,結合圖象看平衡常數,使學生見圖不畏,觀平衡常數現圖象,得心應手,結合實例分析如下。
一、以反比例函數為載體
1.透過平衡常數繪圖象
先寫出離子積、電離平衡常數、水解平衡常數、溶度積等的表達式,根據反比例函數定義,結合合適的平衡常數表達式選擇自變量和因變量構建反比例函數。
【例1】用反比例函數圖象表征一定溫度下Na2CO3溶液中中關于水解平衡常數表達式中相關量。



圖1
總之,函數圖象的自主構建關鍵是結合平衡常數表達式選擇合適的自變量和因變量,使其滿足反比例函數定義即可,如氫氟酸的電離平衡常數為Ka=c(H+)·c(F-),若自變量為c(H+)則因變量為c(F-),若自變量為c(F-)則因變量為c(H+)。
2.結合圖象看平衡常數
先看圖形中橫縱坐標的含義,然后再對照相應的平衡常數表達式,找出相關關系式。
【例2】如圖2所示是碳酸鈣(CaCO3)在25℃和100℃兩種情況下,在水中的溶解平衡曲線。下列有關說法正確的是
( )

圖2
B.a、b、c、d四點對應的溶度積Ksp相等
C.溫度不變,蒸發水,可使溶液由a點變到c點
D.25℃時,CaCO3的Ksp=2.8×10-9
【答案】D


( )

圖3
A.T℃時,該反應的平衡常數值為4
B.c點沒有達到平衡,此時反應逆向進行
C.若c點為平衡點,則此時容器內的溫度高于T℃
D.T℃時,直線cd上的點均為平衡狀態
【答案】C

二、以一次函數為載體
一次函數表達式:y=kx+b(k,b是常數,k≠0)。這類題一般有兩種來源,第一種在離子積、電離平衡常數、水解平衡常數、溶度積等的表達式的基礎上直接變形而來;第二種由在離子積、電離平衡常數、水解平衡常數、溶度積等的表達式的兩側同時取對數值再適當變化而來。
1.透過平衡常數繪圖象

【例4】用一次函數圖象表征某溫度下Na2CO3溶液中關于水解平衡常數表達式中相關量。
【解析】Na2CO3溶液中水解方程式為
①對水解平衡常數等式兩側同時取對數計算得

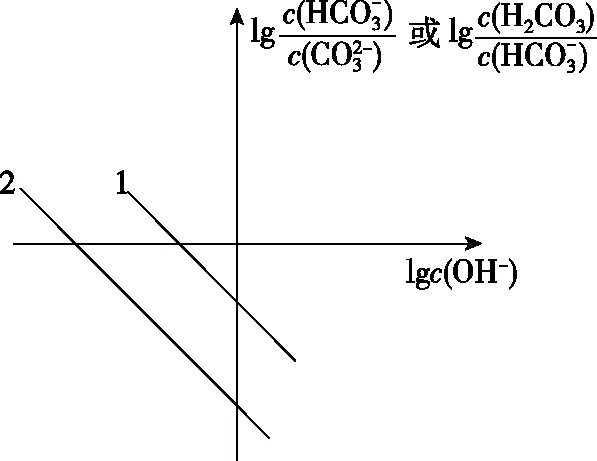
圖4
②對水解平衡常數等式兩側同時取負對數計算得


圖5

【例5】用一次函數圖象表征某溫度下Fe(OH)3懸濁液中關于溶度積表達式中相關量。

①對溶度積等式兩側同時取對數計算得
lgKsp=lg[c(Fe3+)·c3(OH-)],
lgKsp=lgc(Fe3+)+lgc3(OH-),
lgKsp=lgc(Fe3+)+3lgc(OH-),
則若以lgc(Fe3+)為縱坐標、lgc(OH-)為橫坐標的關系符合一次函數,函數圖象如圖7所示。

圖7
②對溶度積等式兩側同時取負對數計算得
lgKsp=-lg[c(Fe3+)·c3(OH-)],
lgKsp=-lgc(Fe3+)-lgc3(OH-),
lgKsp=-lgc(Fe3+)-3lgc(OH-),
則若以-lgc(Fe3+)為縱坐標、-lgc(OH-)為橫坐標的關系符合一次函數,函數圖象如圖8所示。

圖8
總之,繪制圖象其他類型的推導根據情況以此類推(可以自由規定橫縱坐標)。
2.結合圖象看平衡常數
先看圖形中橫縱坐標的含義,然后再對照相應的平衡常數表達式,找出相關關系式。
【例6】(2017·全國卷Ⅰ·13)常溫下將NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖9所示。下列敘述錯誤的是
( )

圖9
A.Ka2(H2X)的數量級為10-6
C.NaHX溶液中c(H+)>c(OH-)
D.當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】D
【解析】H2X電離方程式為






三、總結
近幾年對平衡常數考查方式靈活多變,既是重點難點也是考查熱點。通過二者的互推,可以實現化學與數學的有效碰撞,進而“見平衡常數繪圖”和“看圖識平衡常數”,達到“平衡常數有圖”和“圖中有平衡常數”,加強學生對平衡常數和圖形的認識以及理解,提高學生的讀圖、識圖、繪圖能力,提升這類題的正確率和速率。以期促進學生融會貫通,提高分析、推理能力,促進學生化學學科核心素養的形成。

