基于思維模型結構的氧化還原反應方程式書寫策略——以2019年全國卷高考試題為例
湖北
縱觀歷年高考化學方程式或離子方程式的書寫,絕大多數都是以陌生情景中氧化還原反應方程式的書寫作為考查的重點。高考命題者如此青睞氧化還原反應,不僅僅是因為氧化還原反應作為高中必備的核心知識必須加以考查,而且氧化還原反應還蘊含豐富的學科思想方法,承載學科的核心能力——學生靈活運用已有知識解決陌生情景中實際問題的能力,體現了化學學科核心素養“宏觀辨識與微觀探析”“證據推理與模型認知”的考查意圖。加之這樣的試題具有一定的難度和很強的區分度,因而是高考中必不可少的一道化學大餐。用心咀嚼,細細品味,給人以回味無窮之感。下面筆者以2019年全國高考化學試題為例談談有關陌生情景中氧化還原反應方程式的書寫策略,從中感悟規律,悟法開竅,希望能對2020屆高三學生有所裨益。
一、正確認識氧化還原反應的思維模型是解題的關鍵
1.氧化還原反應的思維模型

圖1 氧化還原反應的一般思維模型圖
在此一般思維模型中,氧化還原反應蘊含著化學眾多的學科思想方法:認識物質性質及轉化關系的思路方法——物質轉化的一般規律;氧化性和還原性的強弱規律;化合價升降守恒規律;得失電子守恒規律;離子反應所遵循的電荷守恒規律;質量守恒定律(原子守恒、元素守恒、物料守恒)等等。
2.氧化還原反應的學科價值
氧化還原反應的學習體現了學科的價值,主要體現在:
從轉化的視角看,認識元素在物質中可以具有不同價態,可通過氧化還原反應實現含有不同價態元素的物質的相互轉化。
從分類的視角看,學生能夠建立對化學反應分類的新視角,特別是形成化學反應認識的新視角,能夠更全面地認識物質性質和轉化;
從思維的視角看,學生對于相關的實際現象和問題的解釋分析能力將得到進一步的提高,使認識思維從低階向高階發展;
從應用的視角看,作為工具建構原電池和電解池裝置,用于分析電池的形成,凸顯學科教學的應用價值;
從辯證的視角看,氧化反應和還原反應作為對立的統一體,從電子的失和得、化合價的升和降、反應物的氧化性和還原性、氧化產物和還原產物,全面揭示了物質的對立統一規律。
二、從物質類別和元素價態變化的視角認識物質的轉化路徑
結合物質類別和元素價態兩個角度,依據氧化還原反應原理,預測物質的化學性質和變化,建立認識物質轉化的二維模型,重點關注元素化合價變化。以“氧化還原”視角再認識物質的轉化,幫助學生形成全面的認識物質性質和轉化的“元素化合價-物質類別二維模型”(如圖2所示)。
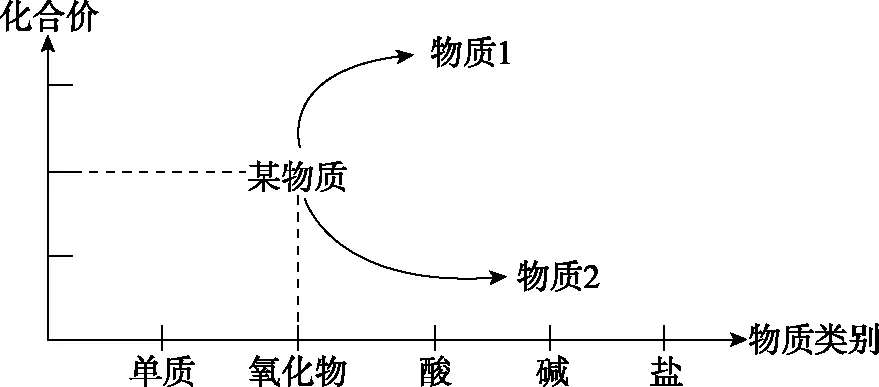
圖2 元素化合價-物質類別二維模型圖
該“元素化合價-物質類別二維模型圖”(簡稱“價-類模型”)是在氧化還原反應一般思維模型的基礎上,從物質分類與元素化合價的視角給學生以直觀明晰的思維結構:
(1)確定某物質及其化合價所處的位置,以此來判斷該物質具有的性質(氧化性、還原性)。
(2)明確發生氧化反應或還原反應之后,該物質中核心元素的化合價變化,并且通過箭頭指向來表達反應的過程(找到反應物和生成物),同時能夠看到物質之間轉化的多種途徑。
(3)通過化合價所處的位置,掌握該物質具有的類別通性。
三、梳理常見物質的轉化是書寫氧化還原反應方程式的必備工具
從高中教材及高考試題中梳理常見物質及其轉化關系,是高中學生必備的基礎性工具知識,因此,學生應熟記常見的氧化劑和還原劑并判斷還原產物和氧化產物。
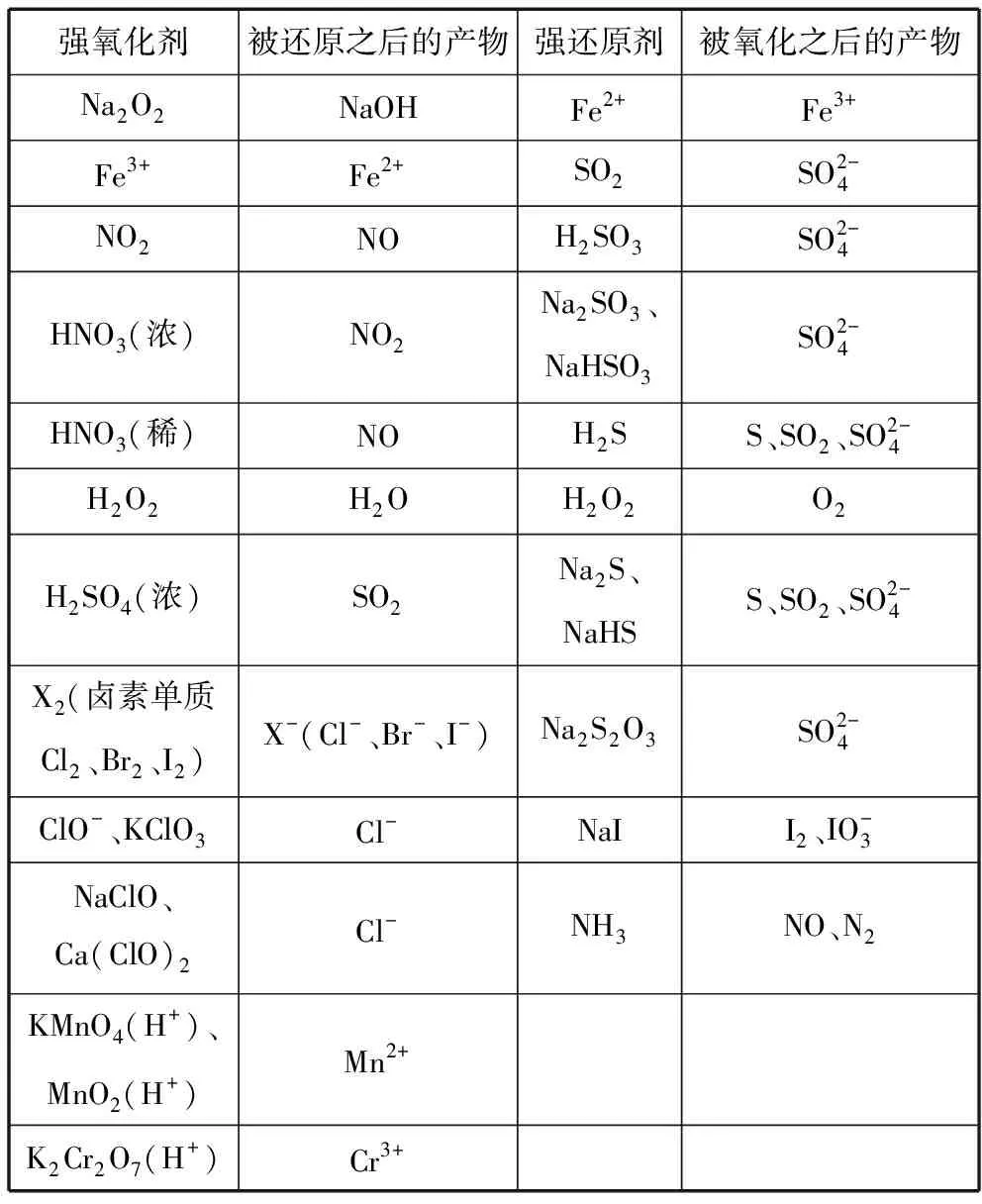
強氧化劑被還原之后的產物強還原劑被氧化之后的產物Na2O2NaOHFe2+Fe3+Fe3+Fe2+SO2SO2-4NO2NOH2SO3SO2-4HNO3(濃)NO2Na2SO3、NaHSO3SO2-4HNO3(稀)NOH2SS、SO2、SO2-4H2O2H2OH2O2O2H2SO4(濃)SO2Na2S、NaHSS、SO2、SO2-4X2(鹵素單質Cl2、Br2、I2)X-(Cl-、Br-、I-)Na2S2O3SO2-4ClO-、KClO3Cl-NaII2、IO-3NaClO、Ca(ClO)2Cl-NH3NO、N2KMnO4(H+)、MnO2(H+)Mn2+K2Cr2O7(H+)Cr3+
學生可結合上表中物質的轉化(或離子的轉化),依據“價-類二維模型”,感悟其分析問題的一般方法。常見的鐵及其化合物之間的相互轉化關系如下:
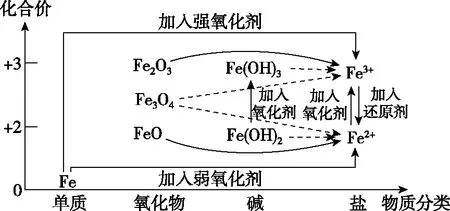
圖3 鐵及其化合物的價-類二維圖
四、掌握有序書寫信息型氧化還原反應方程式的一般步驟
第1步:找出發生氧化還原反應的粒子。根據元素價態和氧化還原順序規律確定氧化劑和還原劑。
第2步:合理地預測產物。根據化合價規律及題給信息和已知元素化合物性質確定相應的還原產物、氧化產物。
第3步:配電子。即轉移電子數守恒。根據化合價升降總數相等確定發生氧化還原反應轉移的電子總數也應相等,確定氧化劑、還原劑、氧化產物和還原產物的化學計量數。
第4步:配電荷。即方程式兩邊電荷守恒。根據溶液的酸堿性,通過在反應方程式的兩端添加H+或OH-的形式使方程式兩端的電荷守恒。
第5步:配原子。即遵守質量守恒定律,方程式左右兩邊各種元素的原子數守恒。根據原子守恒,通過在反應方程式兩端“補缺”H+、OH-和H2O(或其他小分子、離子)使方程式兩端的原子守恒。其“補缺”技巧:
H+→H2O(酸性)、OH-→H2O(堿性);
H2O→H+(中性或酸性)、H2O→OH-(中性或堿性)。
五、例析2019年高考陌生情景氧化還原反應方程式的書寫
(一)典例剖析
【例題】(2019·全國卷Ⅲ·26改編)高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝如下圖所示。回答下列問題:
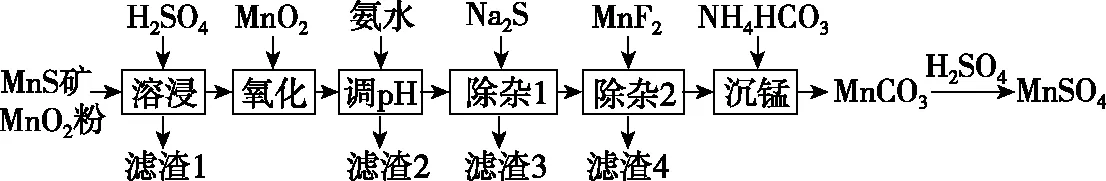
(1)“濾渣1”含有S和________;寫出“溶浸”中二氧化錳與硫化錳反應的離子方程式:____________________。
(2)“氧化”中添加適量的MnO2的作用是___________________。

(2)將Fe2+氧化為Fe3+
【命題意圖】本題以工業上制備高純硫酸錳的工藝流程圖作為載體,考查元素化合物間的相互轉化與物質的分離提純,重點考查了陌生情景下氧化還原反應方程式的書寫。其情景素材來源于科學研究的成果《二氧化錳和硫化錳兩礦法制備高純硫酸錳》(劉清華著),試題中的工藝流程進行了簡化和改進。
【思路分析】硫化錳礦中的Si元素主要以SiO2或不溶性硅酸鹽存在,SiO2與硫酸不反應,所以濾渣1中除了S還有SiO2;在硫酸的溶浸過程中,二氧化錳和硫化錳發生了氧化還原反應,二氧化錳作氧化劑,硫化錳作還原劑。運用“價-類二維模型”來分析反應物MnO2和MnS反應的產物:
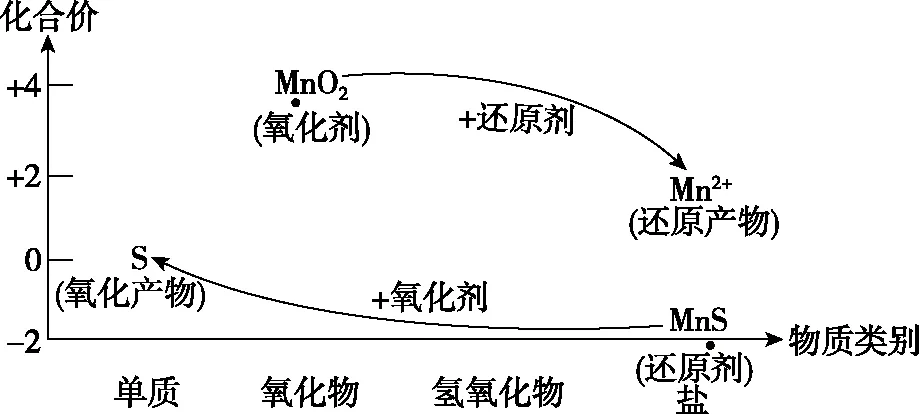
圖4 錳、硫及其化合物的價-類二維圖
【解析】第1步:找出發生氧化還原反應的粒子:MnO2中Mn為+4價,處在高價,因而具有氧化性;MnS中S為-2價,處在最低價,因而具有還原性。
第2步:合理地預測產物:MnO2發生還原反應,Mn元素化合價降低,產物一般為+2價的Mn2+;MnS發生氧化反應,S元素化合價升高,氧化產物一般為單質S。由此可得,MnO2+MnS——2Mn2++S。
第3步:配電子。由于MnO2→Mn2+是得到2e-;MnS→S是失去2e-,因此,得失電子已經相等了。
第4步:配電荷。由于加入的是硫酸溶浸,且方程式右邊總共有4個單位的正電荷,因而在方程式的左邊補上4個H+,使得方程式左右兩邊電荷守恒。即MnO2+MnS+4H+——2Mn2++S。
第5步:配原子。根據原子守恒,顯然在生成物的一邊要加2個H2O,即MnO2+MnS+4H+——2Mn2++S+2H2O。這樣該離子化學方程式就配平了。

【點評】書寫陌生情景中氧化還原反應方程式,其核心在于理解氧化還原反應的思維模型,從物質類別和元素價態變化的視角認識物質的轉化路徑,找準氧化劑和還原劑、氧化產物和還原產物。在氧化還原反應中,元素化合價升高,失去電子,該物質作還原劑,變為氧化產物;元素化合價降低,獲得電子,該物質作氧化劑,變為還原產物。元素化合價升降總數等于反應過程中電子轉移的數目,可利用最小公倍數法配平氧化還原反應方程式,對于離子反應,同時還要符合電荷守恒及原子守恒。
(二)真題演練
1.(2019·全國卷Ⅰ·27改編)硫酸鐵銨[NH4Fe(SO4)2·xH2O]是一種重要鐵鹽。為充分利用資源,變廢為寶,在實驗室中探究采用廢鐵屑來制備硫酸鐵銨,具體流程如下:

回答下列問題:
步驟③中發生反應的離子方程式:___________________。
選用足量的H2O2,理由是____________________。
2.(2019·全國卷Ⅱ·26節選)立德粉ZnS·BaSO4(也稱鋅鋇白),是一種常用白色顏料。
以重晶石(BaSO4)為原料,可按如下工藝生產立德粉:
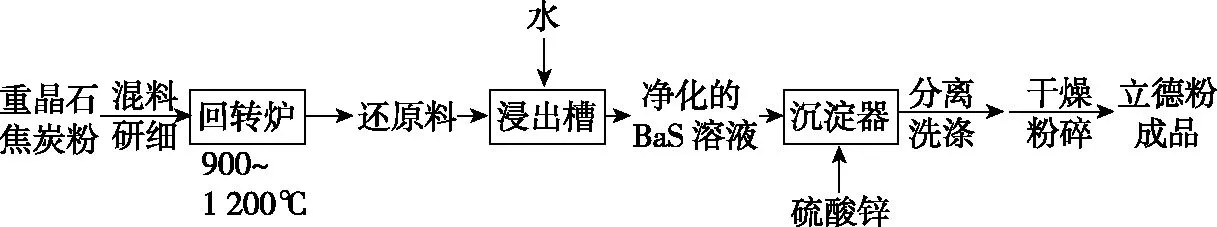
在回轉爐中重晶石被過量焦炭還原為可溶性硫化鋇,該過程的化學方程式為________________________。回轉爐尾氣中含有有毒氣體,生產上可通過水蒸氣變換反應將其轉化為CO2和一種清潔能源氣體,該反應的化學方程式為________________________。
3.(2019·北京卷·26節選)化學小組用如下方法測定經處理后的廢水中苯酚的含量(廢水中不含干擾測定的物質)。
Ⅰ.用已準確稱量的KBrO3固體配制一定體積的amol·L-1KBrO3標準溶液;
Ⅱ.取v1mL上述溶液,加入過量KBr,加H2SO4酸化,溶液顏色呈棕黃色;
Ⅱ中發生反應的離子方程式是__________________。
4.(2019·天津卷·2)下列離子方程式能用來解釋相應實驗現象的是
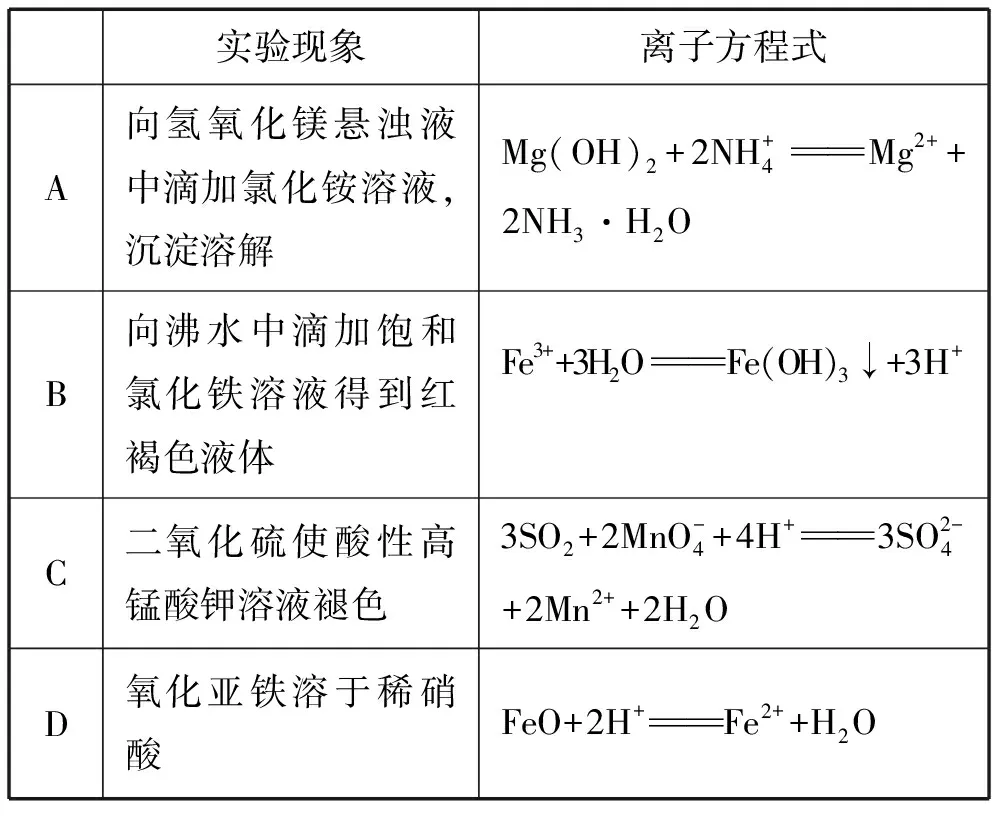
( )
5.(2019·江蘇卷·16節選)N2O、NO和NO2等氮氧化物是空氣污染物,含有氮氧化物的尾氣需處理后才能排放。
(1)N2O的處理。N2O是硝酸生產中氨催化氧化的副產物,用特種催化劑能使N2O分解。NH3與O2在加熱和催化劑作用下生成N2O的化學方程式為________________。
6.(2019·江蘇卷·18·節選)將一定量的FeSO4·7H2O溶于稀硫酸,在約70℃下邊攪拌邊緩慢加入一定量的H2O2溶液,繼續反應一段時間,得到紅棕色黏稠液體。H2O2氧化Fe2+的離子方程式為____________________。
【參考答案】


4.A


