和厚樸酚通過調節(jié)PI3K/AKT通路介導的EMT抑制Hep3B細胞遷移和轉移
黃赟 李智文 黃晅昱 劉晨
肝細胞癌(hepatocellular carcinoma,HCC)是一種在中國人群中高發(fā)、難治的常見腫瘤,近幾十年來,肝癌患者的總生存率未有提高[1]。目前,臨床上用于晚期HCC的有效治療方法和策略非常有限,包括手術切除和肝移植、放療、全身化療和基于分子診斷的靶向治療等[2]。但大多數(shù)HCC患者在確診時已接近腫瘤終末期,并且HCC容易復發(fā)和遠處轉移,預后較差。因此,研發(fā)新型抗HCC藥物具有十分重要的臨床意義。和厚樸酚(honokiol,HNK)作為傳統(tǒng)中藥厚樸的有效成分之一,具有廣泛的抗腫瘤活性。已有相關報道證實,HNK可以有效抑制乳腺癌、肺癌、骨肉瘤、膠質瘤和黑色素瘤等惡性腫瘤的轉移進展[3-6],但在肝細胞癌中,HNK是否有抑制腫瘤細胞遷移和轉移的能力仍需要進一步驗證闡明。本研究旨在探索HNK對于肝癌細胞遷移、轉移能力的影響,試圖尋找合理的分子機制對其進行解釋。我們的研究結果表明HNK可以作為一種天然、安全、有效的肝癌治療輔助藥物。
1 材料與方法
1.1 實驗材料和試劑
抗磷脂酰肌醇3-激酶(PI3K)、p-PI3K(Tyr458)、蛋白激酶B(AKT)、p-AKT(Ser473)、波形蛋白(Vimentin)、上皮-鈣依賴性粘附蛋白(E-cadherin)、神經(jīng)-鈣依賴性粘附蛋白(N-cadherin)抗體均購自美國CellSignaling Technology公司。抗甘油醛-3-磷酸脫氫酶(GAPDH)抗體購自美國Proteintech公司。牛血清白蛋白(BSA)、胎牛血清(FBS)、DMEM培養(yǎng)基購自美國Gibico公司。草酸銨結晶紫染色液購自北京索萊寶公司。蘇木精染液、伊紅染液購自北京雷根生物技術公司。Transwell細胞培養(yǎng)小室購自美國康寧公司。
1.2 細胞培養(yǎng)
人肝癌Hep3B細胞購自中國科學院上海細胞庫。細胞常規(guī)培養(yǎng)在37℃、5%CO2的恒溫培養(yǎng)箱中。當細胞生長至70%左右密度時先更換為無血清培養(yǎng)基,再給予藥物處理。
1.3 實驗動物及動物模型建立
4~5周齡的雌性裸鼠(BALB/C-nu/nu;18~20 g)由上海實驗動物中心提供,均飼養(yǎng)在福建醫(yī)科大學動物實驗中心SPF級動物房,實驗方案經(jīng)福建醫(yī)科大學動物實驗倫理委員會批準。肺轉移模型設計如下:每只裸鼠通過尾靜脈注射濃度為2.0×106的Hep3B細胞。1周后,將小鼠隨機分成試驗組(n=5)和對照組(n=5),每日腹腔注射HNK(50 mg/kg)或空載溶劑,持續(xù)5周。在第6周造模結束時處死并完整取出肺組織。統(tǒng)計肺部轉移瘤結節(jié)個數(shù)并進行后續(xù)蘇木精和伊紅(H&E)染色。
1.4 H&E染色
裸鼠完整肺組織用4%的多聚甲醛固定、脫水后浸蠟、包埋、切片。H&E染色染色前先烤片1小時,再用梯度乙醇和二甲苯脫蠟至水化。接著用蘇木精染色5~7分鐘,再用伊紅染色3分鐘。最后脫水、透明、封片。
1.5 細胞劃痕實驗
在HNK刺激后,將細胞接種到6孔培養(yǎng)板中。當細胞生長至緊密接壤時,用移液槍頭在細胞上輕輕劃過直線,然后用磷酸鹽緩沖液(PBS,pH=7.4)小心洗去細胞碎片;之后加入2 mL維持培養(yǎng)基(含2%FBS的DMEM)繼續(xù)培養(yǎng)。使用顯微鏡(200×)在不同刺激時間點(0 h,48 h)觀察同一位置細胞遷移情況變化。
1.6 細胞遷移試驗
使用Transwell試驗測定以評估細胞遷移能力變化。將細胞(1×105個/孔)置于transwell裝置的上室中,用不含F(xiàn)BS的DMEM培養(yǎng)基培養(yǎng);下室用500 μL含10%FBS的DMEM填充。將上述裝置在37℃下孵育18小時。孵育期結束后,將固定遷移至上室隔膜下表面的細胞連同完整底膜一起剪切下來,并用2.0%結晶紫染色。顯微鏡下選擇5個不同位點拍照并統(tǒng)計遷移細胞數(shù)量。
1.7 Western blot法檢測蛋白水平
4℃條件下在細胞中加入蛋白裂解液,30分鐘后收集細胞裂解液,超聲碎裂細胞,離心(12 000 g,4℃,15分鐘)后測定蛋白濃度,剩余樣品混合上樣緩沖液并置于100℃中變性5分鐘。配置10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠進行電泳,分離蛋白后轉移PVDF膜上,用相應一抗進行孵育(GAPDH稀釋濃度為1:2 000,其余抗體均為1:1 000),TBST洗滌后用相應二抗孵育,化學發(fā)光法進行顯影并進行灰度測定及統(tǒng)計。所有實驗重復三次。
1.8 統(tǒng)計學方法
采用SPSS 22.0統(tǒng)計軟件進行統(tǒng)計學分析,所有數(shù)據(jù)均采用()表示。計量資料比較采用單因素方差分析,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 HNK對Hep3B細胞遷移能力的影響
首先用不同濃度的HNK(20 μmol/L,30 μmol/L)刺激Hep3B細胞24小時。細胞劃痕實驗結果顯示:與對照組相比,HNK處理組中Hep3B細胞的遷移能力降低[0 μmol/L:(45.0±5.8)%;20 μmol/L:(76.7±4.4)%;30 μmol/L:(92.0±1.5)%;0 μmol/L:20 μmol/L,P=0.012;0 μmol/L:30 μmol/L,P=0.001;20 μmol/L:30 μmol/L,P=0.030],并顯示出濃度依賴性趨勢(見圖1A)。Transwell遷移實驗結果亦顯示:與對照組相比,HNK處理后的Hep3B細胞遷移數(shù)目減少[0 μmol/L:(142.6±10.1)%;20 μmol/L:(74.0±6.4)%;30 μmol/L:(25.0±3.8)%;0 μmol/L:20 μmol/L,P=0.005;0 μmol/L:30 μmol/l,P=0.001;20 μmol/L:30 μmol/L,P=0.003],并顯示出濃度依賴性趨勢(見圖1B)。以上結果表明HNK具有抑制體外HCC細胞遷移的能力。

圖1 HNK在體外對細胞遷移能力的影響
2.2 HNK對Hep3B細胞在體內轉移能力的影響
我們使用Hep3B細胞構建裸鼠肺轉移模型以評估HNK對HCC細胞轉移性生長的影響(見圖2)。H&E染色結果及肺轉移瘤的統(tǒng)計結果均顯示:HNK治療組中的裸鼠肺轉移結節(jié)數(shù)目低于對照組[(13.0±3.97):(2.20±1.01)個,P=0.021)]。上述結果證實,HNK具有抑制體內HCC細胞轉移的能力。

圖2 HNK在體內對細胞轉移能力的影響
2.3 HNK對Hep3B細胞PI3K/AKT通路及EMT相關蛋白的影響
如圖3所示,我們觀察到HNK在Hep3B細胞中能降低PI3K和AKT蛋白的磷酸化水平,證實了HNK可以抑制Hep3B細胞中的PI3K/AKT信號通路。PI3K/AKT信號通路的變化進一步影響了上皮-間充質轉化(epithelial-mesenchymal transition,EMT)相關蛋白的表達,包括波形蛋白(Vimentin)、上皮-鈣依賴性粘附蛋白(E-cadherin)和神經(jīng)-鈣依賴性粘附蛋白(N-cadherin)的改變。結果提示:隨著PI3K/AKT通路信號的減弱,E-cadherin蛋白的表達上調,而間質標志物N-cadherin和Vimentin蛋白的表達受到抑制,說明HNK可以通過抑制PI3K/AKT通路逆轉EMT。詳見表1。
表1 p-PI3K、p-AKT、Vimentin、N-cadherin和E-cadherin蛋白的相對表達量(,n=3)
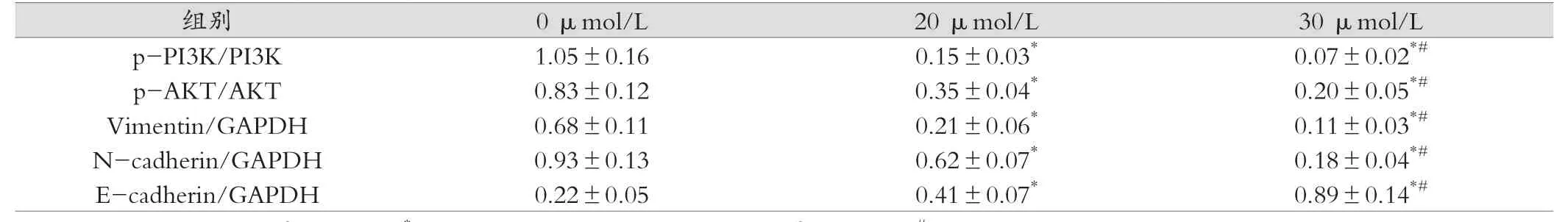
表1 p-PI3K、p-AKT、Vimentin、N-cadherin和E-cadherin蛋白的相對表達量(,n=3)
注:與0μm HNK治療組比較,*P<0.05;與20μmol/L HNK治療組比較,#P<0.05
images/BZ_138_213_1101_2303_1148.pngp-PI3K/PI3K 1.05±0.16 0.15±0.03* 0.07±0.02*#p-AKT/AKT 0.83±0.12 0.35±0.04* 0.20±0.05*#Vimentin/GAPDH 0.68±0.11 0.21±0.06* 0.11±0.03*#N-cadherin/GAPDH 0.93±0.13 0.62±0.07* 0.18±0.04*#E-cadherin/GAPDH 0.22±0.05 0.41±0.07* 0.89±0.14*#
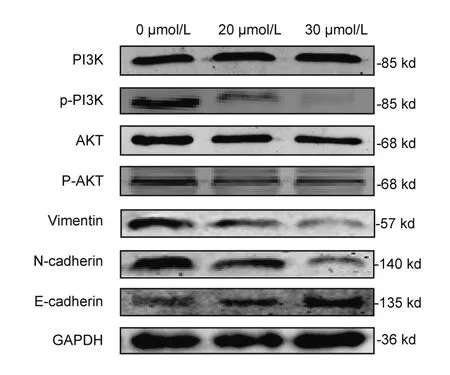
圖3 p-PI3K、p-AKT、Vimentin、N-cadherin和E-cadherin蛋白的Western blot結果
3 討論
中草藥是祖國傳統(tǒng)醫(yī)學的瑰寶,其具有副作用較小、應用廣泛等有點。HNK作為傳統(tǒng)中草藥厚樸的有效成分之一,已被證實在多種腫瘤中具有廣泛的抗癌作用[3,7-8]。本研究證實,HNK能夠在體外有效抑制Hep3B細胞的遷移能力;在體內機制研究中,人肝癌細胞裸鼠肺部成瘤模型的實驗結果顯示HNK治療抑制了Hep3B細胞轉移至肺部成瘤的能力。上述實驗結果共同驗證了HNK對HCC細胞轉移能力的抑制作用。
HCC作為一種高發(fā)、難治的常見病,其高死亡率和低治愈率在很大程度上是由于晚期腫瘤的遠處轉移。目前普遍認為上皮-間充質轉化(epithelial-to-mesenchymal transition,EMT)在腫瘤轉移的分子機制其中起著重要作用,在腫瘤進展、轉移和耐藥性等領域已經(jīng)有了廣泛而深入的研究[9-10]。因此,我們推測HNK對Hep3B細胞遷移和轉移的抑制作用有可能與抑制EMT有關。在本研究中,蛋白質印跡實驗的結果證實了我們的假設:HNK治療后,上皮標記物E-鈣粘蛋白上調,而間質標記物波形蛋白(一種細胞骨架蛋白)和N-鈣粘蛋白(一種細胞表面蛋白)則相應下調,證實了HNK能夠通過抑制肝癌細胞的EMT來抑制腫瘤的遷移和轉移能力。
PI3K/AKT通路是一個經(jīng)典的關鍵致癌信號通路,其影響腫瘤發(fā)展的多個關鍵方面,包括細胞周期轉變、增殖、細胞粘附、運動和侵襲性[11-12]。PI3K/AKT通路的異常激活在HCC中頻繁被報道,以通路中關鍵蛋白的磷酸化水平升高為特征。既往相關研究表明,HNK能夠通過降低相關蛋白磷酸化水平抑制PI3K/Akt途徑[13-14]。本研究結果證明了HNK在HCC中下調了PI3K/AKT通路相關蛋白的表達,并最終抑制了EMT,這與之前報道的PI3K/Akt通路也參與了EMT的誘導相關文獻結果一致[15-16]。因此,HNK作為一種天然的PI3K抑制劑,具有有效抗肝細胞癌的作用。
綜上所述,我們得出結論:HNK通過抑制PI3K/AKT通路逆轉EMT,進而抑制了HCC細胞的侵襲和轉移能力。NHK作為一種天然高效的抗癌藥物,在HCC治療中具有廣闊的研究前景和巨大的臨床應用價值。

