BrVIN3.1互作蛋白BrZAT12在大白菜春化途徑中行使功能初探
辛曉云 王 斌,2 趙岫云 張德雙 汪維紅 余陽俊 蘇同兵 于拴倉 張鳳蘭*
(1 北京市農林科學院蔬菜研究中心,北京 100097;2 北京市農學院植物與科學技術學院,北京 102206)
大白菜原產我國,是種植面積最大的蔬菜作物。先期抽薹嚴重影響了大白菜的產量和質量,是育種中亟待解決的問題。植物開花的調控機制非常復雜,涉及多種調節途徑。對于二年生的大白菜來說,春化作用是成花所必需的,因此研究春化途徑對解析大白菜的開花調控機理具有重要的意義。
VERNALIZATION INSENSITIVE 3(VIN3)屬于PHD-finger 蛋白,是春化途徑中的關鍵調節因子。在擬南芥上的研究表明,VIN3在春化過程中與VERNALIZATION 1(VRN1)、VERNALIZATION 2(VRN2)以 及Polycomb Repression Complex 2(PRC2)一起形成復合體作用于FLC組蛋白染色質,使其組蛋白H3第27位賴氨酸發生三甲基化修飾(H3K27 me3),從而抑制FLC的表達以促進植物開花(Ruth et al.,2004;Sibum &Richard,2004;Kim &Sung,2017)。VIN3蛋白在白菜等十字花科蔬菜的春化途徑中也發揮著同樣重要的作用(胡功鈴 等,2010;于錫宏 等,2012;Su et al.,2018)。Su 等(2018)研究表明,在春白菜選育過程中,BrVIN3.1和BrFLC1基因同時受到選擇,BrVIN3.1通過調節BrFLC1的表達參與春化誘導白菜開花途徑的調控。BrVIN3.1和BrFLC1作為同一條遺傳通路的兩個重要因子被組合選擇,它們在由春化誘導白菜開花途徑中行使主要功能。
ZINC FINGER OF ARABIDOPSIS THALIANA 12(ZAT12)為典型的C2H2型鋅指蛋白(黃驥和張紅生,2007),是一個參與ROS 相關抗氧化系統活化的非生物脅迫相關的轉錄因子,能夠在幾分鐘內響應干旱、高溫、高光強、高鹽度以及機械傷害、過氧化氫(H2O2)、甲基紫精(百草枯)、環己酰亞胺處理等多種脅迫(Vogel et al.,2004;Davletova et al.,2005;Ben Daniel et al.,2016)。在擬南芥中,ZAT12在活性氧和非生物脅迫信號中發揮核心作用(Davletova et al.,2005)。筆者在擬南芥eFP Browser(http://bbc.botany.utoronto.ca/efp/cgi-bin/efpWeb.cgi)中觀察到,ZAT12在花器官中有著較高的表達,暗示ZAT12在花器官中發揮作用,但是關于ZAT12影響植物開花,特別是影響大白菜等十字花科蔬菜抽薹的研究鮮有報道。
本試驗通過酵母文庫篩選和酵母雙雜交驗證尋找BrVIN3.1互作蛋白,進而分析不同花期大白菜中候選基因的表達模式,挖掘春化誘導開花途徑中的其他調節因子,旨在為進一步深入解析大白菜開花調控分子機制奠定基礎。
1 材料與方法
1.1 供試材料
供試大白菜品種分別為白楊,不耐抽薹;膠二葉,耐抽薹,均來源于北京市農林科學院蔬菜研究中心白菜課題組。種子經催芽萌發后種植到營養土中,正常溫度(22 ℃,16 h 光照/8 h 黑暗)生長21 d,然后轉移至低溫(4 ℃,16 h 光照/8 h 黑暗)春化處理21 d,處理結束后再在正常溫度條件下生長7 d。自春化處理開始,每隔7 d 分別收取白楊和膠二葉葉片樣品1次。
1.2 菌株、載體和主要試劑
克隆感受態細胞Trans1-T1(CD501-03)購自北京全式金生物技術有限公司;GV3101農桿菌感受態細胞(BC304-01)購自北京博邁德基因技術有限公司;pGADT7、pGBDT7等相關載體為北京市農林科學院蔬菜研究中心葉根菜類蔬菜遺傳與育種研究室保存;SanPrep 柱式DNA 膠回收試劑盒(B518131-0100)購自生工生物工程(上海)股份有限公司;質粒DNA 小量抽提試劑盒(離心柱型)(Cat,#DP103-03)、RNA Prep Pure 多糖多酚植物總RNA 提取試劑盒(離心柱型)(Cat,#DP441)購自天根生化科技(北京)有限公司;反轉錄試劑盒PrimeScript TM reagent Kit with gDNA Eraser 購自大連寶生物工程有限公司;載體克隆試劑 盒ClonExpress ⅡOne Step Cloning Kit(C112)購自南京諾唯贊生物科技有限公司;熒光定量PCR試劑盒LightCycler 480 SYBR GreenⅠMaster(04887352001)購自上海羅氏制藥有限公司;其余試驗試劑購自北京化工廠。引物由北京博邁德基因技術有限公司合成,DNA 序列一代測序由北京擎科技術有限公司完成。
1.3 引物設計及目的基因克隆
利用BRAD 數據庫(http://brassicadb.org/brad/)以及載體多克隆位點序列,并結合DNAMAN 設計BrVIN3.1和BrZAT12的特異性引物,相關引物序列詳見表1。

表1 試驗所需相關引物序列
采用植物總RNA 提取試劑盒提取大白菜白楊樣品葉片總RNA,利用反轉錄試劑盒獲得cDNA,-80 ℃保存。
以上述獲得的cDNA 為模板,進行高保真PCR 擴增,反應體系:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,68 ℃延伸90 s,35個循環;68 ℃延伸10 min。PCR 擴增產物用1%瓊脂糖凝膠電泳檢測,采用回收試劑盒回收目的片段。
1.4 相關載體的構建
將回收的目的片段按照載體克隆試劑盒說明書所述方法,與pGADT7和pGBKT7載體連接,構建策略如圖1所示,連接產物轉化至大腸桿菌感受態細胞,菌懸液分別涂布于含氨芐青霉素(Amp)和卡那霉素(Kan)的LB 平板上,37 ℃培養過夜。挑取平板上多個單克隆進行菌落PCR 驗證,對陽性克隆進行測序驗證,確認序列無誤后,利用質粒DNA 小量抽提試劑盒提取質粒pGBKT7-BrVIN3.1、pGBKT7-BrZAT12待用。
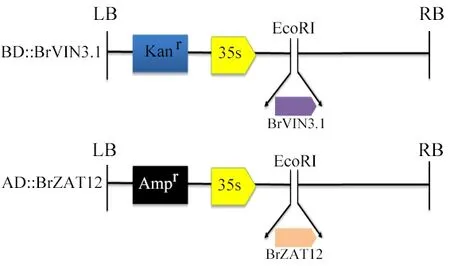
圖1 載體構建策略
1.5 酵母雙雜交試驗
參照Chang 等(2017)的方法,將重組質粒pGBKT7-BrVIN3.1、pGBKT7-BrZAT12轉化酵母感受態細胞。
酵母感受態細胞的制備:挑取在YPDA 固體培養基上生長的酵母AH109,接入200 mL YPDA液體培養基中,28 ℃、220 r·min-1培養至OD600為0.4~0.6;室溫條件下5 000 g 離心5 min,收集菌體,3 mL 無菌水重懸;室溫條件下5 000 g 再離心5 min,棄上清液,菌體使用1 mL TE/LiAc 緩沖液(10 mmol·L-1Tris-HCl,pH 值7.5,1 mmol·L-1EDTA,100 mmol·L-1LiAc)重懸,即為酵母感受態細胞。
質粒轉化酵母感受態細胞:將上述酵母感受態細胞分裝為每管50 μL,加入10 μL 鮭精DNA、pGADT7載體和pGBKT7載體質粒各0.5 μL,最后 加 入300 μL PEG/LiAC 緩 沖 液(10 mmol·L-1Tris-HCl,pH 值7.5,1 mmol·L-1EDTA,5%PEG4000),充分混勻后28 ℃、220 r·min-1振蕩30 min;加入終濃度為10%的DMSO,混勻后42℃水浴15 min,立即冰浴2 min;6 000 g 離心3 min,收集菌體,使用200 μL TE 緩沖液(10 mmol ·L-1Tris-HCl,pH 值7.5,1 mmol·L-1EDTA)重懸,均勻地涂布在2D 培養基上,28 ℃倒置培養2~4 d;待長出菌斑后,挑取單菌落轉接到SD/-Leu/-Trp/-His/-Ade/AbA 培養基上,28 ℃倒置培養2~4 d。
顯色:將生長在SD/-Leu/-Trp/-His/-Ade/AbA培養基上的新鮮菌斑轉印到濾紙上,液氮冷凍10 s,室溫自然融化;重復冷凍融化2次。將粘有菌斑的濾紙浸泡在顯色溶液(2 mL Z buffer,5.4 μL β-mercaptoethanol,33.4 μL X-gal)中,30 ℃避光顯色8 h,染為藍色的菌斑即認為有相互作用,不被染色的菌斑則認為沒有相互作用。
Z buffer 配 方:Na2HPO4· 7H2O 16.7 g·L-1,NaH2PO4· H2O 5.50 g·L-1,KCl 0.57 g·L-1,MgSO4·7H2O 0.246 g·L-1,調節pH 值為7.0。
X-gal 配方:用二甲基甲酰胺(DMF)將5-溴-6-氯-3-β-D-半乳糖苷(X-gal)溶解為20 mg·mL-1。
1.6 熒光定量PCR 分析
利用植物總RNA 提取試劑盒提取1.1中收取的白楊和膠二葉的葉片樣品總RNA,利用反轉錄試劑盒進行反轉錄得到cDNA,并將cDNA 稀釋至200 ng·μL-1待用。利用BRAD 數據庫設計適用于熒光定量PCR 的引物,采用試劑盒進行熒光定量PCR 分析。
2 結果與分析
2.1 BrZAT12與BrVIN3.1的互作分析
已有研究表明,BrVIN3.1是春化途徑中的重要調節基因(Su et al.,2018),為了進一步解析春化途徑的分子機制,北京市農林科學院蔬菜研究中心葉根菜類蔬菜遺傳與育種研究室前期構建了大白菜cDNA 酵母文庫,以BrVIN3.1(Bra020445)為誘餌,篩選互作蛋白。對篩選到的互作蛋白進行注釋發現,其中包括BrZAT12(Bra006691)。為了驗證BrVIN3.1與BrZAT12的互作關系,本試驗進一進行酵母雙雜交試驗,結果如圖2所示,除pGADT7-BrZAT12和pGBKT7-BrVIN3.1能 在SD/-Leu/-Trp/-His/-Ade/AbA 篩選平板上生長且顯色后變藍外,其他組合均不能正常生長變藍,證明BrVIN3.1能夠與BrZAT12互作,表明BrZAT12可能參與了BrVIN3.1介導的大白菜春化開花途徑。
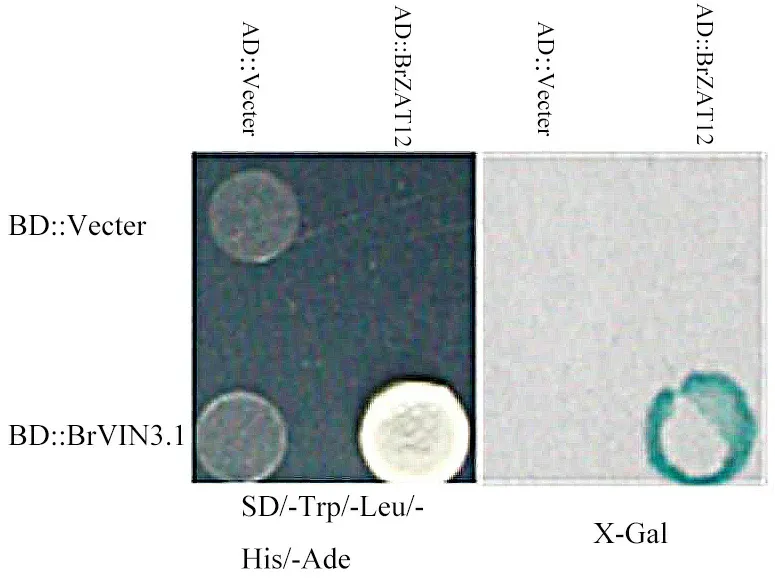
圖2 BrVIN3.1與BrZAT12蛋白互作的酵母雙雜一對一驗證
2.2 BrZAT12蛋白的氨基酸序列比對
BrZAT12作為BrVIN3.1的互作蛋白,其生物學功能目前尚沒有明確的報道。為了預測BrZAT12的生物學功能,本試驗利用大白菜克隆得到的BrZAT12氨基酸序列,通過Blastn 程序在NCBI 數據庫(http://www.ncbi.nlm.nih.gov/)中搜索相似氨基酸序列,利用鄰位相連法(neighborjoining,NJ)構建系統進化樹。如圖3-a 所示,植物中的ZAT12蛋白進化主要有3個分支,大白菜(Brassica rapa)的BrZAT12與擬南芥(Arabidopsis thaliana)、丹參(Eutrema salsugineum)、薺 藍(Camelina sativa)的ZAT12同處于一個分支,親緣關系較近。進一步利用DNAMAN 軟件對大白菜與擬南芥的ZAT12氨基酸序列進行比對發現,兩者的同源性高達84.66%(圖3-b),由此證明大白菜BrZAT12與擬南芥的ZAT12為同源基因,具有較近的親緣關系。現有的研究顯示擬南芥ZAT12作為轉錄因子廣泛地參與了包括低溫在內的非生物脅迫的響應,并且在花器官中表達升高。春化誘導的植物抽薹開花是在低溫逆境的基礎上發生的,由此推測BrZAT12也參與了大白菜開花調節途徑。
2.3 春化處理中BrZAT12 與BrVIN3.1 的表達模式分析

圖3 大白菜BrZAT12與AtZAT12同源性比較
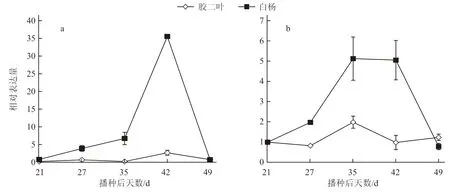
圖4 春化處理中BrVIN3.1 與BrZAT12 的表達模式分析
為了探究BrZAT12在春化開花途徑中與BrVIN3.1的上下游關系,本試驗利用實時定量PCR技術檢測低溫處理后BrVIN3.1和BrZAT12的表達量。選取易抽薹的白楊和耐抽薹的膠二葉作為試驗材料,跟蹤檢測春化處理中BrVIN3.1和BrZAT12的表達量。由圖4可知,持續低溫處理能夠誘導BrVIN3.1的表達,低溫處理結束后又恢復到正常水平,并且易抽薹材料白楊的上調幅度明顯高于耐抽薹材料膠二葉,證明BrVIN3.1在春化途徑中促進開花,這一結果與之前的報道(Su et al.,2018)一致。同時低溫處理后BrZAT12的表達量開始顯著上升,在低溫處理14 d 時達到峰值,低溫處理結束后又迅速回落,并且易抽薹材料白楊中BrZAT12的表達量明顯高于耐抽薹材料膠二葉。該結果表明BrZAT12能夠迅速響應春化處理,同時BrZAT12受低溫誘導表達的時間要早于BrVIN3.1,BrZAT12在低溫處理14 d 后表達量上升幅度最快并達到表達最高峰,而BrVIN3.1的表達則要滯后7 d,在低溫處理21 d 后達到表達最高峰,這表明BrZAT12在遺傳關系上可能位于BrVIN3.1的上游。
3 結論與討論
BrVIN3.1作為大白菜春化途徑的關鍵調節因子,其表達量特異地受到春化處理的誘導,但是目前春化處理誘導BrVIN3.1的表達機制尚沒有解析清楚。本試驗利用酵母文庫篩選和酵母雙雜交驗證,BrVIN3.1與BrZAT12在體內相互作用,這表明BrZAT12蛋白可能在大白菜抽薹開花中發揮著一定的作用。熒光定量PCR 結果表明,BrZAT12確實受低溫誘導,并且影響了開花基因BrVIN3.1的表達,但是BrZAT12受低溫誘導的方式和BrVIN3.1受低溫誘導的方式存在差異,BrVIN3.1的誘導表達滯后于BrZAT12,擬南芥中VIN3和ZAT12低溫處理后的表達模式也存在類似差異(Vogel et al.,2004;Franziska &George,2011),推測BrZAT12可能作為BrVIN3.1的一個上游作用因子,在大白菜開花中發揮影響。
在擬南芥中,過表達ZAT12蛋白可導致植物形態發育的多種表型。Rizhsky 等(2004)報道,ZAT12過表達對植物生長和發育沒有影響;而Iida等(2000)認為,ZAT12過表達植株在葉形和葉色上與對照相比存在差異。Vogel 等(2004)認為ZAT12過表達強烈影響植物生長發育,例如卷片、短葉柄、長角果等表型。前人研究得到不同結論的原因,可能是由于不同研究中獲得的過表達植株ZAT12表達水平存在差異導致的。Vogel 等(2004)研究表明,6周齡野生型(WT)和ZAT12過表達(35S∶∶ZAT12)植物在生長上存在著明顯的差異,ZAT12過表達(35S∶∶ZAT12)表現出了類似的晚花表型。但是,對于BrZAT12對開花途徑的影響和功能的研究,還應該多增加一些遺傳方面的證據。比如構建過表達BrZAT12的大白菜或擬南芥轉基因植株,利用Crispr/cas9基因編輯技術敲除大白菜BrZAT12基因,觀察它們的表型和開花相關指標等。
綜上,推測BrZAT12蛋白可能作為BrVIN3.1的一個上游調控因子,在大白菜抽薹開花中發揮作用,這也將為白菜類蔬菜品種選育以及分子育種等研究提供理論依據。

