黏土礦物界面吸附Fe(Ⅱ)耦合對鄰硝基苯酚還原轉化的增強機理研究
梁劍滔,盧鵬澄,寇卓瑤,趙 丹,吳宏海
(華南師范大學 環境學院, 廣東 廣州 510006)
鐵是地殼中豐度最高的過渡金屬元素,在厭氧環境下容易由Fe(Ⅲ)還原成Fe(Ⅱ),游離態Fe2+離子能與礦物表面活性基團結合并形成吸附態的Fe(Ⅱ)物種(Hofstetteretal., 2003),而吸附態Fe(Ⅱ)物種的還原電位得到有效降低,因而使該Fe(Ⅱ)物種的還原活性得到提高(Lietal., 2009)。吸附態Fe(Ⅱ)物種,能夠有效還原轉化一些環境污染物(Heijmanetal., 1995; Ruggeetal., 1998),從而實現環境凈化(謝麗等, 2008; 李俊等, 2009)。研究表明,氧化性硝基芳香族化合物在自然界中的主要轉化途徑是在厭氧環境介質(如沉積物和含水層)中的還原反應,而其中起主要作用的是那些不同吸附形態的Fe(Ⅱ)物種(Roden and Urrutia, 1999; Lovleyetal., 2004)。蒙脫石和高嶺石是典型的層狀硅酸鹽礦物,在自然界中大量存在,并且對重金屬離子具有很高的吸附容量,顯然它們對Fe2+也具有很強的吸附性能。然而,這兩種黏土礦物對Fe(Ⅱ) 的界面吸附形態有所差異。那么,它們界面吸附態Fe(Ⅱ)物種的還原性能是否存在不同呢?因此,本文開展了高嶺石、蒙脫石對Fe(Ⅱ) 的吸附對比研究,并著重探討溶液pH值、Fe(Ⅱ)濃度以及反應溫度等因素對鄰硝基苯酚(2-NP)還原轉化的影響。在此基礎上,探討不同吸附形式對上述還原轉化的調控規律。
1 材料和方法
1.1 試劑
鈉基蒙脫石(內蒙古)、高嶺石(廣東茂名)、4-磺酸丙基嗎啉(MOPS,大于99.0%)、4-嗎啉乙磺酸(MES,大于99.0%)、鄰硝基苯酚(2-NP)(99.5%)購自上海阿拉丁試劑廠; 而NaOH、FeSO4·7 H2O、HCl、NaCl 和甲醇等其他試劑(色譜級) 購于天津市大茂化學試劑廠。所有試劑均為分析純試劑;實驗用水均為二次去離子水。
1.2 實驗方法
1.2.1 溶液pH值對Fe(Ⅱ)吸附的影響
在規格20 mL的西林瓶中,通高純氮氣除氧并依次加入68.0 mg的黏土和17 mL 混合溶液(0.1或0.5 mmol/L的FeSO4還原劑,0.2 mol/L NaCl 和28 mmol/L MOPS或MES)。蓋上橡膠塞,加鋁蓋密封,避光置于25℃的恒溫搖床持續搖動(200 r/min),振蕩24 h,后離心(4 000 r/min)5 min;然后,用鄰菲羅啉比色法測定(510 nm)溶液中的Fe2+濃度;同時,以不含礦物樣品的實驗組做空白對照。本文實驗主要考查了溶液pH值(4~8)對蒙脫石和高嶺石兩種礦物表面吸附Fe2+的影響。
1.2.2 鄰硝基苯酚(2-NP)的轉化
氮氣保護的缺氧環境下,將調好pH值含緩沖溶液(MOPS或MES)28 mmol/L、NaCl 0.2 mol/L的250 mL溶液中加入到250 mL的玻璃反應器中,同時加入一定量的高嶺石(或蒙脫石)和不同濃度的Fe2+離子,置于DF-101S集熱式恒溫加熱磁力攪拌器(廣州比朗儀器有限公司)中,溫度恒定在25 ℃、轉速400 r/min,攪拌2 h使黏土對Fe2+的吸附達到平衡。之后,加入一定量的鄰硝基苯酚(2-NP)使其初始濃度為0.022 mmol/L,反應開始并間隔取樣,過0.45 μm濾膜后測試分析。
1.2.3 分析方法
采用高效液相色譜儀(HPLC)測定溶液中的2-NP濃度,儀器為日本島津Shimadzu LC-10AT,色譜柱為Syncronis-C18反相柱(250 mm×4.6 mm,5 μm)。流動相組成為70%的甲醇(色譜純級)和30%的水,其中30%的水加鹽酸酸化至pH = 2.8。流量為1 mL/min,柱溫為25 ℃,進樣量為20 μL,檢測波長265 nm。
溶液中Fe2+的測定采用鄰菲絡啉比色法測定(510 nm),分析儀器為7502P CS型紫外可見分光光度計。
2 結果與討論
2.1 Fe2+離子在黏土礦物上的吸附特征
當Fe2+初始濃度一定時,蒙脫石和高嶺石對Fe2+的吸附量隨pH值的升高而增大,該吸附過程在pH值5.0~7.0范圍內增幅明顯;蒙脫石主要通過離子交換以及端面羥基與Fe2+絡合吸附Fe(Ⅱ),而高嶺石則主要是通過端面羥基與Fe2+的絡合吸附Fe(Ⅱ);隨著pH值的升高,礦物表面去質子化增強,使得Fe2+與礦物表面形成的配合物增多(Lietal., 2009)。在相同條件下[如pH=6.0、Fe(Ⅱ)濃度為0.1 mmol/L時],蒙脫石對Fe2+的吸附量較之高嶺石要大得多。這是因為,蒙脫石本身存在著較大的陽離子交換容量。因此,當pH值固定時,隨著Fe2+的濃度的增大,盡管吸附去除率減小,但總的表面吸附量卻是增加的(圖1)。
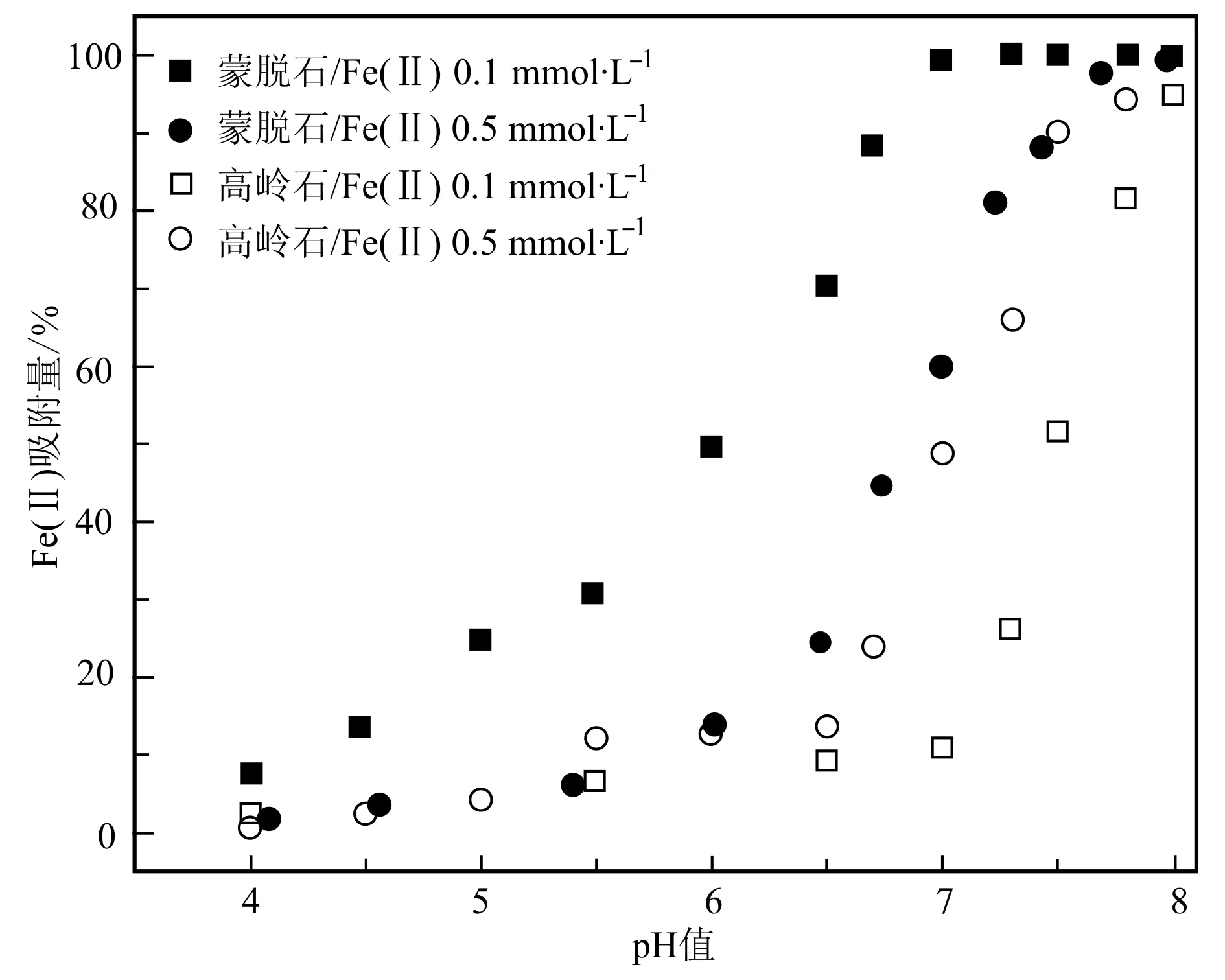
圖 1 溶液pH值對高嶺石和蒙脫石界面Fe(Ⅱ)吸附量的影響Fig. 1 Effect of pH on the adsorptions of Fe(Ⅱ) onto kaolinite and montmorillonite
2.2 5種不同反應體系中2-NP的轉化或去除情況
圖2的反應條件為Fe(Ⅱ)和2-NP的初始濃度分別為3.0 mmol/L、0.022 mmol/L,黏土的投加量為4.0 g/L,溫度25 ℃和pH = 6.7。從圖2[C0、Ct(mmol/L)分別表示初始和反應時間t(min)的2-NP濃度]可以看出,單獨黏土存在時對2-NP去除主要僅為吸附,故去除率不高;單獨高嶺石幾乎不發生吸附2-NP,蒙脫石對2-NP吸附弱,在4.0 h內的吸附率僅達20%。在單獨Fe(Ⅱ)的均相反應體系中,2-NP的還原轉化也較為緩慢,轉化率為52.6%;添加高嶺石時,2-NP能在4.0 h內完全轉化,其還原轉化速率顯著增大;而添加蒙脫石時,4.0 h內2-NP的去除率為85.8%,稍小于Fe(Ⅱ)/高嶺石體系的去除率,但卻明顯高于單獨Fe(Ⅱ)或蒙脫石存在下對2-NP的轉化率或去除率。說明在一定的pH值下,加入黏土能夠提高2-NP還原轉化的速率。由于在Fe(Ⅱ)/蒙脫石體系中有部分Fe(Ⅱ)以離子交換的形式進入蒙脫石,從而減少蒙脫石端面結合態Fe(Ⅱ)的吸附量,從而導致其對2-NP還原轉化率稍小于Fe(Ⅱ)/高嶺石體系的轉化率,即使單獨蒙脫石對2-NP有弱吸附。這些與前人的研究報道相吻合(孫克文等, 2008)。

圖 2 5種體系對2-NP的轉化或去除情況Fig. 2 The comparison of the transformations or removals of 2-NP by the five reaction systems
2.3 不同形態Fe(Ⅱ)還原轉化2-NP的動力學分析
由于黏土礦物對2-NP的吸附是物理吸附,而且2-NP的吸附不強但快速,還原轉化為限速因素,那么參照文獻(Wuetal., 2018)采用偽一級動力學方程擬合2-NP的還原轉化過程,用式(1)表示:
ln (Ct/C0) =-kt(1)
式中,C0、Ct(mmol/L)分別表示初始和反應時間t(min)的2-NP濃度,k(min-1)為準一級反應速率常數。圖3為單獨 Fe(Ⅱ)及其與兩種黏土的復合系統對2-NP的還原轉化動力學曲線,其反應條件同圖2。可以看出,兩種礦物體系對2-NP的還原轉化均很好的遵循偽一級反應動力學方程(R2>0.99),其中游離的Fe(Ⅱ)對2-NP的轉化效率最低,其反應速率常數為0.002 8; Fe(Ⅱ)/高嶺石體系比Fe(Ⅱ)/蒙脫石體系對2-NP的轉化效果還要好些,它們的還原速率常數分別為0.016 6和0.006 5,兩者相差近3倍。
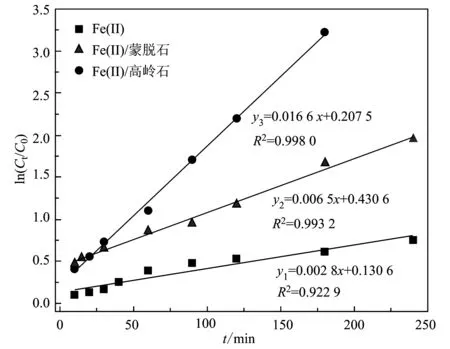
圖 3 3種不同體系中2-NP還原轉化的假一級動力學方程的擬合參數Fig. 3 Kinetics equation fitting parameters of the 2-NP reductive transformation in the three varying systems
2.4 溶液pH值對2-NP還原轉化的影響
圖4表示在2-NP初始濃度0.022 mmol/L、黏土投加量4.0 g/L、FeSO4濃度3.0 mmol/L和溫度25℃的條件下,溶液 pH 值的改變(6.0、6.7、7.0和7.3)對2-NP還原轉化的影響。結果表明,pH值對2-NP的還原轉化影響顯著。當pH值為6.0時,反應進行得很慢,Fe(Ⅱ)/高嶺石體系對2-NP的去除率只有19.5%,而Fe(Ⅱ)/蒙脫石體系對2-NP的去除率為35.6%,可能其中有一大部分是蒙脫石對2-NP的吸附去除。當pH值升高到6.7時,兩種黏土體系對2-NP的轉化率顯著增大,如在Fe(Ⅱ)/高嶺石體系中,2-NP能在4 h內反應完全,去除率可達100%。究其原因,隨著pH值的升高,礦物表面去質子化增強,從而使得Fe2+離子與礦物形成的表面配合物會相應地逐漸增加。當pH值由6.0升至7.3時,蒙脫石對Fe(Ⅱ)的催化還原能力明顯增強。此外,2-NP還原轉化一級速率常數的lnk值與pH值之間有顯著的線性相關性(R2分別為0.99和0.98),并隨著pH值的升高,2-NP還原轉化k值也不斷增大(圖4c)。因為pH值升高,以離子交換形式被蒙脫石吸附的Fe(Ⅱ)減弱,Fe(Ⅱ)水解或在端面配位上吸附增強,甚至可能會在蒙脫石上發生表面沉淀鐵氫氧化物(Erbsetal., 1999; Lee and Batchlor, 2002)。這些現象說明,Fe(Ⅱ)/高嶺石或蒙脫石的兩種體系中,2-NP的還原轉化對pH值非常敏感。由于通常蒙脫石存在的環境介質偏堿性,那么蒙脫石表面對Fe(Ⅱ)還原性能的促進不可忽視,其界面所發生反應具有重要的環境意義。

圖 4 初始pH值對2-NP還原轉化的影響(a,b)及其與lnk的關系(c)Fig. 4 Effect of initial pH on the 2-NP transformation (a, b) and the relationship between the lnk and the pH (c)
2.5 亞鐵離子濃度對2-NP還原轉化的影響
圖5表示2-NP的初始濃度為0.022 mmol/L、黏土投加量4.0 g/L、pH=6.7在溫度25℃時,FeSO4初始濃度變化(2.0、3.0、5.0和10.0 mmol/L)對2-NP還原轉化的影響。從圖5可以看出,2-NP還原轉化速率隨初始Fe(Ⅱ)濃度的升高而增大。在初始Fe(Ⅱ)濃度為2 mmol/L時,反應進行較慢;當初始Fe2+濃度升高至10.0 mmol/L時,2-NP在2 h內反應完全。這是因為:Fe(Ⅱ)的初始濃度增大,Fe(Ⅱ)吸附量增大,可促進表面結合態Fe(Ⅱ)的形成,從而提高Fe(Ⅱ)的還原能力,并顯著加快對2-NP的還原轉化。可見,較高的Fe(Ⅱ)初始濃度增強蒙脫石的催化性能,此現象與蒙脫石表面結合態Fe(Ⅱ)的吸附量增加幅度隨之增大有關。

圖 5 Fe(Ⅱ)初始濃度對2-NP還原轉化效果的影響Fig. 5 Effect of initial Fe(Ⅱ) concentration on the reductive transformation of 2-NP
2.6 溫度對2-NP還原轉化的影響
圖6為2-NP初始濃度為0.022 mmol/L、FeSO4初始濃度為3.0 mmol/L、黏土投加量4.0 g/L、pH = 6.7在25℃時,溫度對2-NP還原轉化的影響情況。由圖6可以看出,溫度對2-NP的還原轉化率影響很大,其還原轉化速率隨溫度升高而明顯增大。例如在Fe(Ⅱ)/高嶺石體系中,從25 ℃升高至40 ℃時,2-NP可被完全轉化的時間從240 min縮短至60 min。此外通過阿累尼烏斯(Arrhenius)方程(式2)可以計算出此條件下高嶺石和蒙脫石礦物界面2-NP還原轉化的反應活化能,分別為68.90和78.46 kJ/mol。
lnkobs=-Ea/RT+lnA(2)
式中,kobs表示反應熱力學常數,Ea表示反應活化能(kJ/mol);R、T分別為理想氣體方程常數(8.314 J/mol·K)和絕對溫度(K);A為常數項。

圖 6 溫度對2-NP還原轉化效果的影響 Fig. 6 Effect of temperature on the reductive transformation of 2-NP
3 黏土礦物吸附Fe(Ⅱ)對2-NP還原轉化增強機理探討
黏土礦物界面吸附,通常表現為離子交換形式,只是在端面上可能出現表面配位吸附(吳宏海等, 2003)。不同于鐵氧化物礦物表面單一的Fe(Ⅱ)配位吸附形式[如α-FeOOH對Fe(Ⅱ)的吸附(Taoetal., 2010)],黏土礦物表面出現多種吸附模式。然而,只有發生配位吸附的Fe(Ⅱ)或者結構Fe(Ⅱ)物種,其還原活性才較之游離態Fe(Ⅱ)強(Wuetal., 2018)。Fe(OH)2和 Fe(OH)3的溶度積常數(Ksp)分別是1.0×10-15、3.2×10-38。當溶液的pH<7.5,Fe(Ⅱ)濃度為3.0 mmol/L時沒有Fe(OH)2沉淀產生,而Fe(Ⅱ)濃度為10.0 mmol/L時就剛好有Fe(OH)2產生。Fe(Ⅱ)氧化后大都會以Fe(OH)3沉淀出現。顯然,當pH 值范圍在6.0 至7.3、Fe(Ⅱ)濃度為3.0 mmol/L時,Fe(Ⅱ)則以吸附存在為主導。Fe(Ⅱ)吸附形態又控制Fe(Ⅱ)的還原性能強弱。
本文通過改變溶液pH值或Fe(Ⅱ)濃度來調控Fe(Ⅱ)在兩種黏土礦物上的吸附形態。高嶺石表面零電荷點(pHpzc)= 5.2(高嵩等, 2005),而蒙脫石的pHpzc=2.0,當pH 值范圍在6.0 至7.3時高嶺石則會帶點一定量的負電荷,而蒙脫石荷明顯的負電荷(Wuetal., 2016)。所以,在pH = 6.7,當Fe2+離子低濃度,如小于2.0 mmol/L時,Fe2+大都為離子交換吸附,兩種礦物吸附的Fe2+與單獨Fe2+離子表現的2-NP還原轉化率差不多。究其原因,是離子交換態Fe2+的還原性能并沒有得到增強所致。當Fe2+的初始濃度升高至3.0 mmol/L時,高嶺石表面配位吸附的Fe2+容量提高,從而導致高嶺石系統的2-NP轉化率高于蒙脫石系統,但此時蒙脫石吸附Fe2+仍以離子交換吸附為主導。當Fe2+離子濃度升高至 5.0 mmol/L時,兩系統的2-NP轉化率就開始出現反轉,即蒙脫石高于高嶺石。此現象表明,蒙脫石表面配位吸附的Fe2+增加并開始超過高嶺石。一般地下水中Fe(Ⅱ)的濃度在3.0 mmol/L以下,那么環境介質的pH值需要7.0以上,黏土礦物吸附誘導作用才能發生顯著效應。在我國北方土壤酸堿條件可以滿足上述強化還原的要求。而在我國南方土壤,則需要適當升高介質的Fe(Ⅱ)濃度,例如可以通過微生物還原提高Fe(Ⅱ)離子在水溶液中的含量。實際上,聯合微生物可以實現持續凈化2-NP等氧化性污染物的目標。鄰硝基苯酚的最終還原產物為鄰氨基苯酚(簡稱為2-AP),其具體的還原轉化方程,見式(3)至(6)。由于通常帶—NH2的化合物最易被吸附,那么轉化產物2-AP容易被黏土礦物所吸附固定。
本文所采用蒙脫石的陽交換容量為654 cmol/kg(Weietal., 2017),那么可以估算出添加的1.0 g蒙脫石大致能交換3.27 mmol的Fe(Ⅱ)。當Fe2+濃度為3.0 mmol/L時,添加250 mL溶液中只相當于含有0.75 mmol的Fe(Ⅱ)。可見,大部分Fe(Ⅱ)以離子交換被蒙脫石所吸附。此估算值與圖2結果相吻合,盡管蒙脫石端面會競爭吸附,但對Fe(Ⅱ)的吸附量低,結果是Fe2+/蒙脫石體系的2-NP還原速率常數k僅比游離態Fe(Ⅱ)的稍高一點;若是Fe2+濃度為2.0 mmol/L時,2-NP還原轉化效率還會繼續降低(圖5)。離子交換態Fe(Ⅱ)因保留著水合水分子而其還原性能未能得到增強;Fe(Ⅱ)通過配位吸附或發生水解,其還原性能才會增強。
Fe(Ⅱ)2++≡SOH0(礦物表面) →≡SOFe(Ⅱ)++H+(3)
Fe(Ⅱ)OH++≡SOH0→≡SOFe(Ⅱ)OH0+H+(4)
≡SOFe(Ⅱ)++2-NP→≡SOFe(Ⅲ)2++2-AP
(5)
≡SOFe(Ⅱ)OH0+2-NP→≡SOFe(Ⅲ)OH++2-AP
(6)
4 結論與展望
在氮氣保護的缺氧環境中,耦合Fe(Ⅱ)吸附的黏土微界面結合系統可以有效還原轉化2-NP。該轉化效率隨著系統pH值、Fe(Ⅱ)初始濃度以及溫度的升高而增大。蒙脫石和高嶺石兩種黏土與Fe(Ⅱ)所構筑的礦物界面結合系統對2-NP還原轉化反應遵循偽一級反應動力學方程。盡管蒙脫石對Fe2+的吸附量明顯高于高嶺石,但因較大的陽離子吸附容量而不能更有效地提高蒙脫石對Fe(Ⅱ)的還原催化性能。這些歸因于大部分Fe(Ⅱ)以離子交換的形式進入層間域而減少了蒙脫石端面上所形成的表面結合態Fe(Ⅱ)的吸附容量。總之,Fe(Ⅱ)在礦物表面的吸附形態與吸附量,是制約上述2-NP還原轉化的關鍵影響因素。可見,通過對pH值、Fe(Ⅱ)初始濃度的調節,就可以實現黏土礦物界面催化性能的提高。

