大麥(青稞)籽粒顏色相關研究進展
蘇樂平 姚曉華 吳昆侖 楊雪 田昊人 黃書晴
摘要:青稞是我國青藏高原的主要糧食作物,也是我國藏族同胞的主要口糧。近幾年來,由于有色青稞含有豐富的花青素、纖維素、糖類、蛋白質等,得到了人們的喜愛和學者們的關注。本文從有色青稞籽粒顏色的劃分、植物花青素的生物學功能及合成調控、有色大麥(青稞)粒色基因的定位3個主要方面簡述了有色大麥(青稞)的研究進展,并提出了展望,為人們進一步認識和利用有色大麥(青稞)提供參考,也為青稞粒色基因的定位和相關基因克隆提供依據,期望隨著研究的深入,能夠培育出優異的有色大麥(青稞)新品種。
關鍵詞:大麥(青稞);粒色;花青素;基因定位
中圖分類號: S512.303.2文獻標志碼: A
文章編號:1002-1302(2019)18-0070-05
收稿日期:2019-03-12
基金項目:國家大麥產業技術體系(編號:CARS-05);國家自然科學基金(編號:31660388);青海省科技廳應用基礎研究項目(編號:2019-ZJ-7075)。
作者簡介:蘇樂平(1994—),男,陜西渭南人,碩士研究生,主要從事青稞遺傳育種研究。E-mail:sltp2015@163.com。
通信作者:吳昆侖,博士,研究員,主要從事青稞遺傳育種研究,E-mail:wklqaaf@163.com;姚曉華,碩士,副研究員,主要從事青稞遺傳育種研究,E-mail:yaoxiaohua009@126.com。
隨著我國改革開放的進行和經濟的飛速發展,人們的生活水平得到了明顯的提高。在飲食方面,人們追求更健康、更營養的飲食。青稞是十分有營養的糧食作物,它具有降“三高”(高血脂、高血壓、高血糖)、促消化、增強體質等功能,前人將這些功能總結為“三高兩低”,所以近年來青稞及相關食品越發受到人們的歡迎[1-2]。有色青稞是一類珍貴的青稞種質資源,主要包括黑青稞、紫青稞、藍青稞等[3-5]。有色大麥(青稞)富含天然色素,其花色苷、酚類化合物、人體必需氨基酸和微量元素等營養保健成分含量普遍高于普通大麥(青稞),具有特殊的生理功能,不僅是生產營養保健品的上好原料,也是食品加工業純天然的添加劑。其中含有的天然色素是化妝品行業防曬霜和染發劑等產品的無公害染料[6]。因此,挖掘調控青稞籽粒顏色的基因,是培育有色青稞品種的基礎。本文綜述了近幾年有色大麥(青稞)的籽粒顏色劃分、植物花青素(anthocyanidin)生物學功能及合成調控、有色大麥(青稞)粒色基因的定位等研究進展,為后期有色青稞基因定位與克隆和新品種的選育提供參考。
1?青稞及有色青稞的概述和籽粒顏色的劃分
1.1?青稞及有色青稞的概述
青稞(Hordeum vulgare L. var. nudum Hook. f.)屬于禾本科大麥屬,外稃頂端的芒呈三叉狀;籽粒與稃片已脫離,故稱裸大麥[7]。青稞的遺傳背景與大麥高度相似,通過高寒缺氧環境的自然選擇,己成為青藏高原最主要的農作物[8-9],是我國藏族同胞的主要口糧,主要分布在青藏高原、滇西北高原、甘南高原、川西部高原等4 200~5 000 m海拔的高寒缺氧地區[10-11]。
有色青稞是成熟時具有不同顏色的青稞籽粒,富含花色素、酚類化合物、蛋白質、人體必需氨基酸和微量元素等營養保健成分,尤其是黑青稞,其營養成分普遍高于普通青稞,因此有色青稞作為功能食品的開發越來越受到重視[12-14]。馴化對于大麥(青稞)品種的多樣性具有比較重要的意義,青藏高原是青稞的馴化地,青稞種質資源極其豐富,黑色、紫色和藍色等深色青稞(下文中稱有色青稞)又是其中最為珍貴的種質資源[4]。
1.2?青稞籽粒顏色的劃分
大麥顏色的劃分有多種方法,Jia等發現,大麥的籽粒顏色一般指大麥穎果的顏色,是由色素沉積在果皮和糊粉層中形成的[15]。由于有色青稞籽粒具有多種多樣的顏色,國外也有多種評判準則,主要可以分為黃、白、藍、紫、黑5種顏色,外種皮含有原花青素的籽粒為黃色[16];在穎片和果皮中含有花色苷的籽粒為紫(紅)色;在穎片或果皮中含有黑色素的籽粒為黑色;在谷物的糊粉層中含有花色素的籽粒為藍色[17];在外種皮、穎片、糊粉層等組織中不含任何生物色素的籽粒為白色[18]。在國內,徐廷文等將西藏山南地區大麥籽粒的顏色概括為白、藍、紫和黑4種顏色[19]。青稞和大麥同屬于麥屬,與大麥的親緣關系十分近,所以大麥粒色劃分的標準同樣適用于有色青稞的分類。
對于大麥籽粒顏色的研究,一直是國內外研究的熱點。Himi等的研究發現,有色大麥籽粒顏色與植物花青素的合成有著十分重要的關系[20-24]。
2?植物花青素的生物學功能及合成調控基因在大麥(青稞)籽粒顏色形成過程中的作用
2.1?植物花青素的生物學功能
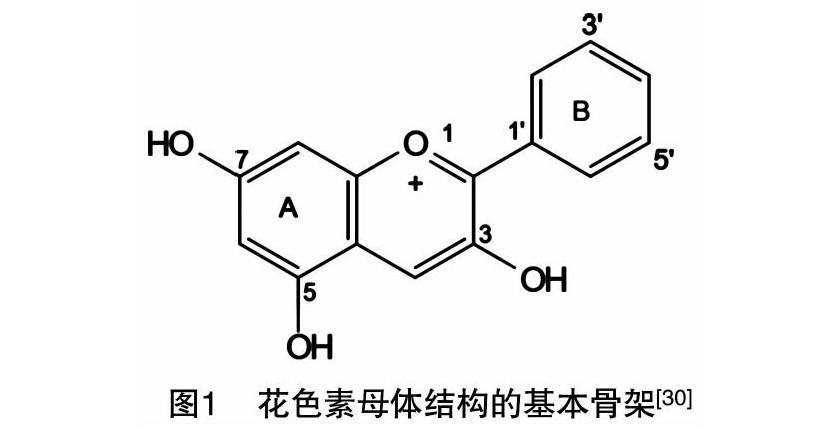
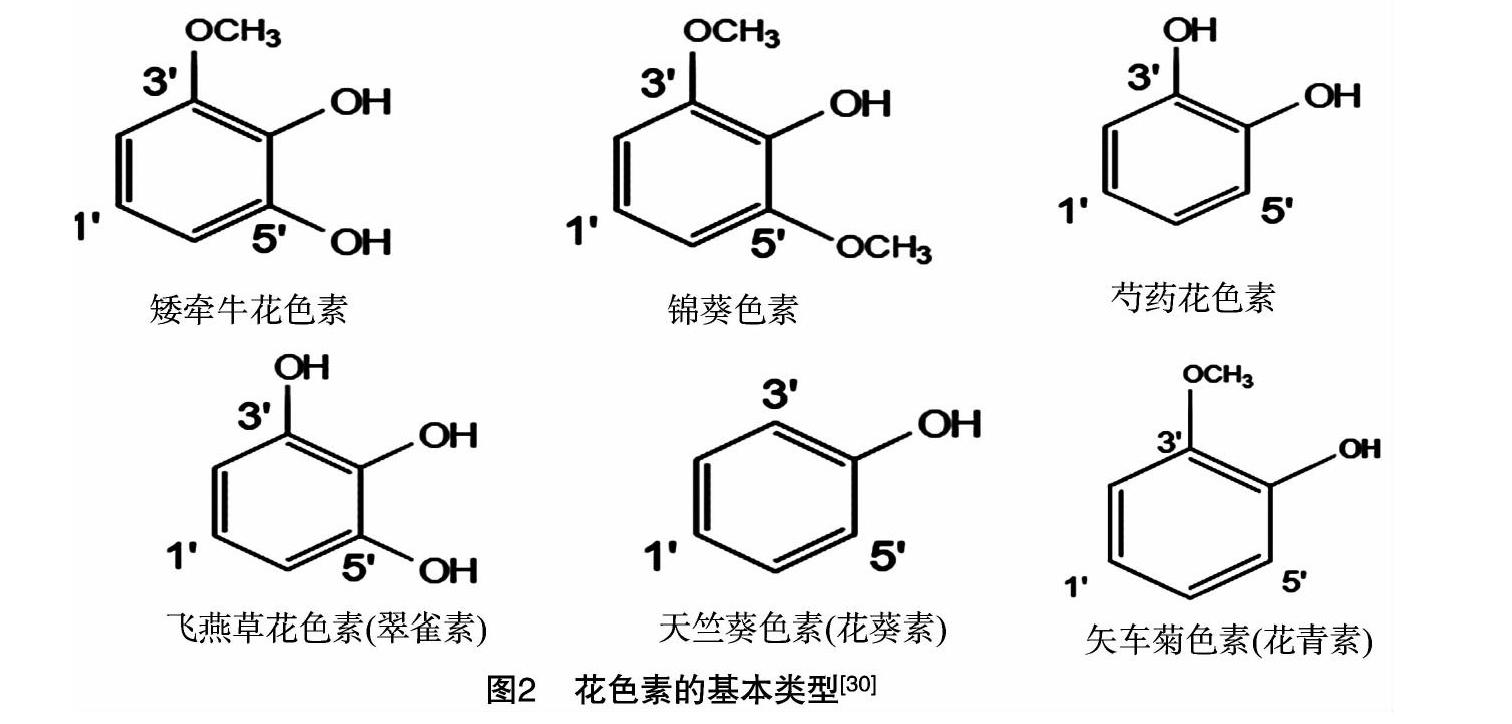
花青素又稱花色苷,是普遍存在于植物體內的一類次生代謝物質。天然花色素母體的糖苷配基的A環基本結構為3,5,7-三羥基-2-苯基苯并吡喃,其結構式如圖1所示,母體糖苷配基中B環的類型主要決定花青素的類型。A環與不同類型的B環共同組成植物中重要的6種花青素,即天竺葵色素、矢車菊色素、飛燕草色素、芍藥花色素、矮牽牛花色素和錦葵色素(圖2)[24-26]。花青素是一種水溶性色素,可以隨著細胞液的酸堿性變化改變顏色。細胞液呈酸性時則偏紅,細胞液呈堿性時則偏藍[27]。花青素的理化性質并不穩定,所有還有很多因子影響花青素的顯色,如細胞程序性凋亡以及各種逆境[28]。花青素廣泛分布在植物體營養器官表皮層以及生殖器官的細胞中,由于花青素的表達具有時空差異,故其在植物中呈現出多種顏色[29-30]。
花青素的生物學功能一直是科學家關注的熱點。花青素構成植物生活史的重要部分,幫助蟲媒植物吸引昆蟲進行傳粉完成生活史[31]。花青素由于其結構上的特征,可以保護植物免受一些逆境脅迫所產生的活性氧的傷害,以及一些過渡金屬的毒害和UV-B對植物的損害[18,28-29,32]。研究表明,花青素具有抗血小板聚集、抗氧化和抗炎等特性,不僅可以清除細胞中的自由基,而且還具有結合重金屬如鐵、鋅和銅的功能[29,32-36]。人們從食物中攝入的花青素能夠降低心腦血管疾病、高血脂、關節炎和癌癥的發病率[37-39]。此外,花青素還在抵制病原微生物以及蟲害的侵襲和有益微生物與植物共生等方面起著重要的作用[40-45]。
2.2?花青素合成及調控基因在大麥(青稞)籽粒顏色形成過程中的作用
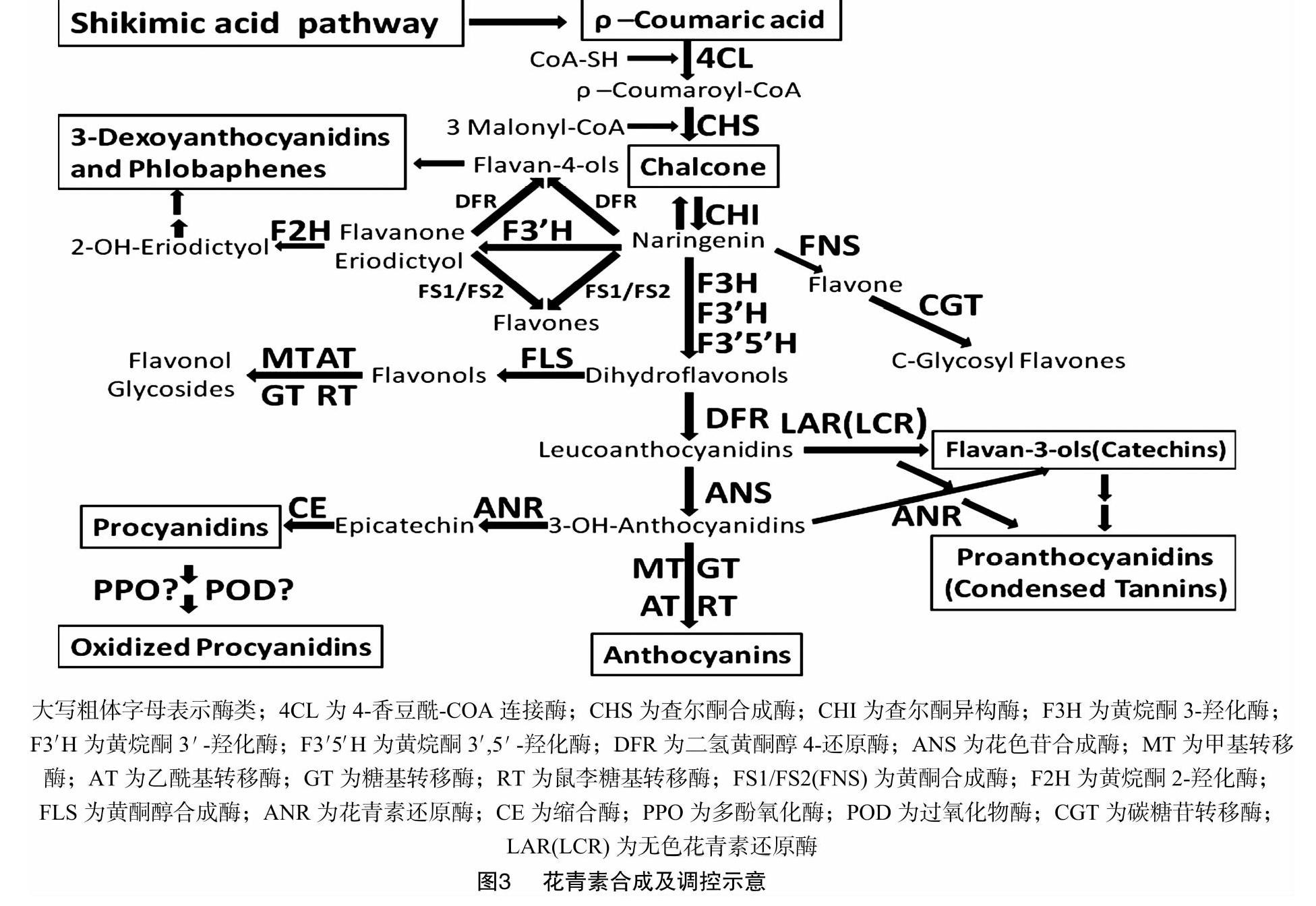
目前,關于花青素合成途徑已經研究得比較清楚,前人研究表明,花青素為類黃酮代謝的最終產物,花青素在植物中的合成主要發生在內質網膜上,是由一系列基因調控合成的(圖3),主要包括結構基因、調節基因和轉運子基因[21,45-49]。其中,結構基因包括苯丙氨酸解氨酶(PAL)、查爾酮合成酶(CHS)、查爾酮異構酶(CHI)、黃烷酮3-羥化酶(F3H)、黃酮3′-羥化酶(F3′H)、類黃酮3′,5′-羥化酶(F3′5′H)、二氫黃酮醇-4-還原酶(DFR)、花青素還原酶(ANR)、黃酮醇合成酶(FLS)、無色花色素雙加氧酶、花青素合成酶(LDOX/ANS)等;調節基因包括R2R3-MYB、WD40和MYC家族的bHLH等[33,45-57];轉運子基因包括谷胱甘肽轉移酶(glutathione S-transferases,簡稱GST)或者多藥和有毒化合物排出家族(multidrug and toxic compound extrusion,簡稱MATE)[45]。
花青素的代謝途徑主要有3個:花青素產生途徑、原花青素產生途徑和鞣紅(鞣酐)產生途徑,這3個途徑與紫粒、藍粒、紅粒、黃粒、黑粒大麥的形成有關。花青素產生途徑:前人對花青素產生途徑的研究已經十分清晰,莽草酸途徑產物苯丙氨酸在多種酶和轉錄因子的參與下合成了花青素[20-21,31,46-49,55-57]。紫粒、藍粒、紅粒大麥的形成主要是由此途徑產生的。研究表明,在大麥籽粒中花青素積累在糊粉層就形成了藍粒大麥,花青素積累在籽粒的果皮和穎片中形成了紫粒、紅粒大麥[21,23]。原花青素(proanthocyanidins)主要是由3個途徑產生的。(1)在形成無色花青素(leucoanthocyanidins)后在無色花色素雙加氧酶/花青素合成酶(LDOX/ANS)的催化下形成黃烷-3-醇(flavan-3-ols),即兒茶素、兒茶酚(catechins),兒茶酚經過一系列的縮合反應形成原花青素[16,52];(2)在形成無色花青素后直接在花青素還原酶(ANR)的作用下生成原花青素[16,52];(3)在形成3-OH-花色苷(3-OH-anthocyanidins)后在花青素還原酶(ANR)催化下形成表兒茶素(epicatechin),在縮合酶(CE)的作用下形成原花青素,在大麥籽粒中,當原花青素積累在外種皮中,就產生了黃粒大麥[21]。鞣紅(phlobaphenes)或者鞣酐產生途徑:黑粒大麥的形成機制比較復雜,此通路中可能存在4種途徑。(1)在莽草酸途徑中主要形成的咖啡酸(caffeic acid)和阿魏酸(ferulic acid)與青稞黑色素的形成有關;(2)在形成4,5,7-三羥基黃烷酮(naringenin)后,在二氧黃酮醇-4-還原酶(DFR)的作用下,被還原成黃烷-4-醇(flavan-4-ols),再在一系列的轉化下形成鞣紅(phlobaphenes),也叫鞣酸[21,52];(3)在形成無色花青素后在無色花色素雙加氧酶/花青素合成酶(LDOX/ANS)的催化下形成黃烷-3-醇(flavan-3-ols),即兒茶素, 也稱兒茶酚,而兒茶酚縮合形成鞣酐(phlobaphenes)[52];(4)這是比較重要的一種通路,在形成3-OH-花色苷(3-OH-anthocyanidins)后在花青素還原酶(ANR)催化下形成表兒茶素,在縮合酶(CE)的作用下形成原花青素,在多酚氧化酶(PPO)和過氧化物酶(POD)的作用下形成被氧化的原花青素,它使植物的種子呈現棕色[45]。推測當鞣紅或者鞣酐積累在穎片或果皮中,就產生了黑粒大麥[17]。
楊希娟等報道,不同粒色青稞中的酚類化合物主要以酚酸的形式存在,其中結合酚是有色青稞酚酸的主要存在形式,黑色青稞具有較高的酚類化合物含量[58]。杜道坤等報道,鞣質主要是由多酚類化合物組成的,此處生成的鞣質可能為縮合型鞣質[12,59-60]。Shoeva等報道,黑粒大麥粒色的形成與黃酮類化合物無關,與酚醛類化合物的聚合和氧化產物有關,它是一種無規則的高分子聚合物[21]。鞣質的分子量為500~3 000 u,是能沉淀生物堿、蛋白質的水溶性多酚類化合物[61],它是羥基黃烷類單體的縮合物[59]。所以,本文推測鞣紅或鞣酐在大麥籽粒的糊粉層和胚乳中的積累與黑色大麥的形成有關。
3?有色大麥(青稞)粒色基因的定位研究進展
將作物群體按照其子代性狀的遺傳穩定的特征,可分為短暫性子代群體,如BC1、BC2、F2、F3等,以及永久性子代群體,如RI、DH、NILs等[62-63]。
分子標記技術屬于低通量測序的一種技術,主要分為隨機引物的標記,如隨機擴增多態性DNA(RAPD)、簡單重復序列區間(ISSR)等;限定引物的標記,如簡單重復序列(SSR)、序列標簽位點(STS)等[64]。對此國內外有許多研究,在國外Shoeva等選用紫色、黑色和無色大麥(青稞)的NILs(近等基因系)群體用微衛星基因分型技術將大麥的紫粒基因(HvPLP)定位到1H染色體上,將黑粒基因(HvBLP)定位到2H染色體上[21]。Jia等選用大麥(青稞)的黑粒和紫粒的F2、F3群體,將大麥(青稞)黑粒基因定位在1HL染色體上,將紫粒基因(HvPRE2)分別定位到2H、1H染色體上,并且驗證得出大麥黑粒屬于質量性狀[15]。Jia等提出特異位點擴增片段分離群體分組分析法測序(SLAF-seq-BSA)方法在識別候選區域和發現特定靶向基因組區域的多態標記方面比較有優勢,將控制黑色大麥(青稞)外稃和/或果皮的HvBLP1基因定位在1號染色體的1.66 Mb以內[65]。筆者所在課題組的Yao等利用涅如姆扎(紫粒)與昆侖10號(白粒)雜交構建DH(203個株系),測量親本和子代的籽粒顏色;使用基因型分型測序(GBS-seq)技術構建高密度遺傳圖譜,定位到6個與青稞紫粒相關的數量性狀座位(QTL),對區段內的基因進行基因注釋,并篩選出了候選基因[22]。Zong等分析白粒小麥和紫粒小麥中TaMYC1的序列差異,該基因在白粒和紫粒小麥的啟動子序列中重復次數不一致,所以導致了小麥粒色的差異[66]。Jiang等對于黑小麥76個不同時期及處理的紫色與白色果皮樣品進行了轉錄組測序,發掘出TaPpm1與TaPpb1候選基因作為黑小麥籽粒顏色花青素調控的候選基因[67]。
4?展望
對于大麥籽粒顏色的相關研究一直是國內外比較熱門的方向,但是將高通量測序技術[68]與大麥籽粒顏色耦合起來的研究相對較少,青稞也存在這樣的問題。目前,青稞的品種選育方法仍然是以常規的雜交育種為主,隨著分子生物學技術的發展,分子標記育種也逐漸融入到青稞新品種選育的過程中。但是限制性片段長度多態性(RFLP)、RAPD、擴增片段長度多態性(AFLP)、SSR[69]、ISSR等傳統的分子標記技術得到的遺傳圖譜不夠精細且定位到的候選基因區段過大,因此可以采用特異性位點擴增片段測序(SLAF-seq)、轉錄組測序(RNA-seq)、GBS-seq等高通量的測序技術來深度挖掘青稞籽粒顏色相關基因。另外,可以利用挖掘的控制籽粒顏色的基因與基因編輯技術CRISPR結合起來,直接進行基因編輯產生新的作物品種。
參考文獻:
[1]徐?菲,黨?斌,楊希娟,等. 不同青稞品種的營養品質評價[J]. 麥類作物學報,2016,36(9):1249-1257.
[2]劉新紅,楊希娟,吳昆侖,等. 青稞品質特性及加工利用現狀分析[J]. 農業機械,2013(14):49-53.
[3]華?為,朱靖環,尚?毅,等. 有色大麥研究進展[J]. 植物遺傳資源學報,2013,14(6):1020-1024.
[4]Morrell P L,Gonzales A M,Meyer K K,et al. Resequencing data indicate a modest effect of domestication on diversity in barley:a cultigen with multiple origins[J]. Journal of Heredity,2014,105(2):253-264.
[5]Sun D F,Xu T W,Zhang G P,et al. Exploiting and utilizing the novel annual wild barleys germplasms on the Qing-Tibetan Plateau[M]// Zhang G P,Li C D,Liu X.Advance in barley sciences.Netherlands:Springer,2013:99-113.
[6]張?帥,吳昆侖,姚曉華,等. 不同粒色青稞營養品質與抗氧化活性物質差異性分析[J]. 青海大學學報,2017,35(2):19-27.
[7]劉尚武. 青海植物志[M]. 西寧:青海人民出版社,1996.
[8]段瑞君,陳國雄,吳昆侖,等. 青稞種子蛋白組研究[C]//中國遺傳學會.遺傳多樣性:前沿與挑戰——中國的遺傳學研究(2013—2015)—2015中國遺傳學會大會論文摘要匯編,2015:1.
[9]強小林,遲德釗,馮繼林. 青藏高原區域青稞生產與發展現狀[J]. 西藏科技,2008(3):11-17.
[10]張唐偉,余耀斌,拉?瓊. 西藏不同青稞品種的品質差異分析[J]. 大麥與谷類科學,2017,34(1):28-32,41.
[11]Mascher M,Richmond T A,Gerhardt D J,et al. Barley whole exome capture:a tool for genomic research in the genus Hordeum and beyond[J]. Plant Journal,2013,76(3):494-505.
[12]杜道坤,賀?娟,孟利東,等. 黑青稞花色苷提取及抗氧化活性的分析[J]. 江蘇農業科學,2017,45(18):173-179.
[13]Moreau R A,Wayns K E,Flores R A,et al. Tocopherols and tocotrienols in barley oil prepared from germ and other fractions from scarification and sieving of hulless barley[J]. Cereal Chemistry,2007,84(6):587-592.
[14]Pengkumsri N,Chaiyasut C,Saenjum C,et al. Physicochemical and antioxidative properties of black,brown and red rice varieties of northern Thailand[J]. Food Science and Technology,2015,35(2):331-338.
[15]Jia Q J,Zhu J H,Wang J M,et al. Genetic mapping and molecular marker development for the gene Pre2 controlling purple grains in barley[J]. Euphytica,2016,208(2):215-223.
[16]Aastrup S,Outtrup H,Erdal K. Location of the proanthocyanidins in the barley grain[J]. Carlsberg Research Communications,1984,49(1):105-109.
[17]Harlan H V. Some distinctions in our cultivated barleys with reference to their use in plant breeding[D]. Minnesota:University of Minnesota,1914.
[18]Khlestkina E K. Adaptive role of flavonoids:emphasis on cereals[J]. Cereal Research Communications,2013,41(2):185-198.
[19]徐廷文,馬得泉,顧茂芝,等. 西藏山南地區大麥種質資源的分類和分布[J]. 中國農業科學,1984,17(2):41-48.
[20]Himi E,Taketa S. Isolation of candidate genes for the barley Ant1 and wheat Rc genes controlling anthocyanin pigmentation in different vegetative tissues[J]. Molecular Genetics and Genomics,2015,290(4):1287-1298.
[21]Shoeva O Y,Mock H P,Kukoeva T V,et al. Regulation of the flavonoid biosynthesis pathway genes in purple and black grains of Hordeum vulgare[J]. PLoS One,2016,11(10):e0163782.
[22]Yao X H,Wu K L,Yao Y H,et al. Construction of a high-density genetic map:genotyping by sequencing (GBS) to map purple seed coat color (Psc) in hulless barley[J]. Hereditas,2018,155:37.
[23]趙啟明,李?范,李?萍. 花青素生物合成關鍵酶的研究進展[J]. 生物技術通報,2012(12):25-32.
[24]Sakata K,Saito N,Toshio H. Ab initio study of molecular structures and excited states in anthocyanidins[J]. Tetrahedron,2006,62(15):3721-3731.
[25]Tanaka Y,Ohmiya A. Seeing is believing:engineering anthocyanin and carotenoid biosynthetic pathways[J]. Current Opinion in Biotechnology,2008,19(2):190-197.
[26]白衛濱,朱翠娟,胡云峰,等. 花色苷對慢性疾病營養干預分子機制的研究進展[J]. 食品與生物技術學報,2016,35(10):1009-1019.
[27]Deng D M,Shu W S,Zhang J,et al. Zinc and cadmium accumulation and tolerance in populations of Sedum alfredii[J]. Environmental Pollution,2007,147(2):381-386.
[28]Zhang Y,Zheng S,Liu Z,et al. Both HY5 and HYH are necessary regulators for low temperature-induced anthocyanin accumulation in Arabidopsis seedlings[J]. Journal of Plant Physiology,2011,168(4):367-374.
[29]Hatier J H B,Gould K S. Anthocyanin function in vegetative organs[M]//Anthocyanins. New York:Springer,2008:1-19.
[30]王?宇. 短波長光質誘導津田蕪菁花青素合成相關基因差異表達機制研究[D]. 哈爾濱:東北林業大學,2013.
[31]Winkel-Shirley B. Flavonoid biosynthesis.A colorful model for genetics,biochemistry,cell biology,and biotechnology[J]. Plant Physiology,2001,126(2):485-493.
[32]Kui L W,Bolitho K,Grafton K,et al. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae[J]. BMC Plant Biology,2010,10(1):50.
[33]Li W D,Shan F,Sun S C,et al. Free radical scavenging properties and phenolic content of Chinese black-grained wheat[J]. Journal of Agricultural and Food Chemistry,2005,53(22):8533-8536.
[34]Manach C,Mazur A,Scalbert A. Polyphenols and prevention of cardiovascular diseases[J]. Current Opinion in Lipidology,2005,16(1):77-84.
[52]Khlestkina E K,Shoeva O Y,Gordeeva E I. Flavonoid biosynthesis genes in wheat[J]. Russian Journal of Genetics:Applied Research,2015,5(3):268-278.
[53]Sudarshan G P,Kulkarni M,Akhov L A,et al. QTL mapping and molecular characterization of the classical D locus controlling seed and flower color in Linum usitatissimum (flax)[J]. Scientific Reports,2017,7(1):15751.
[54]陳?清. 黑莓花青素苷、原花色素的合成代謝及相關基因克隆和表達研究[D]. 雅安:四川農業大學,2012.
[55]趙云榮,王世雷. 植物花青素研究進展[J]. 安徽農業科學,2008,36(8):3095-3097.
[56]周生茂,王玲平,向?珣,等. 山藥ANS基因的克隆和分子特性及其與花青素積累的關系[J]. 園藝學報,2009,36(9):1317-1326.
[57]李海芬,邱金梅,陳小平,等. 花生花青素合成相關基因的表達與種皮顏色關系[J]. 中國油料作物學報,2017,39(5):600-605.
[58]楊希娟,黨?斌,徐?菲,等. 不同粒色青稞酚類化合物含量與抗氧化活性的差異及評價[J]. 中國糧油學報,2017,32(9):34-42.
[59]石?碧,狄?瑩,何有節,等. 鞣質的藥理活性[J]. 中草藥,1998,29(7):487-490.
[60]李海霞,王?釗,劉延澤. 石榴科植物化學成分及藥理活性研究進展[J]. 中草藥,2002,33(8):765-766.
[61]陳會良,顧有方,王月雷. 中草藥化學成份與抗氧化活性的研究進展[J]. 中國中醫藥科技,2006,13(1):63-64.
[62]張?合. 不同遺傳來源甘藍型黃籽油菜粒色的遺傳及其差異[D]. 重慶:西南大學,2008.
[63]達瓦頓珠,尼瑪扎西,其美旺姆,等. 淺談西藏青稞育種的新思路[J]. 西藏農業科技,2010,32(增刊1):1-3.
[64]張玉清. 分子標記在青稞中的應用現狀及前景[J]. 種子,2011,30(8):86-88.
[65]Jia Q J,Wang J M,Zhu J H,et al. Toward identification of black lemma and pericarp gene Blp1 in barley combining bulked segregant analysis and specific-locus amplified fragment sequencing[J]. Frontiers in Plant Science,2017,8:1414.
[66]Zong Y,Xi X Y,Li S M,et al. Allelic variation and transcriptional isoforms of wheat TaMYC1 gene regulating anthocyanin synthesis in pericarp[J]. Frontiers in Plant Science,2017,8:1645.
[67]Jiang W H,Liu T X,Nan W Z,et al. Two transcription factors TaPpm1 and TaPpb1 co-regulate anthocyanin biosynthesis in purple pericarps of wheat[J]. Journal of Experimental Botany,2018,69(10):2555-2567.
[68]高?弢,史建榮. 基于高通量測序技術分析麝香草酚處理禾谷鐮孢菌后轉錄組學的變化[J]. 江蘇農業學報,2017,33(6):1257-1265.
[69]董玲霞,蘇一鈞,戴習彬,等. 基于SSR分子標記的甘薯地上部專用品種遺傳多樣性分析[J]. 江蘇農業學報,2018,34(4):741-746.

