紅豆淀粉-脂質(zhì)復合物結(jié)構(gòu)及體外消化性質(zhì)
郭宏偉,趙城彬,吳玉柱,張 浩,張隋鑫,李 妍,許秀穎*,劉景圣*
(吉林農(nóng)業(yè)大學食品科學與工程學院,小麥和玉米深加工國家工程實驗室,吉林 長春 130118)
紅豆(Vigna angularis)在我國種植廣泛,其營養(yǎng)成分豐富,主要成分為淀粉,其淀粉質(zhì)量分數(shù)在41.83%~59.89%之間[1]。脂肪酸是食品的重要組成成分,影響食品品質(zhì)。淀粉與脂肪酸可以復合形成淀粉-脂質(zhì)復合物,改善淀粉加工性質(zhì)、提高品質(zhì)特性、增加功能特性,提高淀粉的穩(wěn)定性和抗老化性能,降低淀粉在水中的溶解度[2];淀粉-脂質(zhì)復合物因具有抗消化性又被稱RS5型抗性淀粉(resistant starch,RS),具有降血糖、預防結(jié)腸癌和肥胖等多種生理功能[3-4]。
淀粉-脂質(zhì)復合物的制備方法主要有快速黏度分析法、水浴加熱法、HCl/KOH法、二甲亞砜(dimethyl sulfoxide,DMSO)分散法、擠壓蒸煮法等[5-7]。常豐丹[8]研究了脂質(zhì)加入方式對淀粉-脂質(zhì)復合物的影響,結(jié)果發(fā)現(xiàn)先熱處理淀粉再加入脂肪酸這種制備方法較先將脂肪酸與淀粉混合后再加熱更利于淀粉-脂質(zhì)復合物的形成。Le-Bail等[9]將脂肪酸包埋在淀粉中,在500 MPa、40 ℃下處理20 min,得到淀粉-脂質(zhì)復合物。Bienkiewicz等[10]將魚類脂質(zhì)與糊化淀粉溶液混合,在90 W、2 450 Hz下微波爐加熱處理4 min,得到淀粉-脂質(zhì)復合物。Lalush等[11]采用水/DMSO和KOH/HCl絡(luò)合方法制備直鏈淀粉-亞油酸復合物,發(fā)現(xiàn)前種方法制得的樣品結(jié)晶度大于后者。
Marinopoulou等[12]研究發(fā)現(xiàn)高直鏈玉米淀粉與脂肪酸復合時形成典型的V型晶體,并且隨著制備溫度的增加,淀粉-脂質(zhì)復合物的結(jié)晶度增加,而晶體尺寸減小。Vasiliadou等[13]研究表明,直鏈淀粉-脂肪酸復合的程度與脂肪酸鏈長度有關(guān),即脂肪酸鏈長度越短,直鏈淀粉與脂肪酸的相互作用越強。Farooq等[14]研究發(fā)現(xiàn)淀粉-脂質(zhì)復合物的形成降低了大米淀粉的體外消化率,增加了抗性淀粉含量,同時降低了快速和慢速消化淀粉含量。因此,淀粉-脂質(zhì)復合物對于調(diào)節(jié)血糖、血脂,調(diào)控消化功能,以及為淀粉健康食品的開發(fā)提供新方向。但是,目前豆類淀粉與脂肪酸復合物的特性研究不夠深入,特別是缺乏豆類淀粉與脂肪酸在結(jié)構(gòu)與消化性能之間關(guān)系的研究。
本實驗在實驗室前期研究的基礎(chǔ)上,先對紅豆淀粉(adzuki starch,AS)進行微波處理,再分別添加硬脂酸、棕櫚酸、油酸、亞油酸4 種脂肪酸到淀粉溶液中,使用水浴加熱的方法制備AS-脂質(zhì)復合物,對4 種AS-脂質(zhì)復合物形態(tài)結(jié)構(gòu)、熱性質(zhì)、晶體結(jié)構(gòu)、消化特性等方面進行研究,為脂肪酸在豆類淀粉的加工應(yīng)用以及制備RS5型抗性淀粉提供參考依據(jù)。
1 材料與方法
1.1 材料與試劑
紅小豆為市售;棕櫚酸(palmitic acid,PA)、硬脂酸(stearic acid,SA) 天津市光復精細化工研究所;油酸(oleic acid,OA)(純度97%)、亞油酸(linoleic acid,LA)(純度97%) 美國Sigma公司;豬胰α-淀粉酶(45.5 U/mg) 合肥博美生物科技有限責任公司;糖化酶(105U/mL) 酷爾化學科技有限公司;總淀粉、直鏈淀粉/支鏈淀粉、D-葡萄糖(GOPOD法)檢測試劑盒 愛爾蘭Megazyme公司。
1.2 儀器與設(shè)備
微波爐 廣東美的廚房電器制造有限公司;Alpha1-4LDplus冷凍干燥機 德國Christ公司;Phenom Pro臺式掃描電子顯微鏡(scanning electron microscope,SEM) 復納科學儀器(上海)有限公司;Q2000差示掃描量熱(differential scanning calorimeter,DSC)儀美國TA公司;VERTEX 70傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,F(xiàn)T-IR)儀 德國Bruker公司;D/max200PC X射線衍射(X-ray diffraction,XRD)儀 日本理學公司;恒溫水浴振蕩搖床 上海精宏實驗設(shè)備有限公司;Allegra X-30高速離心機 美國Beckman公司;Spectramax190全波長酶標儀 美國Molecular Devices公司。
1.3 方法
1.3.1 AS提取
參考李冠華等[15]的堿提法,并做適當改動:稱取紅小豆→浸泡4.5 h(料液比1∶7)→去皮→打碎磨漿→過濾(棄濾渣)→調(diào)pH 9.0→攪拌→靜置0.5 h(棄上層蛋白液)→加水攪拌→過濾→靜置(棄上層液)→干燥→粉碎→淀粉成品。
1.3.2 AS的基本營養(yǎng)成分測定
采用總淀粉和直鏈淀粉/支鏈淀粉檢測試劑盒測定AS的總淀粉與直鏈淀粉的質(zhì)量分數(shù)[16]。脂肪質(zhì)量分數(shù)測定:參照GB 5009.6—2016《食品安全國家標準 食品中脂肪的測定》中的索氏抽提法;蛋白質(zhì)量分數(shù)測定:參照GB 5009.5—2016《食品安全國家標準 食品中蛋白質(zhì)的測定》中的自動凱氏定氮儀法;灰分質(zhì)量分數(shù)測定:參照GB/T 22427.1—2008《淀粉灰分測定》。
1.3.3 AS-脂質(zhì)復合物樣品的制備
在實驗室前期研究的基礎(chǔ)上進行AS-脂質(zhì)復合物的制備:稱取10 g AS,將AS與蒸餾水配成質(zhì)量濃度為10 g/100 mL溶液,放置在微波爐中,設(shè)置微波功率500 W、作用時間50 s,取出后與AS干基質(zhì)量1.5%的PA、SA、OA、LA混合,95 ℃水浴攪拌30 min取出,用體積分數(shù)50%的乙醇溶液洗滌3 次并離心,除去未與AS復合的脂肪酸,冷凍干燥樣品,分別得到AS-PA、AS-SA、AS-OA、AS-LA。不加入脂肪酸,在相同條件下處理淀粉得到的樣品即為對照AS。
1.3.4 形態(tài)觀察
將AS-脂質(zhì)復合物及對照AS分布在載物臺的導電雙面膠上,噴金處理120 s后,于SEM下觀察,選取最佳角度與放大倍數(shù)觀察樣品的形貌狀態(tài)。
1.3.5 熱特性分析
用DSC儀分析樣品的熱特性及結(jié)構(gòu)特性。參考Koo等[17]的方法并適當改動:加熱速率5 ℃/min,溫度范圍為30~140 ℃。取2 mg樣品,加20 mg高純水,壓片,在室溫下平衡24 h。N2流速為50 mL/min,以空坩堝作參比。
1.3.6 FT-IR分析
使用FT-IR儀測定樣品的結(jié)構(gòu)。參考Zhao Chengbin等[18]的方法并作部分改動:稱取1 mg已干燥至恒質(zhì)量的樣品與150 mg溴化鉀在紅外燈下研磨混合均勻,置于模具中在15 MPa下抽真空壓片60 s。扣除溴化鉀薄片背景,在4 000~400 cm-1范圍內(nèi)掃描64 次,分辨率為4 cm-1,得到FT-IR圖。
1.3.7 XRD測定
將樣品放在玻璃凹槽內(nèi),用壓片壓緊,使樣品平整鋪在凹槽處,測試條件參考徐澎聰?shù)萚19]方法。測定參數(shù)為管壓40 kV、管流40 mA、2θ掃描范圍4°~40°、掃描速率5°/min。
1.3.8 消化特性測定
參考Englyst等[20]的方法并做適當改動:稱取0.2 g樣品于錐形瓶中,加入15 mL 0.2 mol/L醋酸鈉緩沖液(pH 5.2),混勻后加入10 mL酶混合液(含290 U/mL豬胰α-淀粉酶和15 U/mL糖化酶),37 ℃恒溫水浴中振蕩120 min。在20、120 min各取0.5 mL酶解液,加入4 mL無水乙醇,于4 000 r/min離心10 min。取上清液,采用D-葡萄糖檢測試劑盒測定葡萄糖質(zhì)量濃度。根據(jù)式(1)~(3)分別計算AS-脂質(zhì)復合物的快速消化淀粉(rapidly digested starch,RDS)、慢速消化淀粉(slowly digestible starch,SDS)和RS的質(zhì)量分數(shù)。

式中:ρ0為淀粉酶解前葡萄糖質(zhì)量濃度/(mg/mL);ρ20為酶解20 min時葡萄糖質(zhì)量濃度/(mg/mL);ρ120為酶解120 min時葡萄糖質(zhì)量濃度/(mg/mL);V為反應(yīng)體系總體積/mL;m為樣品中淀粉質(zhì)量/mg。
1.4 數(shù)據(jù)處理與分析
實驗數(shù)據(jù)采用Microsoft Excel 2010和Origin 8.5軟件完成,結(jié)果以表示;采用DPS V7.65軟件用Tukey法進行差異顯著性分析,P<0.05表示差異顯著。
2 結(jié)果與分析
2.1 AS基本營養(yǎng)成分測定結(jié)果

表 1 AS基本營養(yǎng)成分Table 1 Chemical composition of adzuki starch
由表1可知,AS中總淀粉質(zhì)量分數(shù)為(93.10±0.64)%,直鏈淀粉質(zhì)量分數(shù)為(31.30±0.72)%,脂肪質(zhì)量分數(shù)為(0.35±0.03)%,蛋白質(zhì)量分數(shù)為(0.26±0.03)%,灰分質(zhì)量分數(shù)為(0.17±0.01)%。
2.2 SEM觀察結(jié)果
由圖1可知,應(yīng)用SEM觀察樣品發(fā)現(xiàn),經(jīng)過加熱處理后的4 種AS-脂肪酸復合物與未加入脂肪酸的AS相比,顆粒形態(tài)發(fā)生明顯改變。對照AS的表面較為平整,呈現(xiàn)片狀或塊狀,表面積較小,沒有大量顆粒的聚集(圖1A)。與脂質(zhì)復合后,淀粉形貌發(fā)生明顯改變,淀粉顆粒破壞更明顯,形成了更加不規(guī)則的形狀,體積增大、外形差異大、表面粗糙、凹凸不平,顆粒內(nèi)部多孔洞,這可能利于脂肪酸的插入,有利于復合(圖1B~E)。
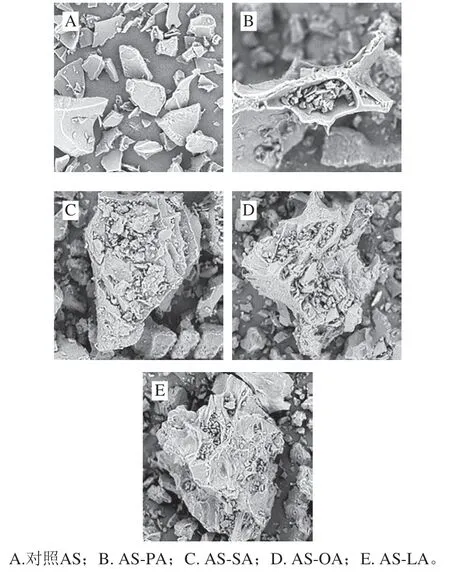
圖 1 AS及AS-脂質(zhì)復合物的SEM圖(×2 000)Fig. 1 SEM images of adzuki starch and starch-lipid complexes (× 2 000)
2.3 熱特性分析結(jié)果
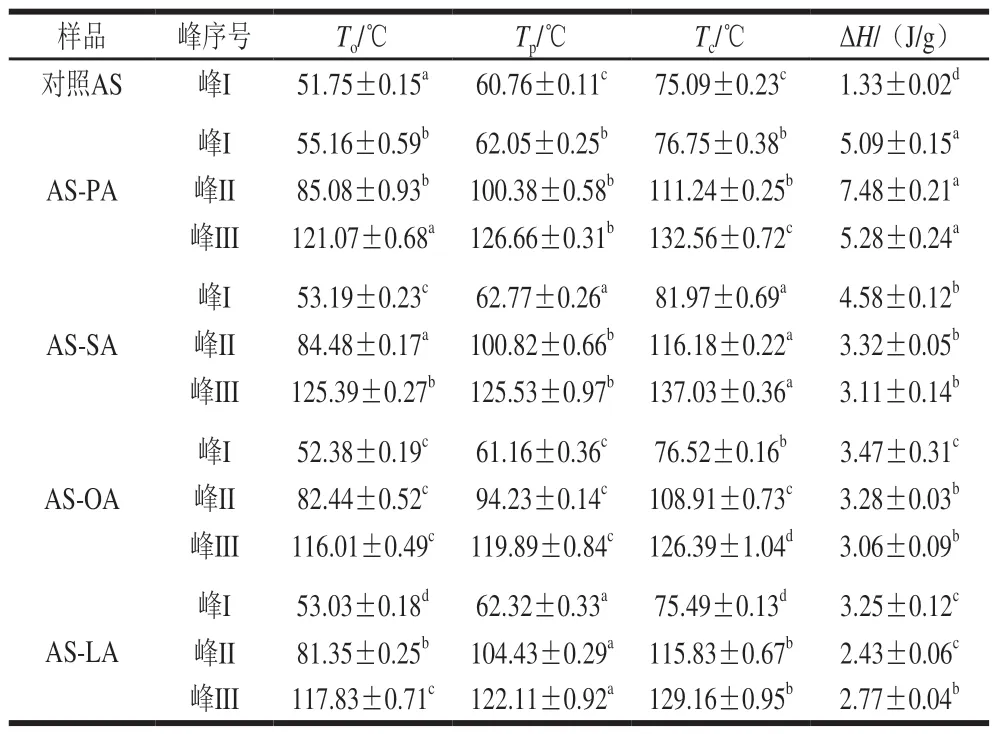
表 2 AS與AS-脂質(zhì)復合物的相變溫度及焓Table 2 Phase transition temperature and enthalpy of adzuki starch and starch-lipid complexes
采用DSC測定淀粉的熱相變過程,可以反映結(jié)構(gòu)的變化。由表2可知,對照AS在30~140 ℃升溫過程中有1 個吸熱峰,4 種AS-脂質(zhì)復合物均存在3 個吸熱峰。峰I是淀粉的糊化吸熱峰,淀粉顆粒在糊化過程中吸水使氫鍵斷開,結(jié)晶結(jié)構(gòu)受到破損,伴隨著吸熱現(xiàn)象。在添加脂肪酸后,AS-SA、AS-OA、AS-LA、AS-LA分別比對照AS的To高3.41、1.44、0.63、1.28 ℃(P<0.05),Tp高1.29、2.01、0.40、1.56 ℃(除AS-LA外均差異顯著,P<0.05),Tc高1.66、6.88、1.43、0.40 ℃(P<0.05),ΔH高3.76、3.25、2.14、1.92 J/g(P<0.05),表明添加這4 種脂肪酸抑制了淀粉的糊化。峰II和峰III為淀粉-脂質(zhì)復合物的相變吸熱峰。峰II為I型淀粉-脂質(zhì)復合物解旋熔融的吸收峰,其熔點比II型淀粉-脂質(zhì)復合物低,為非晶結(jié)構(gòu);峰III是II型淀粉-脂質(zhì)復合物解旋熔融的吸收峰,熔點較高,其又可以分為IIa型和IIb型復合物,且復合物的含量與ΔH相關(guān),同時,ΔH的增加也與抗性淀粉含量的增加有關(guān)[21-22]。IIa型相變溫度大概在115~120 ℃,IIb型溫度則更高。由表2可知,4 種AS-脂質(zhì)復合物均是由I型和II型復合物共同構(gòu)成。I型復合物通常為緩慢消化淀粉,II型復合物特別是IIb型復合物為抗性淀粉。不同脂肪酸碳鏈長度與淀粉的作用程度也不相同,這是PA(C16:0)與SA(C18:0)產(chǎn)生不同作用效果的主要原因。長鏈脂肪酸隨著碳鏈長度的增加,親水性變得越來越差,使得脂肪酸在淀粉體系的分散變差,從而降低了二者接觸的可能性[23]。SA、OA、LA均含有18 個碳原子,與AS作用后,ΔH依次為AS-SA>AS-OA>AS-LA,說明SA與AS復合率更大,LA與AS復合率最小,這是由于SA為飽和脂肪酸,OA含有1 個不飽和雙鍵,而LA有兩個不飽和雙鍵,雙鍵的存在會產(chǎn)生空間阻礙的作用,使得復合率降低。復合熔融溫度范圍(Tc~To)越大,表明淀粉顆粒晶體的多樣性越多[24]。
2.4 FT-IR分析結(jié)果
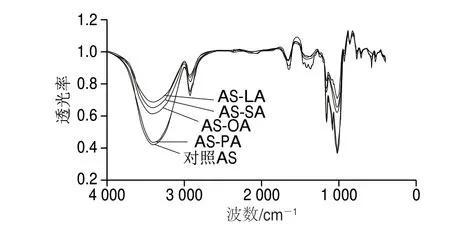
圖 2 AS及AS-脂質(zhì)復合物的FT-IR圖Fig. 2 FT-IR of adzuki starch and starch-lipid complexes
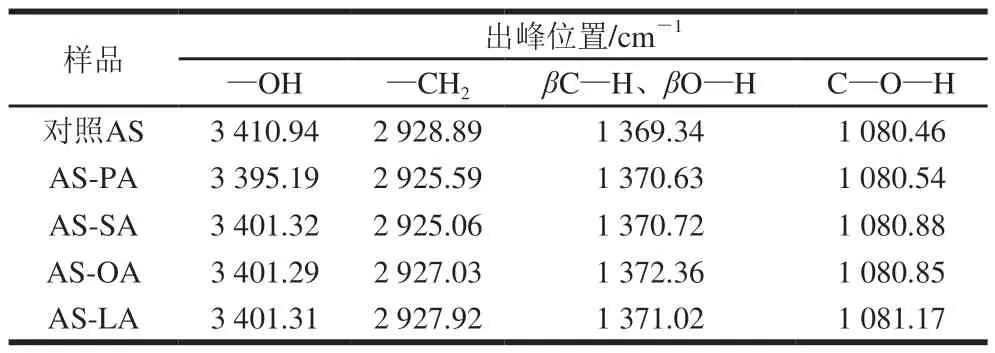
表 3 AS與AS-脂質(zhì)復合物的FT-IR解析Table 3 FT-IR analysis of adzuki starch and starch-lipid complexes
由圖2可知,5 種樣品的FT-IR圖相似,沒有新基團特征峰的生成,說明在AS與脂肪酸的結(jié)合時,沒有發(fā)生化學反應(yīng),而是依靠疏水作用力形成結(jié)合。表3是樣品可能含有的官能團及其出峰位置。不同樣品的特征峰出峰位置有所偏移。1 703 cm-1附近是C=O的振動峰,1 240~1 249 cm-1附近是—COOH的振動峰,這兩處峰是游離脂肪酸的特征峰,圖2中未出現(xiàn)這兩處振動峰,這是由于AS與脂肪酸形成的復合物屏蔽了脂肪酸的振動峰[25]。與對照AS相比,AS-脂質(zhì)復合物在3 410.94 cm-1的—OH振動峰向低波數(shù)處移動,發(fā)生紅移,—OH穩(wěn)定性增強,這是由于AS與脂肪酸復合時通過氫鍵發(fā)生作用,氫鍵的結(jié)合增多說明AS-脂質(zhì)復合物的形成。AS-PA的—OH振動峰向低波數(shù)處移動的距離大于AS-SA、AS-OA、AS-LA,說明PA與AS復合率更高。氫鍵穩(wěn)定性增強使AS與脂肪酸的結(jié)合更牢固,可能造成了RS含量的增加。2 928.89 cm-1處為淀粉—CH2的伸縮振動峰[26]。與對照AS相比,AS-脂質(zhì)復合物中—CH2伸縮振動峰也發(fā)生紅移,表明AS與脂肪酸—CH2基團的重疊引起—CH2穩(wěn)定性增強。AS-SA的—CH2基團吸收峰波數(shù)AS-OA、AS-LA,說明飽和脂肪酸與AS復合能力更強。AS-脂質(zhì)復合物在1 080.46 cm-1處的C—O—H吸收峰稍向高波數(shù)處移動,說明復合物的形成使C—O—H穩(wěn)定性降低。在1 369.34 cm-1處的C—H、O—H彎曲振動峰向高波數(shù)處略微移動,說明復合物的形成輕微增加了C—H、O—H的彎曲振動。
2.5 XRD分析結(jié)果
淀粉是多晶體系,主要可以分為結(jié)晶區(qū)與非結(jié)晶區(qū)。淀粉由于結(jié)晶結(jié)構(gòu)的差異生成不同類型特征的XRD圖。有尖峰特征的是結(jié)晶區(qū),彌散特征的為非結(jié)晶區(qū)。淀粉結(jié)晶結(jié)構(gòu)有A、B、C、V型。其中V型鮮少存在于天然淀粉中,主要是通過直鏈淀粉與脂肪酸、碘、乳化劑等混合獲得[27]。淀粉與復合物的晶型可以通過衍射峰位置判斷。A型晶體在15°、17°、18°、23°處有強衍射峰,B型晶體在5.6°、17°、22°、24°處有強衍射峰,V型晶體在7.6°、12.8°、19.8°附近有強衍射峰[28-29]。徐向東[1]測得AS在15.21°、17.18°、22.91°處有強衍射峰,判斷AS為A型晶體結(jié)構(gòu),經(jīng)熱處理后,晶體結(jié)構(gòu)有所消失。

圖 3 AS及AS-脂質(zhì)復合物的XRD圖Fig. 3 XRD patterns of adzuki starch and starch-lipid complexes
由圖3可知,與對照AS相比,AS-脂質(zhì)復合物在17°處的衍射峰強度明顯降低,在19.8°附近有強衍射峰,在12.8°附近有弱衍射峰,出現(xiàn)的新峰表明復合物產(chǎn)生了V型晶體的特征峰。這是由于在復合物形成后的冷卻過程中,脂肪酸的疏水基團在直鏈淀粉的螺旋腔內(nèi)參與了淀粉重結(jié)晶,形成獨特的V型晶體結(jié)構(gòu)[30]。常豐丹[8]研究發(fā)現(xiàn)在溫度為80 ℃時,制備的高鏈玉米淀粉-月桂酸復合物為B型晶體結(jié)構(gòu)占主導,隨著溫度的升高,V型結(jié)構(gòu)特征峰增強。AS-OA在22.08°、24.12°出現(xiàn)衍射峰,可能是游離OA聚集成的結(jié)晶峰;AS-PA在21.77°、24.21°出現(xiàn)衍射峰,這可能是游離的PA聚集而成的結(jié)晶峰,乙醇溶液洗滌并未將溶解度低的脂肪酸完全除去,這與陳海華等[25]研究的結(jié)果相似。AS-PA、AS-SA、AS-OA的V型結(jié)果特征峰強度明顯高于AS-LA,尖銳特征峰強度變化明顯,表明前三者形成復合物的含量更多。此外,結(jié)晶特性與消化性存在一定關(guān)系,V型結(jié)構(gòu)特征峰強度越大,可能越有利于RS的形成。
2.6 體外消化特性分析
根據(jù)Englyst等[20]提出在0~20 min和20~120 min內(nèi)解離的淀粉分別定義為RDS和SDS,除去RDS與SDS剩余的部分淀粉定義為RS。最初消化階段,淀粉酶酶解未與脂肪酸發(fā)生復合作用的無序態(tài)淀粉鏈,這部分為RDS;隨著消化時間的延長,淀粉與脂肪酸發(fā)生復合時,支鏈淀粉與直鏈淀粉或脂質(zhì)之間的螺旋堆積可能受到阻礙,并且這種螺旋的填充導致形成了較不致密的晶體結(jié)構(gòu),淀粉被緩慢消化,這部分SDS、RS的形成主要歸結(jié)于直鏈淀粉與脂肪酸復合產(chǎn)生的具有完美晶體結(jié)構(gòu)的直鏈淀粉-脂質(zhì)復合物和直鏈淀粉的老化[31]。
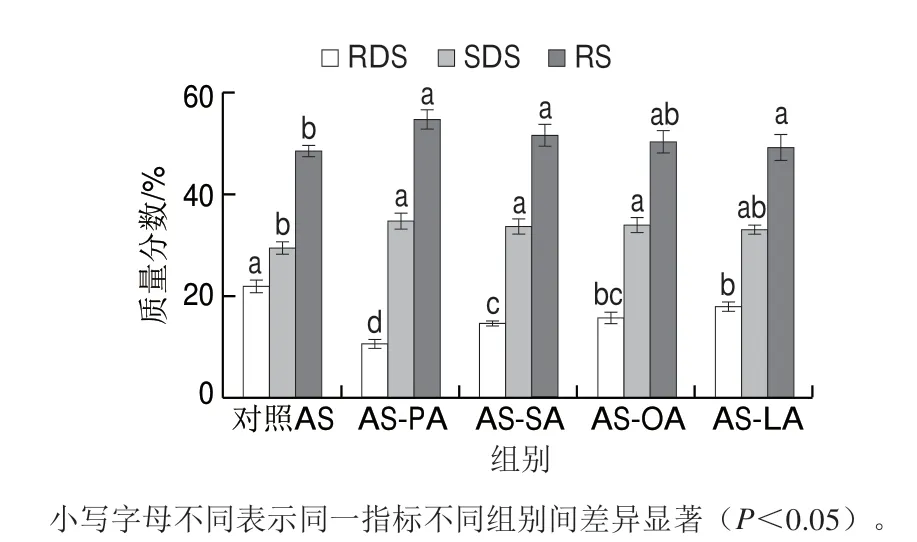
圖 4 AS及AS-脂質(zhì)復合物的體外消化特性Fig. 4 In vitro digestibility of adzuki starch and starch-lipid complexes
由圖4可知,與對照AS相比,添加4 種脂肪酸形成AS-脂質(zhì)復合物都降低了淀粉體外消化率,但降低程度不同。4 種AS-脂質(zhì)復合物RDS質(zhì)量分數(shù)降低,SDS和RS質(zhì)量分數(shù)升高,表明形成的復合物會抑制淀粉的消化。這是由于脂肪酸進入AS的螺旋內(nèi)部,與淀粉牢固地結(jié)合,使淀粉酶對淀粉發(fā)生作用時受到阻礙;還有一部分原因是復合物對消化酶抗性比淀粉高。AS-PA、AS-SA、AS-OA、AS-LA中RDS質(zhì)量分數(shù)較對照AS顯著降低(P<0.05),分別降低了11.37%、7.41%、6.30%、4.13%,SDS質(zhì)量分數(shù)較對照AS顯著增加(P<0.05),分別增加了5.24%、4.33%、4.48%、3.44%。表明復合物使淀粉的消化速率變得更加緩慢,這可能是復合時淀粉與脂肪酸之間的堆積密度變大引起的[32-33]。Sang[34]和Guraya[35]等認為,提高淀粉無定型區(qū)的堆積密度以及降低結(jié)晶區(qū)的完美度可引起淀粉的慢消化性[34-35]。與對照AS相比,AS-脂質(zhì)復合物的RS質(zhì)量分數(shù)增加,其增加幅度依次為:AS-PA>AS-SA>AS-OA>AS-LA,以AS-PA最為明顯,增加了6.13%(P<0.05)。這可能是由于PA的碳鏈較短,且為飽和脂肪酸,復合時產(chǎn)生的晶體結(jié)構(gòu)使淀粉結(jié)構(gòu)更牢固,阻礙了淀粉酶的酶解作用,淀粉-脂質(zhì)復合物的抗消化性隨著脂肪酸碳鏈長度及不飽和度的增加而降低。
3 結(jié) 論
采用微波法處理淀粉,并通過水浴加熱的方法制備了AS-脂質(zhì)復合物,結(jié)果表明,復合物的形成影響AS的結(jié)構(gòu)及消化性質(zhì),且脂肪酸的碳鏈長度與飽和度不同對AS特性的影響不同。與對照AS相比,AS-脂質(zhì)復合物的體積變大,表面凹凸不平,顆粒的多孔洞形貌有利于吸入脂肪酸。AS-脂質(zhì)復合物有3 個吸熱峰,峰II與峰III分別是I型、II型復合物的解旋熔融吸收峰;ΔH隨著脂肪酸碳鏈長度及不飽和度的增加而增大,ΔH的增加與RS的增多有關(guān)。FT-IR圖譜證明了復合物的形成,復合物的氫鍵增加使淀粉結(jié)構(gòu)更牢固,可能導致了RS質(zhì)量分數(shù)增多。復合物的產(chǎn)生使淀粉晶型發(fā)生改變,加入脂肪酸后在17°附近的特征峰強度降低,在12.8°、19.8°附近出現(xiàn)V型晶體的特征峰,表征復合物的存在,并且AS-PA、AS-SA、AS-OA的特征峰強度明顯高于AS-LA,說明AS-LA復合率低于其他脂肪酸形成的復合物;V型結(jié)構(gòu)特征峰強度增加有利于RS的形成。與對照AS相比,AS-脂質(zhì)復合物的RDS質(zhì)量分數(shù)降低,SDS和RS質(zhì)量分數(shù)增加,抗消化性能增強。AS-脂質(zhì)復合物的抗消化性隨著脂肪酸碳鏈長度及不飽和度的增加而降低,其中以添加PA形成的復合物的改變最為明顯,表明脂肪酸在抑制淀粉消化方面有重要作用。

