免疫系統人源化小鼠模型的構建及其在腫瘤治療研究中的應用
郭文文,喬天運,張彩勤,趙菊梅,師長宏*
(1.延安大學醫學院,陜西 延安 716000;2.空軍軍醫大學實驗動物中心,西安 710032)
腫瘤免疫治療是繼手術、放療、化療與分子靶向治療后,又一種新的能夠改善腫瘤患者生存期的治療方法。自2011年FDA批準首個免疫檢查點抑制劑ipilimumab應用于黑色素瘤治療后,免疫制劑在臨床上已用于非小細胞肺癌、腎癌、頭頸鱗癌、霍奇金淋巴瘤、惡性黑色素瘤等的治療,并顯示出良好的應用前景[1-3]。腫瘤免疫治療的進一步研究需要建立人體腫瘤與人體免疫系統相互作用的動物模型。通常腫瘤模型是利用免疫缺陷動物移植入人體腫瘤細胞或組織,而該類動物由于缺乏完整的免疫系統,無法用于免疫治療研究。人們嘗試在免疫缺陷小鼠體內移植入人造血干細胞或功能性的淋巴細胞,使其具有人的免疫功能,這樣的小鼠稱為免疫系統人源化小鼠。該模型可模擬人體腫瘤細胞與免疫系統之間的相互作用,在腫瘤免疫治療藥物的研發與臨床前評估方面具有重要的應用前景。本文重點綜述免疫系統人源化小鼠模型的類型、構建方法以及在腫瘤免疫治療中的應用。
1 免疫系統人源化小鼠模型的構建
重度聯合免疫缺陷動物由于T、B、NK免疫細胞的缺乏,廣泛應用于人源化小鼠模型的構建,常用品系主要有NSG(NOD.Cg-PrkdcscidIl-2rgtmlWjl/SzJ)[4]、NOG(NOD.Cg-PrkdcscidIl-2rgtmlSug/JicTac)[5]、NRG(C.Cg-Rag1tm1MomIl-2rgtmlWjl/SzJ)[6]等。除此之外,用于人源化的NSG-SGM3(NOD.Cg-PrkdcscidIl-2rgtm1WjlTg(CMV IL-3,CSF2,KITLG)1Eav/MloySzJ)小鼠表達人IL-3、粒細胞巨噬細胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)和干細胞因子,允許人造血干細胞(hematopoietic stem cell,HSC)的穩定植入[7];另有MISTRG(MC-SF, IL3, Sirpa, TPO, Rag2-/-IL2Rgc-/-)小鼠可支持較高水平的髓細胞發育,促進人單核細胞、樹突狀細胞(dendritic cell,DC)和巨噬細胞的分化,并促進NK細胞的發育[8]。由于上述動物體內仍然存在有少量鼠源性免疫細胞,通常在移植人源性細胞之前均需進行輻照,以達到清髓的效果[9]。而NBSGW(NOD,B6.SCIDIl2rγ-/-KitW41/W41)小鼠由于攜帶c-Kit基因突變,可支持無輻照小鼠造血干細胞的移植[9-10]。
依據人免疫系統重建的方法,將免疫系統人源化小鼠模型分為三大類:Hu-BLT(humanized-bone marrow,liver,thymus)小鼠模型、Hu-HSCs(humanized-hematopoietic stem cells)和Hu-PBL(humanized-peripheral blood mononuclear cells)小鼠模型(表1)。
1.1 Hu-BLT小鼠模型
該模型是將免疫缺陷小鼠經亞致死劑量輻照處理后,腎包膜下合并移植人胎胸腺和胎肝組織,同時再經尾靜脈注射分離自同一個體的胎肝或骨髓來源的造血干細胞[11]。Hu-BLT小鼠體內能檢測到完整的T細胞、B細胞、NK細胞、單核細胞、DC、巨噬細胞等多種人免疫細胞,并可產生人源性的適應性免疫應答,是人源免疫系統重建最完善的小鼠模型[12]。經流式細胞術檢測,Hu-BLT模型中可表達穩定的人CD45+細胞,其在外周血細胞的比例約為30% ~ 80%。而CD45+細胞比例超過25%標志著Hu-BLT模型構建成功[13]。

表1 不同免疫系統人源化小鼠模型的特點
該模型的重要特征是能產生人類粘膜免疫系統,因此可以應用于HIV[14]、EDV[15]等粘膜感染機制模型、造血系統及腫瘤免疫治療的研究。但其供體樣本難以獲得,而且由于人胸腺組織中的T細胞對小鼠的主要組織相容性復合體(major histocompatibility complex,MHC)仍然有高的親和力,因此Hu-BLT模型可能在植入20周后出現移植物抗宿主反應(graft versus host disease,GVHD)。而有研究報道將C57BL/6小鼠的Rag2、IL-2Yc和CD47基因三重敲除后的TKO-BLT模型在植入人的免疫細胞后45周未發生GVHD跡象,且保持人免疫細胞的高度重建,顯著優于現有的BLT模型[16]。
1.2 Hu-HSCs小鼠模型
Hu-HSCs模型是將新生或成年免疫缺陷小鼠經亞致死劑量輻照處理后,破壞小鼠自體骨髓造血功能,再將新鮮的人CD34+HSC(可來源于人的G-CSF動員的血液、骨髓、臍帶血或胎兒肝等)在24 h內經尾靜脈或者骨髓腔注射入免疫缺陷小鼠體內,使多系Hu-HSC發育成包括T細胞、B細胞、NK細胞、骨髓來源的抑制性細胞(myeloid-derived suppressor cells,MDSCs)和其他譜系陰性細胞在內的免疫細胞[17]。通常在植入后第4周hCD45+T細胞可達25%~60%,外周血中人CD45+T細胞超過25%,標志Hu-HSC模型構建成功[18]。
該模型的優勢在于其造血系統及免疫細胞是HSC在小鼠體內重新發育而來的,對小鼠宿主具有免疫耐受,通常不會發生GVHD,模型穩定期可長達10~12周[19],可應用于HIV[20]、EBV[21]等感染模型及造血系統發育的長期研究,在腫瘤免疫治療研究中顯示出巨大的應用前景。然而,在該模型中影響免疫細胞分化成熟的因素較多。如成年NSG小鼠體內植入HSC后,12周才能夠在外周血中檢測出人T細胞,且T細胞的數量相對較少,活性不高[22-24]。相反,將HSC植入新生NSG小鼠后,很容易產生人T細胞。另有研究證明,雌性NSG小鼠比雄性NSG小鼠更支持人HSC的植入[25-26]。
1.3 Hu-PBL小鼠模型
該模型是將免疫缺陷小鼠經亞致死劑量輻照處理后,將5×106~ 20×106個新鮮的人PBMCs經尾靜脈或腹腔移植入小鼠體內,以實現血液和脾中50% ~ 80%的CD45+細胞的植入,通常第一周就可獲得人CD3+T細胞,第四周可檢測到人CD3+CD45+T細胞超過25%[22, 27]。
Hu-PBL小鼠是目前最簡單、經濟的人源化小鼠模型,以重建人的T細胞為主并保持其免疫功能。與CD34+HSC衍生T細胞相比,當免疫缺陷小鼠移植PBMC時,人T細胞增殖速度更快,可重建更高水平的人T細胞,是研究成熟效應T細胞的理想模型[22]。同時該模型中還可檢測到少量的B細胞、髓系細胞或其他免疫細胞。但該模型存在的主要問題是,由于人T細胞和小鼠免疫細胞之間的MHC不匹配而出現的致死性GVHD反應[28-29]。通常會在人PBMC注射后4~6周出現明顯的GVHD癥狀,治療觀察窗口期短,使用受限[8, 27]。但此實驗窗口期可以通過改造NSG(NDG、NPG等)小鼠,使其缺失MHC-I或II基因而得到延長[30]。此外,降低PBMCs中CD4+T細胞的比例也可顯著減緩GVHD反應[31]。然而,CD4+T輔助細胞亞群比例的降低會損害細胞免疫,這可能會降低該類小鼠模型的適用性。
2 Hu-PDX模型
基于臨床腫瘤標本建立的PDX(patient-derived xenograft)模型較好的保持了原發瘤的特征,但由于其缺乏人體免疫系統,無法針對特定患者的腫瘤細胞或組織開展免疫治療研究。在免疫系統人源化小鼠體內移植入特定患者的腫瘤組織而建立的模型稱為Hu-PDX(humanized patient-derived xenograft)模型,因其可模擬人體中腫瘤細胞與免疫系統之間的相互作用,在抗腫瘤免疫治療研究方面具有重要的應用前景。
Hu-PDX模型的構建與腫瘤移植的時間和人源化的方法密切相關。如Hu-PBL小鼠模型免疫重建維持時間較短,因此Hu-PBL-PDX模型的構建通常是先移植患者的腫瘤組織,待腫瘤體積達到約120~180 mm3時,對小鼠進行亞致死性輻照后,再經尾靜脈注射人PBMC;Hu-HSC小鼠模型由于GVHD反應較弱,免疫重建維持時間約為10~12周,所以Hu-HSC-PDX模型通常是先將人CD34+HSC移植入經亞致死性輻照處理的免疫缺陷小鼠體內,當小鼠體內人CD3+CD45+比例超過15%(通常為移植后12周),再移植入患者腫瘤組織[22]。該模型構建成功的標志是在腫瘤組織中能夠檢測到人的免疫細胞和細胞因子等。
目前,Hu-PDX模型已應用于多種類型的腫瘤研究中,如非小細胞肺癌、結直腸癌、腎癌、肝癌、三陰性乳腺癌、黑色素瘤等[22, 31-34]。這些模型給腫瘤細胞提供與人體更相似的生長微環境,可以從組織病理學、基因表達、基因突變、炎癥和治療反應等方面真實準確的反映了臨床腫瘤患者的表現,在腫瘤的發生、發展和轉移機制研究等方面具有重要的應用價值,尤其在腫瘤免疫治療研究方面,是理想的腫瘤模型。
3 人源化小鼠模型在腫瘤免疫治療研究中的應用
腫瘤免疫治療是通過激活機體抗腫瘤免疫反應或阻斷腫瘤免疫逃逸,以控制和殺傷腫瘤。主要包括嵌合抗原受體T細胞(chimeric antigen receptor T cells,CAR-T)、免疫檢查點抑制劑治療以及與其他免疫療法相結合的綜合療法等,而人源化小鼠模型是開展上述免疫治療研究的理想的臨床前模型。表2是目前已報道的部分人源化小鼠模型在不同類型腫瘤免疫治療研究中的應用。
3.1 CAR-T治療中的應用
CAR-T細胞免疫療法原理在于經嵌合抗原受體修飾的T細胞,可以特異性地識別腫瘤相關抗原,使效應T細胞的靶向性和殺傷活性均較常規的免疫細胞高,從而發揮抗癌作用。目前CAR-T療法臨床上主要應用于B細胞淋巴瘤、白血病等血液系統惡性腫瘤的治療[35-36],而在實體腫瘤的治療中應用較少。人源化小鼠模型目前已應用于各種CAR設計的抗腫瘤療效評估。Abate-Daga等[37]利用胰腺癌Hu-PBMC-PDX模型,開發了一種針對前列腺干細胞抗原(PSCA)的CAR,為將PSCA作為基于CAR的胰腺癌免疫治療的靶抗原提供了證據;另有研究報道證明在卵巢癌Hu-PBMC-PDX模型上,CD27能夠共刺激CAR-T細胞以獲得更高的持久性和抗腫瘤活性[38]。顯然,Hu-PDX模型為評估CAR-T療法在實體腫瘤中的有效性提供了新的方法。
3.2 腫瘤免疫檢查點抑制劑研究中的應用
腫瘤細胞可以通過多種途徑逃避免疫系統的識別及殺傷。通過激活腫瘤微環境中特定的抑制性信號通路是腫瘤逃避免疫監視的途徑之一,這些抑制信號被稱為免疫檢查點。目前發現的免疫檢查點包括:細胞毒性T淋巴細胞抗原4(cytoxic T lymphocyte-associated antigen-4,CTLA-4)、程序性死亡受體-1/程序性死亡受體-配體1(programmed cell death-1/programmed cell death-ligand 1, PD-1/PD-L1)、T細胞免疫球蛋白-3(T cell immunoglobulin-3, TIM-3)、T細胞免疫球蛋白ITIM結構域(T cell immunoglobulin and ITIM domains, TIGIT)、淋巴細胞活化基因-3(lymphocyte activation gene-3, LAG-3)及唾液酸結合免疫球蛋白樣凝集素-15(sialic acid-binding Ig-like lectin-15, Siglec-15)等。其中CTLA-4與PD-1/PD-L1信號通路的研究獲得了2018年諾貝爾生理學或醫學獎。目前免疫檢查點抑制劑的研究主要集中在臨床研究,但由于缺乏大量的動物模型進行篩選和驗證,所以相關結果并不理想。許多研究已證實人源化小鼠模型在免疫檢查點抑制劑研究中的獨特優勢。例如,Kenneth等[39]應用EBV相關淋巴瘤的Hu-PBL-SCID小鼠模型來篩選一組抗人CTLA-4單克隆抗體(MAb),結果顯示不同單抗在小鼠模型中活化人T細胞的效能具有顯著的差異。Lin等[22]構建了Hu-PBL-NSI和Hu-HSPCs-NSI(humanized-hematopoietic stem and progenitor cells-NSI)兩種人源化小鼠的非小細胞肺癌PDX模型,并評估了針對PD-L1/PD-1免疫檢查點靶向治療的效果。研究發現與Hu-HSPCs-NSI小鼠相比,Hu-PBL-NSI人源化小鼠模型在免疫靶向治療中顯示出更高的抗腫瘤效果。此外,Roberto等[33]成功構建了三陰性乳腺癌的Hu-CD34-HSC-PDX模型,并評估了抗PD-1抗體治療的有效性。研究結果顯示,抗PD-1抗體治療可顯著抑制腫瘤的生長并提高患者的生存率。
盡管部分人源化小鼠模型在免疫治療中取得了成功,但在一項針對非小細胞肺癌Hu-PDX模型的研究中發現,不同來源的CD34+HSPC供體重建的人源化小鼠針對免疫檢查點抑制劑治療的反應不盡相同,這與臨床上患者對抗PD-1治療的不同反應率是一致的。并且在人源化小鼠模型中反應性的差異可能與供體的T細胞譜系有關[18]。因此,人源化小鼠模型在腫瘤免疫治療中的應用仍然需要進一步的改進。
3.3 免疫綜合治療中的應用
逆轉T細胞抑制信號的藥物(例如PD-1/PD-L1療法)的成功應用使人們對癌癥免疫療法充滿了信心,但單藥治療效果有限,聯合免疫治療可能具有良好的抗腫瘤效能。2019年3 月美國FDA批準了PD-L1抑制劑Atezolizumab聯合依托泊苷、卡鉑用于廣泛期小細胞肺癌患者的一線治療,這標志著免疫治療進入聯合治療為主的2.0時代。人源化小鼠模型用于評價CAR-T細胞與抗體靶向免疫檢查點抑制劑(如PD-L1和CTLA-4)聯合治療的效果[40]。Suarez等[41]在轉移性透明細胞腎細胞癌的人源化小鼠模型中使用CAR-T細胞和免疫檢查點抑制劑進行聯合治療。這些靶向人抗碳酸酐酶的CAR-T細胞還可分泌人抗PD-L1抗體,以克服PD-1和PD-L1相互作用介導的檢查點抑制。與僅使用CAR-T細胞處理組相比,聯合免疫檢查點阻斷方法可有效增強抗腫瘤效力。Leonid等[42]使用胸膜間皮瘤的原位小鼠模型研究PD-1介導的T細胞衰竭與間皮素靶向的CAR-T細胞之間的關系,研究結果顯示通過阻斷PD-1/PD-L1可以增強CAR-T細胞的療效。另有研究報道,在EBV相關淋巴瘤的Hu-HSC-NSG模型中,PD-1和CTLA-4阻斷抗體的聯合治療可顯著抑制EBV誘導的彌漫性大B細胞淋巴瘤的生長,并且兩種抗體聯合用藥的抗腫瘤效果優于單藥治療[43]。此外,在人結腸癌組織植入Hu-PBL-BRG小鼠模型中,利用抗人CD137和抗PD-1單抗聯合作用具有顯著抑制腫瘤生長的效果;研究者在利用人胃癌組織和自體PBMC構建的Hu-PDX模型中獲得了相同的結果[31]。
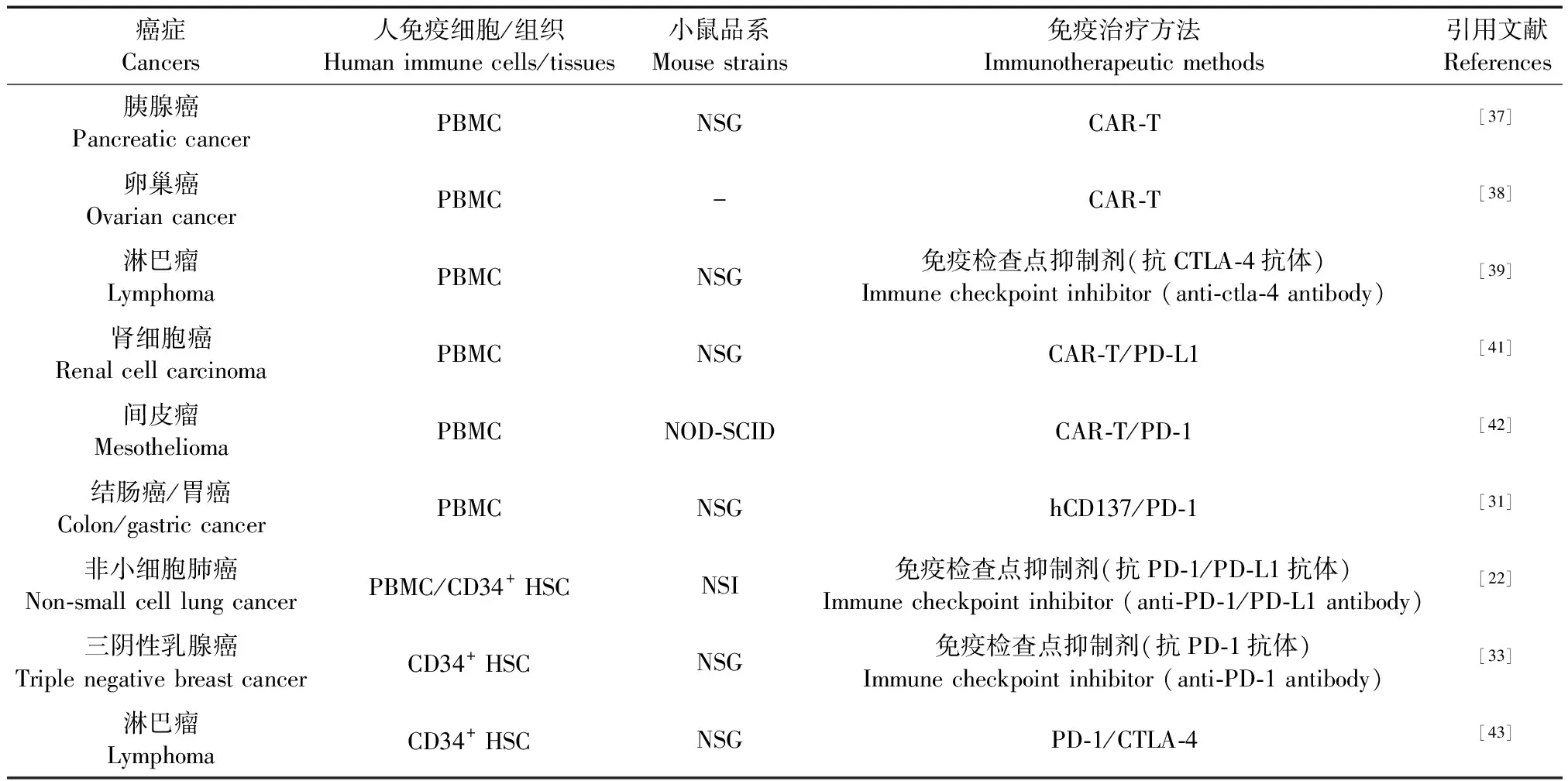
表2 人源化小鼠模型在腫瘤免疫治療中的應用
4 未來的發展趨勢
在癌癥免疫治療的新時代,人源化小鼠模型是評估新療法、研究組合療法以及指導個性化免疫治療的有效工具。但該模型的構建目前仍存在諸多缺陷,如免疫細胞與移植瘤之間的組織相容性問題、小鼠殘留的先天免疫系統影響人免疫細胞的植入、缺乏物種特異性的生長因子促進某些免疫亞群的成熟等,這些因素導致人源化小鼠模型不能完全滿足腫瘤—免疫研究的需求。為此,正在研發的下一代人源化小鼠,包括MHC基因人源化的小鼠[44]、抑制鼠源免疫細胞的人信號調節蛋白α(signal regulatory protein alpha, SIRPα)轉基因小鼠[45-46]以及轉入人源細胞因子如IL-2、IL-3、GM-CSF、SCF等的小鼠[47-48],有望通過解決這些問題以實現更高水平及更全亞群的人免疫細胞的植入。
人源化小鼠模型在腫瘤免疫治療研究中的進一步應用有望解決臨床治療中存在的問題。如尋找明確的生物標志物以解決臨床反應率低的問題、探索腫瘤免疫治療與傳統治療方法相結合的聯合療法以解決免疫相關不良反應問題等。總之,人源化小鼠模型的不斷優化以及其在腫瘤免疫治療領域應用的擴大,必將為癌癥免疫學和個性化醫學提供前所未有的研究平臺。

