合成微生物群落共培養研究概況
張 鑫,梁建東*,田維毅,梁宗琦
1貴州中醫藥大學基礎醫學院;2貴州大學真菌資源研究所,貴陽 550025
微生物是新型天然產物的重要來源,在藥物發現等領域具有不可替代的應用[1]。如今,隨著宏基因組學技術的發展,賦予了挖掘微生物天然產物的新內涵。基因組測序顯示,微生物基因組,尤其是真菌基因組,包含大量的基因簇,具有比預期更加豐富的天然產物,它們可能產生結構更多樣化的次生代謝物,但是在傳統的培養條件下,許多微生物基因簇保持沉默。近年已發展了一些激活這些神秘基因的手段,其中,基于微生物組學原理及方法的合成微生物群落共培養研究正在興起[2]。筆者從合成微生物群落共培養的價值與構建方法、共培養產物的檢測和微生物群落的共培養應用等方面對國內外有關合成微生物群落共培養的研究進行概述,旨在為合成微生物群落共培養的進一步深入研究及開發應用提供參考。
1 合成微生物群落的共培養體系
合成微生物群落是在成分明確的基質條件下,人工創建的兩個或多個物種共培養的微生物群體系[3]。合成微生物群落通過微生物之間的相互作用實現特定功能,其中的微生物能夠通過相互交流和分工行使不同的復雜功能,具有復雜度低、可控性高、穩定性好等優點。合成微生物群落中存在多種相互作用,這些相互作用可以通過改變細胞間交流、物種代謝作用以及空間結構等方式進行調控,從而實現對合成群落的改造[4]。在自然界和人類社會中,微生物群落在生物地球化學循環[5],食物生產[6],工業過程[7]以及人類健康和疾病[8]中皆發揮著重要作用。然而,傳統的微生物研究方法(如純分離和純培養等方法)一定程度上卻又制約著微生物的研究和應用。實則,微生物在自然界中,經常以防御或營養競爭狀態生活在群落中,它們的相互作用產生多種次級代謝物。如,在細菌或真菌的生長環境中(土壤,根際,植物,粘膜和腸等),微生物持續地相互作用,會導致復雜調節機制的激活,進而促使高度多樣化的天然產物的生物合成,例如信息素,防御分子和參與共生關聯的代謝物。此外,應激誘導分子(誘導子)表現出特異性的抗微生物,抗癌,和植物毒性活性[9]。為了發現新藥物,人們可借助這些相互作用,在化學生態學研究的框架內,模仿自然存在的群落,構建(合成)一個人工群落,如,專門用于研究群落成員間對抗區天然產物誘導(主要發現新的活性化合物)的合成群落[10]。為進一步拓寬待研究物種和代謝產物的多樣性,研究者們基于微生物群落中菌株間發生的化學——生態互作關系,開發了新的培養微生物的方法——共培養法[11,12],該方法自興起以來,受到越來越多的重視。
1.1 合成微生物群落共培養價值和策略
共培養(co-culture)是在一個培養容器中一起培養兩種或多種微生物的方法[13]。共培養可以在液體或固體培養基中進行。當使用液體培養時,該方法也稱為 “混合發酵”(mixed-fermentation)。
通常,共培養的策略是通過模擬自然生態,來構建人工的微生物群落[14]。在模擬自然微生物環境條件下,共培養可導致現有天然產物積累的增加[15],或由于微生物串擾和化學防御而觸發沉默生物合成途徑的表達,產生新的化合物[4]。實現這些目標與微生物及其產生的酶和其他物質密切相關。酶抑制可以引起天然產物生物合成的誘導和抑制。向培養基中添加酶抑制劑可以阻斷某些生物合成途徑,從而將次級代謝物生物合成轉變為從沉默或表達不良的基因簇產生其他天然產物[16]。在某些情況下,沉默通路的激活需要第二種微生物的存在,單獨的代謝物不總是足以誘導刺激代謝產物的產生,微生物間的相互作用是產生次級代謝產物的必然驅動力,可能與空間/營養的競爭、寄生和拮抗等不同機制以及誘導植物防御反應有關[4]。共培養對于特定基因的激活取決于相互作用類型,可能會誘導由各種不相關途徑產生的代謝物。微生物共培養可以激活沉默基因簇,但實現這一目標的分子機制尚不十分明確。微生物可以產生具有轉錄調節和表觀遺傳修飾功能的化合物[17]。微生物的共培養還可以導致基因突變和其他沉默基因簇的表達,甚至整個基因片段的交換(水平基因轉移),這可以產生以前未檢測到的化學結構[18]。共培養也可以監測藥物對合成微生物菌群的影響,與藥物研究高度相關[19],還能減少代謝負擔,限制多余副產物的形成,已成為合成和生產生物活性化合物的替代方法[20]。此外,由于天然微生物群落的復雜性,合成微生物群落可以隨時間單獨測量每種基因型的生長和代謝特性,因此通常更適用于數學建模[21]。
Chen等[22]在大米培養基上將土曲霉Aspergillusterreus與枯草芽孢桿菌Bacillussubtilis或蠟質芽孢桿菌Bacilluscereus共培養,與單一的土曲霉培養相比,其產生的天然產物積累增加了34倍。Kumari & Naraian[23]將佛羅里達平菇Pleurotusflorida和立枯絲核菌Rhizoctoniasolani共培養,得到了比單培養更高的生物產量。海洋真菌,Emericellasp.(CNL-878)和Salinisporaarenicola(CNH-665)共培養,使縮酚酸肽的產量增加了100倍[24]。共培養系統優于單一菌種培養或許是它們更為豐富的酶系統和生物誘導效應利用了中間代謝物,從而有利于生物量的快速增長[25]。雜色曲霉A.versicolor與枯草芽孢桿菌共培養產生的3,4-二氫萘醌-(2H)-1- 1- 1(1-四酮)衍生物,aspvanicin A及aspvanicin B從未從真菌或細菌單獨的培養物中檢測分離到。真菌-細菌共培養是一種誘導產生新的次生代謝產物的有效方法[26]。在放線菌Nocardiopsissp.RV163和Actinokineosporasp.EG49的共培養中誘導產生了三種在任一微生物單獨培養物中都未檢測到的化合物[27]。以上結果都表明,共培養是提高代謝產物含量和發現新的生物活性代謝物的重要潛在策略。
1.2 微生物共培養的固、液體系
培養條件會影響微生物的代謝產物,這促使研究人員用不同的培養基進行實驗以優化代謝物的產生。培養基的可利用性取決于培養微生物的類型,無論在固體或液體中培養,培養條件必須對共培養雙方都相容[10]。因此,人們可利用不同的底物類型和培養條件來改變微生物群落的培養特征。
1.2.1 固體基質上的共培養
在固體培養基上,可研究菌絲體前端的形態發生和代謝變化及其互作模式。利用真菌在固體培養基上的拮抗生長特征及物種的形態,可定位共培養微生物代謝物誘導的“化學戰”區域(即代謝物誘導現象可能發生的地方)。但在培養皿中進行的固體培養下,只能提取有限數量的代謝物,當需要分離特定代謝產物進行重新鑒定或生物活性研究時,這種局限非常明顯[10]。
1.2.2 液體培養基中的共培養
液體培養基中不同種類微生物的共培養也被稱為混合發酵。混合發酵是增加天然產物庫的有效方法,不僅有助于發現新的次級代謝產物,還有助于激活已知的微生物生產力[28]。在液體培養中,不易明確微生物之間相互作用的方式,但可以監測天然產物的誘導,如通過比濁法監測培養物的生長[10],通過高效液相監測代謝的變化。液體環境中的共培養已應用于各種微生物的開發利用中[29]。
1.2.3 固、液環境下共培養的優缺點
與液體培養相比,固體培養能產生更多數量的代謝物,也有助于觀察真菌的相互作用區域,估計增長率等。另外,在固體培養基上共培養構成了一種簡單、靈活且低成本的方式,在篩選真菌共培養中的誘導現象時優于液體培養[30]。然而,在固體培養基上大規模生產共培養產物仍然是一個相當復雜的過程。目前,已經開發了幾種利用固體培養基共培養物的技術[31],這些方法能夠產生足夠數量的代謝物,從而對微生物代謝產物進行分離,用于深入的生物活性研究。然而,如果需要升級到工業生產,使用純菌株和混合發酵則仍然是至關重要的。
1.3 不同分類群共培養體系的建立
細菌-細菌、真菌-真菌或細菌-真菌的共培養組合,代表了模擬生理條件的自然驅動方法[18]。科學家已成功研究了不同微生物組合的共培養對微生物種群生長、互作以及不同活性代謝物的影響[32]。表1列舉了其中一些成功的實例。
1.3.1 細菌-細菌的共培養
細菌通常以細胞種群在微生態位上形成生物膜,一個或幾個細菌物種密切相互作用并在群落中進化,以在有限的環境中利用有限的資源來確保物種存活,并得到諸如營養獲取、動態生長、增加抗性等優勢[33]。細菌共培養能夠促使產生未知的次級代謝產物,包括許多具有抗腫瘤、抗癌、抗菌和防污特性的分子[34]。很多時候,這類細菌主要是革蘭氏陽性的鏈霉菌,它們分布于土壤、各種海藻和海洋沉積物中[35]。
1.3.2 真菌-真菌的共培養
真菌-真菌的共同培養及其誘導的天然產物已見報道[36]。在共培養中兩個彼此接近的菌絲體可以以不同的方式互作,包括共生,中性或競爭,它們也可以從一種類型轉換到另一種互作類型。當不同菌株的菌絲在互作區相遇作用時,菌絲形態的改變加強,競爭性的菌株間可形成抗衡區,常強烈著色,暗示了顯著的代謝活動,可用以尋找新的代謝物。在互作過程中發生的變化還包括細胞外酶和胞外次級代謝產物的產生,特別是酚類和醌類化合物,這意味著對“合作伙伴”的氧化應激,進而加速真菌的新陳代謝轉變為次生代謝[10,37]。
1.3.3 細菌-真菌共培養
細菌-真菌的共培養是誘導次生代謝物、激發沉默基因簇的重要途徑[15,26]。Machín-Ramírez 等[38]的實驗表明,使用真菌-細菌共培養體系可以增強苯并[a]芘(Benzo[a]pyrene)的生物降解。幾種不同細菌與曲霉共培養表明,真菌-細菌共培養體系是一種可豐富這些真菌化學多樣性的有效工具[39](表1)。細菌與真菌共培養增加了真菌的生物活性,這或許與細菌在培養基中產生的次生代謝產物有關,這些細菌化合物作為信號分子誘導真菌合成抗菌化合物以提高真菌的生存[1]。
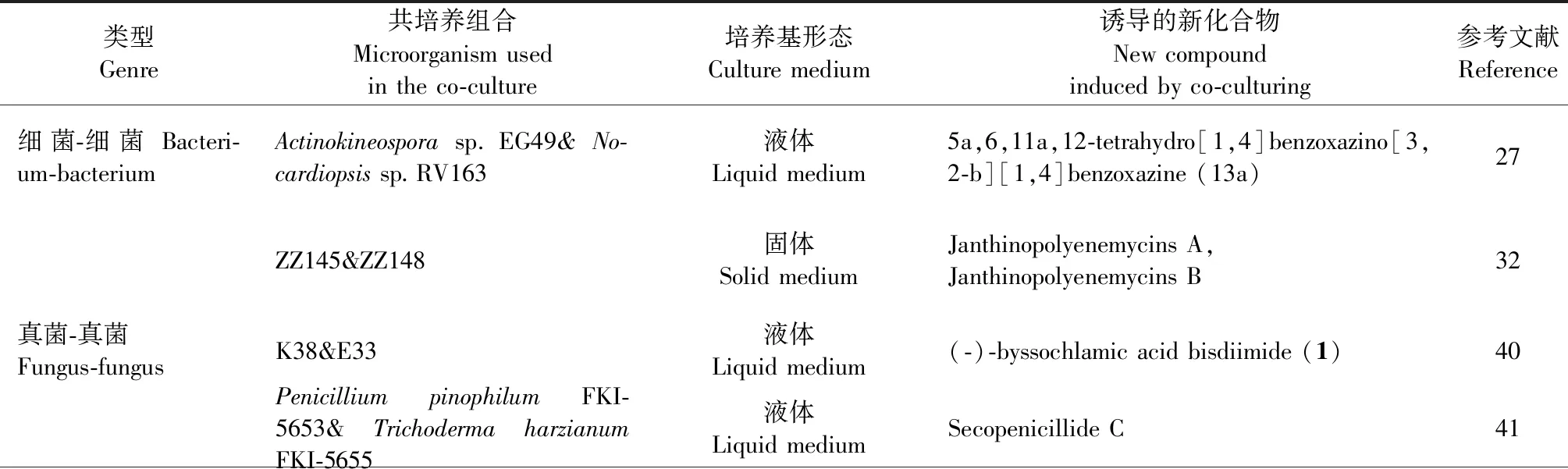
表1 一些共培養微生物組合及其誘導產生的重要生物活性化合物Table 1 Some co-cultured microbial combinations and important bioactive compounds induced by them
續表1(Continued Tab.1)

類型Genre共培養組合Microorganism usedin the co-culture培養基形態Culture medium誘導的新化合物New compound induced by co-culturing參考文獻ReferenceTrichophyton rubrum &Bionectriaochroleuca固體Solid medium4″-hydroxysulfoxy-2,2″-dimethylthielavin P9Phomopsis sp.K38 & Alternaria sp.E33液體Liquid mediumCyclo (D-Pro-L-Tyr-L-Pro-L-Tyr) (1) ,Cyclo (Gly-L-Phe-L-Pro-L-Tyr) (2)42Trametesversicolor&Ganoderma applanatum液體Liquid medium N-(2-hydroxy-4-methoxyphenyl)formamide, N-(4-methoxyphenyl)formamide 2-O-β-D-xylo-bioside14Camporesiasambuci FT1061&Epicoccum sorghinum FT1062液體Liquid medium11S-hydroxy-1-methoxyfusaricide (1)43細菌-真菌Bacterium-fungusEmericella(CNL-878)&Salinisporaarenicola(CNH-665)液體Liquid mediumEmericellamide A(1),Emericellamide B(2)24Streptomyces coelicol-or&Aspergillusniger液體Liquid medium (E)-2-(3-hydroxyprop-1-en-1-yl)-phenol , (2E,4E)-3-(2-carboxy-1-hydroxyethyl)-2,4-hexadienedioxic acid 44Pestalotiopsis sp.&Bacillus sp.固體Solid mediumPestalotiolactones A(1),Pestalotiolactones B(2)45Penicilliun sp.DT-F29 &Bacillus sp.B31固體Solid mediumFumitremorgin A ,13-prenyl fumitremorgin B 46Bionectria sp.&Bacillus subtilis or Streptomyces lividans固體Solid medium1,2- dihydrophenopyrrozin(1)47Streptomyces piomogenus AS63D&Aspergillus niger ASMC5 固體Solid mediumPenicisteroid C (1)48
2 共培養產物的檢測
由于微生物提取物的復雜性,先進的分析方法是成功檢測和鑒定共培養代謝產物的關鍵。目前常用監測代謝物的方法主要有以下幾種。
2.1 高效液相色譜法(HPLC)
這種方法提供了一種監測單一培養和共培養的不同色譜圖之間的變化,可容易地鑒定共培養液中的代謝物,以檢測代謝譜的變化[49]。
2.2 超高壓液相色譜時間質譜指紋圖(UHPLC-TOF-MS)
此法是近年來另一種檢測共培養代謝物的有效方法[50,51]。它能在培養皿水平上篩選固體培養基中的真菌共培養物,通過自動生成的峰列表,進行統計處理來比較共培養物獲得的LC-MS數據及其相應的單一培養物,突出真菌互作高表達的代謝物[30]。Bertrand等證明,這種方法可有效檢測到幾十種誘導代謝物[9]。Schroeckh等利用UHPLC-TOF-MS證明了通過真菌共培養可以誘導已知化合物的新硫酸化類似物[52]。
2.3 液相色譜/質譜(LC-MS)法
通常從培養基中提取天然產物,隨后進行液相色譜-質譜(LC-MS)分析以純化和分離潛在的新次級代謝產物,再利用核磁共振(NMR)技術對結構進行分析[19]。其它一些研究者也用這種方法發現和鑒定了通過共培養產生的多種活性物質[14]。
2.4 核磁共振(NMR)
此方法是代謝組學研究中應用的另一種主要分析技術,是結構鑒定的首選方法[53]。在利用核磁技術時,不需要進行樣品分離或制備,且是非破壞性的,具有很強的追蹤代謝途徑的能力,能夠明確鑒定未知代謝物的結構,在識別復雜混合物中的分子方面特別有效,因此有助于群落新陳代謝的直接生化分析[54]。Bertrand等[9]通過NMR技術成功鑒定了共培養的誘導物來源及新化合物的結構。
當能夠直接觀察到代謝物誘導現象時,可用前述簡單的高效液相色譜(HPLC);如果沒觀察到顯著的代謝物變化時,則需要利用高級數據挖掘的敏感代謝組學方法[10]。代謝組學被定義為一種非選擇性,普遍適用的綜合分析方法。該研究領域致力于獲得完整的代謝物指紋,檢測代謝物之間的差異并產生假設來解釋這些差異[19,55]。此外,使用代謝組學分析可以快速鑒定在真菌-真菌相互作用過程中產生的新化合物[4]。而這些數據分析可以利用一些有利的工具進行,如MultiGeneBlast(用于手動挖掘基因組)[56],PubChem數據庫(專注于化合物的數據庫)[57],GNP / iSNAP網絡應用程序(用于天然產物鑒定的代謝組學工具)[58],SMBP(用于基于代謝組學的次級代謝研究,可在http://www.secondarymetabolites.org上公開獲取)[59],Mminte(用于預測微生物間發生的相互作用類型,可在www.github.com/mendessoares/MMinte上公開獲取)[60]等。此外,共培養產物的分析也是一項重大的有挑戰性的工作,它可通過使用多種提取方法[61]和互補的復雜分析平臺[62],對產生的結構信息與復雜混合物中代謝物的鑒定進行比較[63]。
3 微生物群落的共培養應用
通過共同培養多種微生物而促進天然產物形成的研究表明,共培養是一種可促進生物活性代謝物形成的(在單一培養中不存在)極有前途的方法[64]。微生物組和功能菌群的研究推動了基礎研究向實際應用的轉化,具有巨大的應用潛力,并獲得了一些創新性的進展。表2總結了近年來共培養在工業、生態等領域的應用實例。

表2 不同微生物共培養組合的成功應用實例Table 2 Successful application examples of different microbial co-culture combinations
4 結論
微生物群落的共培養已成為誘導沉默的次級代謝產物合成基因簇的一種強有力的方法[73,74]。對于合成微生物群落共培養,在今后研究中需要關注如下幾個問題。
首先,合成微生物群落,通過改變細胞間交流、物種代謝作用以及空間結構等方式進行調控,實現極為精細的合作分工。為了更深入地了解微生物共培養的分子機制,可以利用宏基因組方法,從菌群基因組水平解析微生物群落組成及代謝調控多樣性。
其次,在微生物共培養體系中產生的次級代謝產物產量相對較少,因此開發分析工具變得越來越重要。將代謝分析工具和代謝網絡優化工具轉化為共培養應用程序,促進未知代謝物的鑒定,開發衍生化合物的共享數據庫是我們進一步理解微生物間互作的重要環節[75]。
共培養與生物轉化的結合也十分重要。微生物轉化法是通過微生物整體細胞或產生的酶將復雜的底物進行結構修飾和改造,其本質在于利用微生物代謝過程中產生的某個或某一系列的酶對底物(或外源化合物)進行催化反應,使一種化合物轉變成更有經濟價值的產物。活性天然產物的生物轉化產生的代謝產物具有較強的生物活性和較低的毒性[76]。除了共培養產生新的代謝產物外,生物轉化大大增加了發現新化合物的概率,這為藥物發現提供了新的思路和途徑[43]。本實驗室利用靈芝菌-蛹蟲草共培養發酵太子參的實驗中發現,在共培養的過程中,蟲草素的含量高于單菌發酵,說明在共培養的過程中會促進某些次級代謝產物的形成,導致現有天然產物積累的增加。

