常溫下鈉在空氣中反應的實驗探究
陳云

摘要: 依據常溫下鈉與氧氣反應的原理,運用自制三口瓶改進傳統實驗,利用O2傳感器、CO2傳感器和相對濕度傳感器進行實驗探究。發現鈉與空氣中的O2、 CO2、水蒸氣等物質發生反應最終生成碳酸鈉,且同時可能發生多個反應。初始相對濕度越大,鈉與空氣中O2、 CO2、水蒸氣反應速率也越快。
關鍵詞: 鈉在空氣中反應; O2傳感器; CO2傳感器; 相對濕度傳感器; 實驗探究
文章編號: 1005-6629(2019)11-0057-04? ? ? ? ? ? 中圖分類號: G633.8? ? ? ? ? ? 文獻標識碼: B
1? 問題的提出
鈉與氧氣反應是蘇教版高中化學必修教材《化學1》專題2第二單元第一節“金屬鈉的性質與應用”中的內容,教材中有這樣一個實驗設計環節: 取一小塊金屬鈉,用濾紙吸干表面的煤油,用小刀切去一端的表層,觀察表面的顏色;將其放置在空氣中,觀察表面顏色的變化。從實驗現象看,剛切開金屬鈉時,表面呈現金屬光澤,然后變暗,再放置一段時間表面呈白色。一般教師的解釋是由于鈉被空氣中的氧氣氧化為氧化鈉,還會繼續與二氧化碳、水蒸氣反應最終生成碳酸鈉。這種解釋雖然基本沒什么問題,但是氧化鈉是白色固體,而用鈉的表面發暗的現象來說明鈉被氧氣氧化為氧化鈉有些牽強[1],另外鈉與氧氣反應和與空氣反應還是有一定區別的[2, 3]。
本實驗設計透過自制玻璃儀器觀察物質變化的宏觀現象,借助電子傳感器捕捉化學反應過程中的細微變化,對鈉在空氣中的反應進行實驗改進和知識補充,進而幫助學生正確認識化學反應、物質及其變化的基本規律和方法,這也是新課程標準的重要內容之一。
2? 實驗探究分析鈉在常溫下的反應
2.1? 實驗原理
在室溫下,鈉能夠迅速地與空氣中的氧氣反應,還很容易吸收空氣中的二氧化碳;鈉還會與空氣中的水蒸氣反應或被氧氣氧化后又會與水反應生成氫氧化鈉,氫氧化鈉與空氣中二氧化碳反應。一般認為,鈉暴露于空氣中,長期久置后最終產物就是碳酸鈉。過程中主要涉及的反應如下:
4Na+O22Na2O①
Na2O+H2O2NaOH②
2Na+2H2O2NaOH+H2↑③
2NaOH+CO2Na2CO3+H2O④
2.2? 實驗藥品與儀器
實驗儀器: 自制三口瓶、Logger Pro 3(軟件)、數據采集器、O2傳感器、CO2傳感器、相對濕度傳感器、鑷子、小刀、玻璃片、濾紙、鐵架臺、鐵夾
實驗藥品: 金屬鈉、煤油、濃硫酸
本實驗采用威尼爾公司的數字采集器、數據采集軟件、O2傳感器、CO2傳感器以及相對濕度傳感器
2.3? 實驗裝置及操作要點
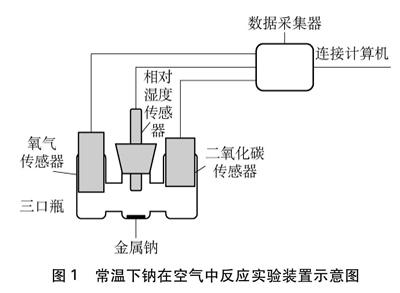
實驗裝置中,自制三口瓶的三個口分別插入O2傳感器、相對濕度傳感器和CO2傳感器,三個口分別對應三個凹槽,金屬鈉放在中間凹槽內。若要改變密閉容器內的相對濕度,可先向三口瓶的左右兩個凹槽內滴加濃硫酸,待相對濕度穩定后再進行實驗。實驗裝置如圖1所示。
圖1? 常溫下鈉在空氣中反應實驗裝置示意圖
實驗操作時主要注意以下幾點:
(1) 金屬鈉盡量切成薄片狀,兩面皆為新切切面,且大小相等,表面積約為1.5cm×0.5cm,便于透過玻璃觀察鈉表面的現象,也為對比實驗探究提供真實有用的數據。
(2) 切好金屬鈉后立即放入三口燒瓶的中間凹槽內,迅速蓋上橡皮塞,再進行數據采集。
(3) 干燥劑濃硫酸不能與金屬鈉接觸。
2.4? 實驗過程
2.4.1? 實驗探究1: 空氣中相對濕度對O2濃度和CO2濃度數據采集的影響
用USB數據線將計算機與數字采集器連接起來,將O2傳感器、相對濕度傳感器和CO2傳感器連接到數據采集器上,三口瓶固定在鐵架臺上,按照圖1搭好裝置。在三口瓶兩端凹槽內分別滴加少量濃硫酸,點擊數據采集,觀察曲線變化情況。
數據圖像縱軸選擇O2濃度(%)、CO2濃度(ppm)和相對濕度(%),橫軸選擇時間(s),開啟儀器采集數據,觀察O2濃度、CO2濃度和相對濕度隨時間變化情況。實驗結果如圖2、圖3和圖4所示。
圖2? 密閉容器內O2濃度和相對濕度隨時間變化的曲線1
圖3? 密閉容器內CO2濃度和相對濕度隨時間變化的曲線1
圖4? 密閉容器內O2濃度和CO2濃度隨相對濕度變化的曲線1
2.4.2? 實驗探究2: 探究金屬鈉在空氣中反應的原理
(1) 用鑷子夾取一小塊鈉,用濾紙把表面的煤油吸干,將鈉放在玻璃片上,用小刀切下薄片狀,觀察鈉表面的現象。
(2) 重復以上操作,迅速將片狀金屬鈉放入如圖1所示的三口瓶中間凹槽內。點擊數據采集,觀察鈉表面的現象以及數據曲線的變化。實驗結束,用鑷子取出鈉并放回原試劑瓶。實驗結果如圖5和圖6所示。
圖5? 密閉容器內O2濃度和相對濕度隨時間變化的曲線2
圖6? 密閉容器內CO2濃度和相對濕度隨時間變化的曲線2
2.4.3? 實驗探究3: 探究空氣相對濕度對金屬鈉在空氣中反應消耗O2和CO2速率的影響
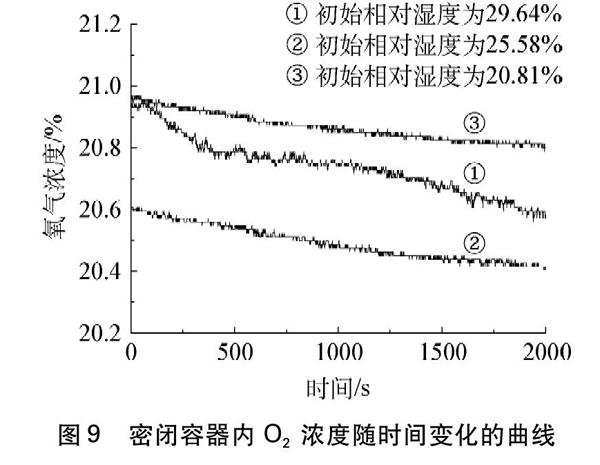
向三口瓶的左右兩個凹槽內分別滴加濃硫酸,待相對濕度數值穩定后,再重復實驗探究2實驗操作(2)。初始相對濕度控制在30%以下,設置不同的初始相對濕度進行比較。實驗結果如圖7、圖8和圖9所示。
圖7? 密閉容器內相對濕度隨時間變化的曲線
圖8? 密閉容器內CO2濃度隨時間變化的曲線
圖9? 密閉容器內O2濃度隨時間變化的曲線
2.5? 結果與討論
2.5.1? 實驗探究1
CO2傳感器是基于氣體的紅外吸收光譜隨物質的不同而存在差異的原理制成的。不同氣體分子化學結構不同,對不同波長的紅外輻射的吸收程度不同。由于空氣中存在多種氣體,其中水蒸氣對CO2氣體的紅外吸收有一定的影響。若要探究鈉在空氣中的反應,則需要排除由于傳感器自身原因造成的干擾。
由圖2曲線說明加入干燥劑濃硫酸后,隨時間變化,密閉容器內相對濕度逐漸降低,O2濃度基本不變;由圖3曲線說明CO2濃度隨著相對濕度的降低逐漸上升,CO2濃度上升約50ppm(原因有待進一步探究),且相對濕度降低到約為30%之后,CO2濃度基本保持不變;由圖4曲線說明空氣中相對濕度的變化對O2濃度的測定幾乎無影響,對CO2濃度的測定影響較小,在相對濕度低于30%時,CO2濃度基本保持不變。
因此在實驗探究2和實驗探究3中,涉及CO2濃度測定的實驗,設置密閉容器內初始相對濕度低于30%,為數據的真實有效提供了依據。
2.5.2? 實驗探究2
實驗探究2中實驗(1)可以觀察到剛切開金屬鈉后,表面呈現銀白色的金屬光澤,然后迅速變暗,再放置一段時間表面變白,空氣相對濕度較大時,可以觀察到表面有氣泡。說明鈉與空氣中的一些物質發生了反應,鈉與空氣中的水蒸氣反應生成氫氣。
實驗探究2中實驗(2)結果如圖5和圖6所示,由曲線說明隨著反應的進行,密閉容器內O2濃度、CO2濃度和相對濕度隨時間的推移逐漸降低。說明鈉與空氣中的O2、 CO2和H2O發生了反應。從反應開始時O2濃度、CO2濃度和相對濕度就逐漸降低,說明同時可能發生多個反應。
2.5.3? 實驗探究3
由圖7曲線說明隨著反應的進行,密閉容器中相對濕度逐漸降低。曲線①看出相對濕度由29.64%降低到20.43%, 2000s內降低9.21%;曲線②看出相對濕度由25.58%降低到17.36%, 2000s內降低8.22%;曲線③看出相對濕度由20.81%降低到16.11%, 2000s內降低4.7%。由以上數據說明初始相對濕度越大,空氣中的水蒸氣消耗速率就越快。
由圖8曲線說明隨著反應的進行,密閉容器中CO2濃度逐漸降低。曲線①看出CO2濃度在1000s時降到最低,且CO2濃度由336ppm降低到25ppm, CO2消耗速率為0.311ppm/s;曲線②看出CO2濃度在1050s時降到最低,且CO2濃度由302ppm降低到25ppm, CO2消耗速率為0.264ppm/s;曲線③看出CO2濃度在
1300s時降到最低,且CO2濃度由336ppm降低到25ppm, CO2消耗速率為0.239ppm/s。由以上數據表明初始相對濕度越大,空氣中的CO2消耗速率就越快。
由圖9曲線說明隨著反應的進行,密閉容器中O2濃度逐漸降低。曲線①看出O2濃度由20.91%降低到20.57%, 2000s內降低0.34%;曲線②看出O2濃度由20.60%降低到20.41%, 2000s內降低0.19%;曲線③看出O2濃度由20.94%降低到20.80%, 2000s內降低0.14%。由以上數據表明初始相對濕度越大,空氣中的O2消耗速率就越快。
2.6? 結論
(1) 常溫下,金屬鈉在空氣中涉及的反應較為復雜。由以上實驗可以得出,鈉與空氣中CO2、 O2、水蒸氣等物質發生反應,且同時可能發生多個反應。
(2) 初始相對濕度越大,鈉與空氣中CO2、 O2、水蒸氣反應速率就越快。
3? 反思與啟示
常溫下鈉在空氣中的反應是物質轉化的一個重要知識點,但是教學過程中現象的描述并不能有效地證明微觀的變化。如何將反應的微觀變化盡可能通過技術手段呈現出來,并能服務于日常的課堂教學已成為本實驗設計的主要思想。
本實驗中自制三口瓶的設計,主要是由于常規實驗儀器無法與O2傳感器、CO2傳感器匹配使用。三口瓶瓶口設計與傳感器匹配使用,形狀簡單、方便組裝、便于攜帶。該實驗設計運用于課堂教學,金屬鈉消耗少,微量化的實驗設計,節約了試劑,但獲得的信息量卻很豐富。利用O2傳感器、CO2傳感器和相對濕度傳感器同時進行實驗探究,從圖像曲線的變化可直觀地看到常溫下金屬鈉在空氣中的多個反應,解決了常規實驗現象無法解釋的問題,為理論推理提供了真實有效的實驗證據。
實驗過程中發現有以下問題需要進一步反思與改進的:
(1) 如何設計實驗更好地在短時間內觀察鈉表面的變化過程?
常溫下金屬鈉在空氣中反應,其表面現象發生變化比較緩慢,要想在課堂上短時間內觀察到相關現象比較困難。一般能觀察到金屬鈉表面變暗,接下來的現象就需要等待一段時間才行。相關影響因素中較容易改變的是金屬鈉的厚薄,但如何將鈉在短時間內壓成極薄的片狀也是一個難題。是否還可以從其他途徑著手呢?再者,如何設計“利用傳感器實驗探究氧氣濃度、二氧化碳濃度、相對濕度、鈉的表面積等因素對反應速率的影響”也是可深入探討的一個問題。
(2) 如何利用三口瓶進一步設計實驗?
三口瓶的設計新穎且簡單,可以用于多種物質的化學反應原理探究,如本實驗設計鈉在空氣中的反應,也可以設計實驗探究氫氧化鈉與CO2的反應、氫氧化鈉的潮解等。如何有效利用自制三口瓶進行多樣化的實驗設計,并服務于課堂教學?
后續還有很多相關工作要做,需要我們不斷去探索。
參考文獻:
[1]揚金華. 常溫下鈉與空氣中氧氣反應生成氧化鈉[J]. 化學教學, 1996, (11): 47~48.
[2]劉國慶. 鈉與氧氣反應實驗的改進[J]. 實驗教學與儀器, 2013, (4): 24~25.
[3]徐小健. 金屬鈉性質探究實驗的創新改進[J]. 化學教學, 2017, (2): 66~67.

