比較轉錄組分析揭示花生種皮花青素積累的分子調控機制
趙鈺涵 付春 朱琳 馬俊杰 周希萌 李長生 李愛芹 厲廣輝 夏晗 王興軍 趙傳志

摘要:花青素作為一種抗氧化物質,具有多種保健功效。與其他顏色花生相比,黑種皮花生具有良好的感官品質,且花青素含量更高。為了揭示花生黑種皮花青素形成和調控的分子機理,本研究以黑種皮花生(YH29)和粉紅種皮花生(WH10)為研究對象,通過RNA-seq技術比較其轉錄組的差異。結果表明,與粉紅種皮花生相比,黑種皮花生中1 539個基因表達上調,1 275個基因表達下調。KEGG分析發現花青素生物合成、苯丙素生物合成、類黃酮生物合成等多個與色素積累相關的通路在黑色種皮花生中富集。在黑種皮花生中,苯丙氨酸解氨酶、查爾酮合成酶等5個與花青素合成相關的關鍵酶基因表達上調,而與花青素生物合成途徑競爭同一底物的一些關鍵酶基因,如柚皮素和甘草素基因,則表達下調,這使得有更多的底物流向花青素合成途徑,這些基因的協同表達可能是黑種皮花青素高水平積累的關鍵。另外,兩個R2R3-MYB轉錄因子在黑種皮花生中也表達上調,可能是引起花青素合成關鍵基因表達差異的關鍵因素。我們的研究結果為深入研究花生種皮花青素合成的分子機理及培育高花青素含量的花生新品種提供了參考。
關鍵詞:黑花生;轉錄組分析;花青素;種皮顏色
中圖分類號:S565.2:Q78文獻標識號:A文章編號:1001-4942(2019)09-0001-08
Comparative Transcriptome Analysis Reveals Transcriptional
Regulation in Accumulating Anthocyanins in Peanut Testa
Zhao Yuhan , Fu Chun3, Zhu Lin , Ma Junjie2, Zhou Ximeng , Li Changsheng2,
Li Aiqin2, Li Guanghui2, Xia Han , Wang Xingjun , Zhao Chuanzhi
(1. College of Life Sciences, Shandong Normal University, Jinan 250014, China;
2. Biotechnology Research Center, Shandong Academy of Agricultural Sciences/Shandong Provincial
Key Laboratory of Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China;
3. Weifang Academy of Agricultural Sciences, Weifang 261071, China)
Abstract Anthocyanin is an antioxidant with health benefits to human. In comparison with peanut with other colors, black or dark purple peanut cultivars were enriched in anthocyanin and showed better organoleptic quality. To reveal the molecular mechanism of synthesis and regulation of anthocyanins in peanut, the RNA-seq technology was performed to investigate the transcriptome variation between the black testa (YH29) and pink testa (WH10) cultivars. In comparison with WH10, a total of 1 539 up-regulated and 1 275 down-regulated genes were identified in YH29. Among them, five genes encoding key enzymes of anthocyanin synthesis were up-regulated, while some genes related with competing for the same substrates with anthocyanin synthesis were down-regulated. The different expression of these genes led to more substrates used for anthocyanin synthesis pathway, suggesting that the co-expression of these genes might be the key factor of high anthocyanin accumulation in black testa cultivar. In addition, two R2R3-MYB transcription factors were found up-regulated in YH29, which might play important roles in regulating the differential expression of key genes in anthocyanin synthesis pathway. In conclusion, this study provided a reference for further studying the molecular mechanism of anthocyanin synthesis in peanut and breeding new peanut varieties with high anthocyanin content.
Keywords Black testa peanut; Transcriptome analysis; Anthocyanin; Testa color
花生是一種口感好、營養豐富的油料作物,在世界范圍內廣泛種植[1]。我國傳統的花生品種種皮顏色以粉紅色和紅色為主,黑色(或深紫色)種皮顏色的花生品種較少。與常規花生品種相比,黑色花生含有更多的花青素。
花青素是植物體內廣泛存在的一種黃酮類化合物,具有多種生物學功能。花青素有利于植物傳粉,種子傳播,同時在預防紫外損傷和防止病原體攻擊中具有重要作用[2,3]。在觀賞植物中,花青素、類胡蘿卜素或甜菜色素決定其五彩繽紛的花色[4,5]。對于很多果實和花卉來說,花青素是形成其重要品質特征的因素之一[6]。花青素能夠清除細胞內產生的超氧自由基,具有較強的抗氧化活性。花青素還有預防癌癥、炎癥和心臟病的功能,如紫色番茄富含花青素,可顯著抑制人結腸癌和卵巢癌細胞系的增殖[7,8]。茄科蔬菜中大量花青素可減少血管炎癥和預防血栓的形成[9]。
花青素的生物合成途徑主要包括以下步驟:①首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)作用下生成4-香豆酰-CoA。PAL是苯丙烷代謝途徑的第一個關鍵酶,決定了花青素合成的關鍵一步。②4-香豆酰-CoA和丙二酰-CoA在查爾酮合成酶(CHS)催化下合成查爾酮。CHS是花青素代謝途徑的關鍵限速酶,催化花青素合成途徑的第一步反應,是一類多基因家族編碼的酶[10,11]。目前,已經在葡萄[11]等多種植物中克隆鑒定出該類基因,該類基因具有一定的保守性。降低 CHS 基因的表達水平,會導致植物花色變淡[12]。③查爾酮異構酶(CHI)將查爾酮異構化為柚皮素。CHI是最早研究的類黃酮合成途徑的關鍵酶。④柚皮素在黃烷酮3-羥化酶(F3H)催化下轉化為二氫山奈酚。⑤二氫山奈酚在類黃酮3′-羥化酶(F3′H)和類黃酮3′5′-羥化酶(F3′5′H)催化下分別轉化為二氫槲皮素和二氫楊梅素。⑥二氫槲皮素和二氫楊梅素經二氫黃酮醇還原酶(DFR)催化分別轉化為無色矢車菊素和無色天竺葵素,DFR也可以直接催化二氫山奈酚為無色飛燕草素。⑦無色矢車菊素、無色天竺葵素和無色飛燕草素經隱色花青素雙加氧酶(LDOX/ANS)催化,轉化為矢車菊素、天竺葵素和飛燕草素。ANS 基因的表達直接影響植物花青素的積累,降低ANS的表達水平,會導致花青素合成水平明顯下降從而產生白色花[13];而過表達ANS可以增加花青素的積累[14]。⑧最后,在類黃酮3-O-葡糖基轉移酶(UFGT)的作用下形成花青素。在蘋果中CHS、F3H、DFR、LDOX/ANS、UFGT等酶的結構基因協同表達決定果皮花青素含量,而葡萄中UFGT表達在花青素積累過程中起著非常關鍵的作用[15]。
花青素的合成不僅與CHS、DFR、LDOX/ANS等結構基因的表達密切相關,同時還受轉錄因子如R2R3-MYB、bHLH、WD40和HY5的調控[16]。雖然對花青素生物合成中的MBW(MYB-bHLH-WD40)絡合物已有豐富的認識,但MYB轉錄因子仍是人們關注的焦點,而bHLH轉錄因子可單獨或通過與MYB結合成為二聚體來結合DNA[17],從而啟動基因的表達[18]。紫娟茶紫色葉片MYB-bHLH-WDR復合物通過激活F3H、DFR和ANS基因表達來調控花青素的積累[19]。柿子中WD40蛋白與Myb2和Myb4相互作用共同調節原花色素的合成[20]。玉米中MYB蛋白的激活可分為bHLH非依賴性和bHLH依賴性兩種模式,如調節玉米中花青素途徑的R2R3-MYB C1蛋白通過與bHLH轉錄因子相互作用以結合到啟動子上,啟動基因轉錄;而調節玉米中吡咯烷途徑的R2R3-MYB蛋白可以在沒有bHLH轉錄因子的情況下激活相同的啟動子[21]。有些MYB轉錄因子不需要依賴WD40蛋白而參與調控花青素的合成,如擬南芥MYB11、MYB12和MYB111[22]。這些結果表明,一部分MYB需要同時表達bHLH和WD40才能發揮作用,而其他MYB可以單獨誘導花青素合成[23]。HY5是多種光感受器家族的下游因子,促進光形態發生[24],其在花青素合成中也可直接與相關酶基因啟動子區結合,調控基因表達[25];還可通過誘導擬南芥MYB75/PAP1轉錄因子的轉錄來調控花青素的生物合成[26]。
隨著研究的深入,擬南芥、葡萄、蘋果等植物中花青素合成和調控的機理逐漸清晰,為研究其他植物花青素的合成和調控奠定了基礎。本研究利用RNA-Seq分析方法,研究了WH10(粉紅種皮)和YH29(黑種皮)兩種種皮顏色差異較大的花生品種的差異表達基因,并對不同種皮顏色品種的花青素生物合成和調控基因的表達水平進行分析。該項工作有助于加深我們對黑花生種皮中花青素在代謝和分子水平上的特異性積累的理解。
1 材料與方法
1.1 試驗材料
所用花生材料分別為黑種皮花生YH29和粉紅種皮花生WH10。YH29由開封市農林科學院鄧麗老師提供;WH10是出口型大花生品種,由濰坊市農業科學院付春老師提供。
1.2 花青素含量的測定
參照Serrano等[27]的方法進行花生花青素含量的測定,具體步驟如下:稱取50 mg 花生葉和莖分別置于1.5 mL 離心管中,在液氮中將其研成粉末;加入700 μL酸性甲醇(甲醇與HCl體積比為99∶1),于4℃過夜提取;然后于4℃、12 000 r/min離心1 min,取600 μL上清液置于新的離心管中,加入1 mL三氯甲烷,再加400 μL蒸餾水,于4℃、12 000 r/min離心10 min,上清液用于花青素含量測定;利用分光光度儀(U-3000,HITACHI)分別在530 nm與657 nm處測定吸光值。計算公式如下:花青素含量=(OD530-0.25OD657)/m,式中,OD530為花青素在530 nm波長下的光密度,OD657為葉綠素在657 nm波長下的光密度,m為樣品質量(g)。設置3組生物學重復,每組重復測量3次。
1.3 轉錄組文庫的構建和高通量測序
采用RNAiso試劑(Takara,中國)從不同花生材料新鮮葉片中分離總RNA,經DNase I (Takara,中國)處理,去除污染的基因組DNA。用1.0%瓊脂糖凝膠和NanoDrop電泳檢測RNA質量。mRNA被富集并分裂成短片段(約200 nt )。以mRNA片段為模板,利用隨機六聚體引物合成第一鏈cDNA。第一鏈cDNA與DNA聚合酶Ⅰ、緩沖液、dNTPs、RNase H進一步合成第二鏈cDNA。在每一個片段之后加入一個核苷酸(腺嘌呤),完成末端修復,然后將測序接頭連接到片段上。最后,通過PCR擴增純化片段并進行富集,構建cDNA文庫。每個樣品設置3個生物學重復。
構建好的轉錄組文庫由深圳華大基因科技有限公司進行高通量測序,測序使用BGISEQ-500平臺。測序所得的raw reads需進行質控(QC)處理,獲得clean reads用于后續分析。
1.4 生物信息學分析
從Peanutbase(https://peanutbase.org/)下載栽培花生Tifrunner的基因組序列。將clean reads比對到花生參考基因組上,通過統計比對率、reads在參考序列上的分布情況等,判斷比對結果是否通過第二次質控(QC)。然后進行基因定量分析、基于基因表達水平的各項分析,對篩選出的差異表達基因進行GO功能顯著性富集分析、pathway顯著性富集分析、聚類、蛋白互作網絡和轉錄因子等分析。
基因的表達量采用FPKM(Fragments Per Kilobase Million)進行均一化處理,使用Log2(YH29/WH10)計算基因的相對表達量。差異倍數為兩倍以上并且Q-value≤0.001的基因為表達顯著差異基因。
2 結果與分析
2.1 花生色素積累的表型鑒定
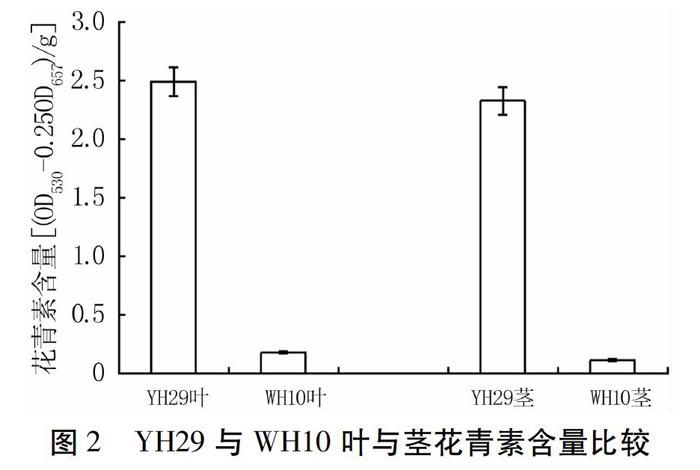
為了研究黑色花生種皮中色素的積累特性,本研究選取了具有典型種皮顏色的代表性品種YH29和WH10。YH29種皮呈黑色,葉、花顏色與WH10相比較深,特別是葉柄,但兩個品種胚的顏色沒有差異(圖1)。同時,對葉和莖中花青素含量進行測定,YH29葉和莖中花青素含量都顯著高于WH10(圖2)。
2.2 高通量測序和基因表達譜
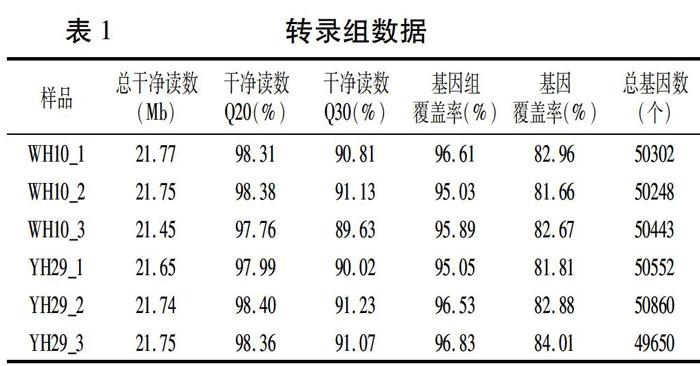
為了獲得不同種皮顏色基因表達譜,利用YH29和WH10構建了6個cDNA文庫,利用BGISEQ-500平臺對cDNA文庫進行測序,每個樣品平均產出21.69 Mb數據,消除低質量序列后共獲得130.11 Mb的clean reads(干凈讀數),平均讀取率為99.36%(表1)。使用HISAT將clean reads比對到參考基因組序列,YH29平均有96.14%匹配到參考基因組,WH10平均有95.84%匹配到參考基因組。大部分的轉錄本被完整覆蓋,reads均勻分布在轉錄本的各個區域。
2.3 差異表達基因的鑒定和功能分析
使用Bowtie2將clean reads比對到參考基因組序列上,然后使用RSEM計算各個樣品的基因表達水平,在兩個樣品中鑒定出2 814個差異基因,與WH10相比,YH29中1 539個表達上調,1 275個表達下調。對差異基因進行GO分類(圖3),分類在生物過程、細胞成分和分子功能三個部分中。在生物過程中,“代謝過程”中差異基因的數目最多,“細胞過程”差異基因數目次之,其次是“生物調節”、“定位”和“刺激反應”。在細胞成分中,“細胞”、“膜”、“細胞器”中差異基因數目較多。在分子功能中,“催化活性”和“結合”的差異基因數目明顯多于其他功能,其中含有多個MYB、bHLH、WRKY等轉錄因子(表2)。
為了獲得更多的生物學信息,深入了解花生花青素積累機制,我們對KEGG富集途徑進行分析,結果(表3)表明,有20條途徑被富集,其中,花青素生物合成途徑排在首位。表4列出了與花青素合成通路相關的基因及其表達量,14個相關基因中有12個在YH29中表達上調,2個表達下調。另外,類黃酮生物合成、異黃酮生物合成等途徑均被富集,以往的研究表明,這些途徑的代謝變化都與花青素的積累相關。
3 討論
3.1 花青素生物合成關鍵酶結構基因的調控
植物中花青素生物合成途徑已經相對比較清楚,在本研究中花青素合成過程中的關鍵酶PAL、CHS、DFR、LDOX/ANS、UFGT基因表達均上調(圖4)。其中,PAL作為苯丙烷代謝途徑的第一個關鍵酶,其兩個編碼基因(5H4H17、FI9C9D)表達上調,使4-香豆酰-CoA大量積累,為花青素的積累提供更多底物。CHS作為花青素代謝途徑的關鍵限速酶,其7個編碼基因(GQLW6A、95I963、QZN0LQ、BCQ67I、0FI6RG、UDJX6I、BDJ8VI)表達上調十分明顯,會產生大量的查爾酮。2個DFR基因(7JZ58T、X8EVF3)表達上調,可以使更多的二氫山奈酚流入花青素合成途徑,從而產生更多的無色花色素。LDOX/ANS是花青素合成的最后一個關鍵酶,在本研究中,編碼LDOX/ANS的7個基因(UQ0Z3E、AQ6B1J、FYP25E、9KNF1J、KX8RC4、36PEC4、N5X18U)表達均上調,直接影響花青素的積累[28]。UFGT是花青素生物合成途徑中的最后一種酶,本研究中,編碼UFGT的一個基因(31BJ59)也是表達上調的。上述結果表明,PAL、CHS、DFR、LDOX/ANS、UFGT酶的結構基因協同表達共同促進了花青素積累。
3.2 花青素合成積累過程中支鏈途徑的調控
花青素生物合成途徑的中間體也可用于合成其他次生物質,例如,4-香豆酰-CoA是木質素、生物堿的主要前體[30],三個合成途徑共同競爭底物4-香豆酰-CoA。在木質素和生物堿合成過程中,4-香豆酸-CoA連接酶(4CL)長期以來被認為是該途徑中的一個重要調控點[31]。本研究(表5)發現,黑花生中編碼4CL的基因顯著下調,使木質素合成途徑的中間體減少;同時編碼咖啡酸3-O-甲基轉移酶(COMT)的基因也顯著下調,編碼F5H的基因也是下調的,COMT和F5H在木質素合成的多個過程中起催化作用,編碼這兩個酶的基因下調使木質素積累減少,更多的底物進入花青素途徑。綜上所述,在木質素合成過程中,編碼相關酶的基因都顯著下調,其結果是使更多的底物流向花青素合成途徑。
異黃酮是豆科植物次生代謝產物[32],異黃酮生物合成途徑與花青素生物合成途徑共同競爭底物柚皮素和甘草素。本研究結果表明,黑花生編碼此過程相關酶的基因也存在下調現象,其結果也使更多的底物流向花青素合成途徑從而增加花青素的積累。
3.3 花青素合成積累過程中轉錄因子的調控
花青素代謝途徑受MYB-bHLH-WD40轉錄復合物在轉錄水平上的調控,在本研究中,差異表達基因中有MYB轉錄因子31個,bHLH轉錄因子30個(表2),表達量在黑皮花生中上調最明顯的兩個MYB轉錄因子是與花青素合成相關的R2R3-MYB,其中一個MYB3R-3轉錄因子。早期研究發現它決定器官大小,參與細胞增殖的時間和空間調控,是產生具有特定大小和形態器官的關鍵因子[33]。表達下調最明顯的一個MYB轉錄因子是MYB124,研究發現它在擬南芥中有控制葉片上氣孔數量的功能[34]。在黑花生中表達上調最明顯的bHLH轉錄因子屬于bHLH96。一個HY5蛋白在黑花生中也是表達上調的,這些轉錄因子可能也參與黑花生中花青素的積累。
4 結論
本研究發現花生品種YH29和WH10種皮、葉、花、莖花青素含量不同,并造成了其顏色的差異。通過比較轉錄組分析發現,YH29花青素生物合成途徑中5種關鍵酶的編碼基因均上調表達,而在與花青素生物合成相競爭的其他代謝途徑中編碼相關酶的基因表達下調,其結果使更多的底物流向花青素代謝途徑。另外, MYB等轉錄因子的差異表達也可能是調控YH29中花青素積累的重要因素。本研究結果可為深入研究花生種皮花青素合成的分子機理及培育高花青素含量的花生新品種提供參考。
參 考 文 獻:
[1]Huang J, Xing M, Li Y, et al. Comparative transcriptome analysis of the skin-specific accumulation of anthocyanins in black peanut (Arachis hypogaea L.)[J].J. Agric. Food Chem., 2019, 67(4): 1312-1324.
[2]Regan B C, Julliot C, Simmen B, et al. Fruits, foliage and the evolution of primate colour vision[J].Philos. Trans. R Soc. Lond B Biol. Sci., 2001, 356(1407): 229-283.
[3]Howe G A, Jander G. Plant immunity to insect herbivores[J].Annu. Rev. Plant Biol., 2008, 59: 41-66.
[4]Xu W, Dubos C, Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J].Trends Plant Sci., 2015, 20(3): 176-185.
[5]Hsu C C, Chen Y Y, Tsai W C, et al. Three R2R3-MYB transcription factors regulate distinct floral pigmentation patterning in Phalaenopsis spp.[J].Plant Physiol., 2015, 168(1): 175-191.
[6]Pavel S, Jurgita P, Kazanaviiūt V, et al. Expression and anthocyanin biosynthesis-modulating potential of sweet cherry (Prunus avium L.) MYB10 and bHLH genes[J].PLoS ONE, 2015, 10(5): e0126991.
[7]Gallus S, Talamini R, Giacosa A, et al. Does an apple a day keep the oncologist away?[J].Ann. Oncol., 2005, 16(11): 1841-1844.
[8]Mazzucato A, Willems D, Bernini R, et al. Novel phenotypes related to the breeding of purple-fruited tomatoes and effect of peel extracts on human cancer cell proliferation[J].Plant Physiol. Biochem., 2013, 72: 125-133.
[9]Watson R R, Schnlau F. Nutraceutical and antioxidant effects of a delphinidin-rich maqui berry extract Delphinol: a review[J].Minerva Cardioangiol, 2015, 63(2 Suppl 1): 1-12.
[10]Durbin M L, McCaig B, Clegg M T. Molecular evolution of the chalcone synthase multigene family in the morning glory genome[J].Plant Mol. Biol., 2000, 42(1): 79-92.
[11]Koes R E, Spelt C E, van den Elzen P J M, et al. Cloning and molecular characterization of the chalcone synthase multigene family of Petunia hybrida[J].Gene, 1989, 81(2): 245-257.
[12]Sparvoli F, Martin C, Scienza A, et al. Cloning and molecular analysis of structural genes involved in flavonoid and stilbene biosynthesis in grape (Vitis vinifera L.)[J].Plant Mol. Biol., 1994, 24(5): 743-755.
[13]Nakamura N, Fukuchi-Mizutani M, Miyazaki K, et al. RNAi suppression of the anthocyanidin synthase gene in Torenia hybrida yields white flowers with higher frequency and better stability than antisense and sense suppression[J].Plant Biotechnology, 2006, 23: 13-17.
[14]Reddy A M, Reddy V S, Scheffler B E, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J].Metabolic Engineering, 2007, 9(1): 95-111.
[15]Boss P K, Robinson D S P. Analysis of the expression of anthocyanin pathway genes in developing Vitis vinifera L. cv. Shiraz grape berries and the implications for pathway regulation[J].Plant Physiol., 1996, 111(4): 1059-1066.
[16]Lu Y Z M, Meng X, Wan H, et al. Photoperiod and shading regulate coloration and anthocyanin accumulation in the leaves of malus crabapples[J].Plant Cell Tissue Organ Cult., 2015, 121: 619-632.
[17]Liu X F, Yin X R, Andrew C,et al. The role of MrbHLH1 and MrMYB1 in regulating anthocyanin biosynthetic genes in tobacco and Chinese bayberry (Myrica rubra) during anthocyanin biosynthesis[J].Plant Cell,Tissue and Organ Culture, 2013, 115: 285-298.
[18]Feller A, Machemer K, Braun E L, et al. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors[J].Plant J., 2011, 66: 94-116.
[19]Sun B, Zhu Z, Cao P, et al. Purple foliage coloration in tea (Camellia sinensis L.) arises from activation of the R2R3-MYB transcription factor CsAN1[J].Sci. Rep., 2016, 6: 32534.
[20]Naval M D M, GIL-Munoz F, Lloret A, et al. A WD40-repeat protein from persimmon interacts with the regulators of proanthocyanidin biosynthesis DkMYB2 and DkMYB4[J].Tree Genetics & Genomes, 2016, 12(1): 13.
[21]Sainz M B, Grotewold E, Chandler V L. Evidence for direct activation of an anthocyanin promoter by the maize C1 protein and comparison of DNA binding by related Myb domain proteins[J].Plant Cell, 1997, 9(4): 611-625.
[22]Abe H, Urao T, Ito T, et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J].Plant Cell, 2003, 15(1): 63-78.
[23]Dasgupta K, Thilmony R, Stover E, et al. Novel R2R3-MYB transcription factors from Prunus americana?????? regulate differential patterns of anthocyanin accumulation in tobacco and citrus[J].GM Crops Food, 2017, 8(2): 85-105.
[24]Lee J, He K, Stolc V, et al. Analysis of transcription factor HY5 genomic binding sites revealed its hierarchical role in light regulation of development[J].Plant Cell, 2007, 19: 731-749.
[25]Zhang H Y, He H, Wang X C, et al. Genome-wide mapping of the HY5-mediated genenetworks in Arabidopsis that involve both transcriptional and post-translational regulation[J].Plant J., 2011, 65: 346-358.
[26]Shin D H, Choi M, Kim K, et al. HY5 regulates anthocyanin biosynthesis by inducing the transcriptional activation of the MYB75/PAP1 transcription factor in Arabidopsis[J].FEBS Lett., 2013, 587: 1543-1547.
[27]Serrano M, Kanehara K, Torres M, et al. Repression of sucrose/ultraviolet B light-induced flavonoid accumulation in microbe-associated molecular pattern-triggered immunity in Arabidopsis[J].Plant Physiology, 2012, 158(1):408-422.
[28]Shin D H, Choi M, Kim K, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J].Metab. Eng., 2007, 9(1): 95-111.
[29]Koes R, Verweij W, Quattrocchio F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways[J]Trends Plant Sci., 2005, 10(5): 236-242.
[30]Wang L, Pan D, Liang M, et al. Regulation of anthocyanin biosynthesis in purple leaves of Zijuan tea (Camellia sinensis var. kitamura)[J].Int. J. Mol. Sci., 2017, 18(4): 833.
[31]Knobloch K H, Hahlbrock K. Isoenzymes of p-coumarate: CoA ligase from cell suspension cultures of Glycine max[J].Eur. J. Biochem., 1975, 52(2): 311-320.
[32]Kim H K, Jang Y H, Baek I S, et al. Polymorphism and expression of isoflavone synthase genes from soybean cultivars[J].Mol. Cells, 2005, 19(1): 67-73.
[33]Kobayashi K, Suzuki T, Iwata E, et al. Transcriptional repression by MYB3R proteins regulates plant organ growth[J].The EMBO Journal, 2015, 34(15): 1992-2007.
[34]Yang M. The FOUR LIPS (FLP) and MYB88 genes conditionally suppress the production of nonstomatal epidermal cells in Arabidopsis cotyledons[J].American Journal of Botany, 2016, 103(9):1559-1566.
收稿日期:2019-09-05
基金項目:山東省良種工程課題(2016LZGC025, 2017LZN032);山東省重點研發計劃項目(2019GNC106026, 2019GSF107008, 2018GSF121032);山東省自然科學基金項目(ZR2017MC005);山東省泰山學者項目;山東省農業科學院農業科技創新工程項目(CXGC2018E13, CXGC2016B02);山東省農業科學院青年英才培養計劃項目
作者簡介:趙鈺涵(1992—),女,碩士研究生,主要從事花生基因組學和遺傳育種研究。E-mail:zyh685119@163.com
通訊作者:王興軍(1966—),男,博士,研究員,主要從事花生基因組學和遺傳育種研究。E-mail:xingjunw@htomail.com
趙傳志(1981—),男,博士,副研究員,主要從事花生基因組學和遺傳育種研究。E-mail:chuanzhiz@126.com

