基于Design-Expert回歸分析的藜麥葉黃酮提取工藝優化
魏志敏,呂瑋,裴美燕,宋世佳,盧川,劉秋紅,李順國*
(1.河北省農林科學院谷子研究所,河北省雜糧研究實驗室,國家谷子改良中心,河北 石家莊 050035;2.國家半干旱農業工程技術研究中心,河北 石家莊 050051;3.邯鄲市邯山區農業農村局,河北 邯鄲 560000;4.河北醫科大學臨床醫學院,河北石家莊 050000)
藜麥原產于安第斯山脈,有5 000 a以上的種植歷史,是印加土著居民的主要傳統食物,近年來藜麥葉的食用價值得到了人們越來越多的廣泛認可。藜麥葉含有人體必需的氨基酸、維生素、微量元素等多種營養成分,還富含黃酮等多種生物活性成分,因此,具有較高的食用價值和一定的藥用價值[1,2]。醫學研究表明,黃酮類化合物具有抗氧化,改善血管彈性,抗癌、抗菌、殺菌,治療冠心病、心絞病、高血壓,止咳、平喘、祛痰等功效[3]。當前藜麥子粒已經成為功能食品研究利用的熱點,受到各國消費者的廣泛青睞,但對藜麥苗的保健成分研究還較少。
本項目以藜麥葉為試驗原料,以總黃酮為研究對象,以乙醇作為提取溶劑,在單因素試驗的基礎上,采用Design-Expert分析對藜麥葉黃酮提取工藝進行優化,以期獲得較高的提取率,為菜用藜麥在食品和藥品領域的應用提供一定的參考。
1 材料與方法
1.1 試驗材料
1.1.1 藜麥苗 樣品于2019年5月6日采自河北省農林科學院郄馬試驗站,株高15 cm,冷凍烘干后粉碎、研磨,過50目篩,裝袋備用。
1.1.2 藥劑 蘆丁標準品:光譜純,國藥集團化學試劑有限公司生產;無水乙醇和氫氧化鈉:分析純,天津大茂化學試劑廠生產;亞硝酸鈉和硝酸鋁:分析純,上海國藥集團化學試劑有限公司生產。
1.1.3 儀器與設備 6202高速粉碎機:北京環亞天元機械有限公司生產;UV-3200PCS型紫外-可見分光光度計:上海美譜達儀器有限公司生產;電子天平:精度0.1mg,上海奧豪斯有限公司生產;SHZ-D(Ⅲ)循環水式真空泵:上海青浦滬西儀器廠生產;RE-522A型旋轉蒸發儀:上海亞榮生化儀器廠生產;DK-S26型數顯恒溫水浴鍋:蘇州威爾實驗用品有限公司生產。
1.2 試驗方法
1.2.1 標準曲線的繪制 精密稱取蘆丁標準品5.0 mg置于25 mL容量瓶內,加入體積分數70%的乙醇溶液,充分溶解、搖勻后定容,得到0.2 mg/mL的蘆丁標準溶液。分別準確吸取蘆丁標準溶液0、0.5、1.0、2.0、3.0、4.0、5.0 mL置于10 mL試管內,依次加入質量分數5%的NaNO2溶液0.3 mL混勻,室溫下靜置6 min后加質量分數10%的Al(NO3)3溶液0.3 mL搖勻,靜置6 min后再加入質量分數4%的NaOH溶液4.0 mL,再用體積分數70%的乙醇溶液定容10 mL搖勻,放置15 min,以不加蘆丁標準溶液處理為空白對照,用紫外分光光度計測定波長510 nm處的吸光度。每個處理重復3次,每個重復在測定吸光度時再重復測定3次,以吸光度(Y) 為縱坐標、濃度(mg/mL)為橫坐標(X)繪制標準曲線。
1.2.2 單因素試驗(單因素對藜麥葉黃酮提取量的影響) 準確稱取1.00 g藜麥苗粉6份,分別置于100 mL圓底燒瓶中;然后,固定乙醇體積分數、提取溫度、提取時間和液料比中的3個因素,進行不同單因素對黃酮提取量的影響試驗。回流提取后,將提取液濃縮至近干,加體積分數70%的乙醇溶解并定容至50 mL,用紫外分光光度計測定波長510 nm處的吸光度。每個處理重復3次,每個重復在測定吸光度時再重復測定3次。
1.2.2.1 乙醇體積分數對黃酮提取量的影響。固定液料比(mL/g,下同) 25∶1,分別加入體積分數40%、50%、60%、70%、80%、90%的乙醇溶液25 mL,在溫度60℃條件下回流提取100 min。
1.2.2.2 提取溫度對黃酮提取量的影響。固定液料比25∶1,用體積分數70%的乙醇溶液25mL,分別在溫度30、40、50、60、70、80℃條件下回流提取100 min。
1.2.2.3 提取時間對黃酮提取量的影響。固定液料比25∶1,用體積分數70%的乙醇溶液25 mL,在溫度60℃條件下分別回流提取60、80、100、120、140、160 min。
1.2.2.4 液料比對黃酮提取量的影響。液料比分別設定為 10∶1、15∶1、20∶1、25∶1、30∶1、35∶1,用體積分數70%的乙醇溶液25 mL,在溫度60℃條件下回流提取100 min。
1.2.3 響應面試驗(響應面法對藜麥葉黃酮提取工藝的優化分析) 根據單因素試驗結果,應用Design-Exper 10軟件的中心組合設計方法,設計乙醇體積分數(A)、提取溫度(B)、提取時間(C) 和液料比(D)4個因素的響應面試驗。根據建立的數學模型,得到較優后的藜麥葉黃酮提取工藝。
1.2.4 數據統計分析 單因素試驗數據采用Microsoft Office Excel 7.0軟件進行統計并制圖。根據單因素試驗結果,應用Design-Exper 10軟件的中心組合設計方法,進行乙醇體積分數(A)、提取溫度(B)、提取時間(C) 和液料比(D) 四因素三水平(表1) 的響應面試驗設計,得到2個不同因素互作的立體三維圖。
2 結果與分析
2.1 蘆丁濃度-吸光度標準曲線的繪制
依據不同濃度蘆丁溶液的吸光度結果,繪制標準曲線(圖1)。對試驗數據進行回歸分析,得到蘆丁濃度-吸光度線性回歸方程為Y=0.292x+0.014 781(R2=0.999 6)。可以看出,在蘆丁濃度0.01~0.1 mg/mL范圍內,吸光度與濃度呈正比。
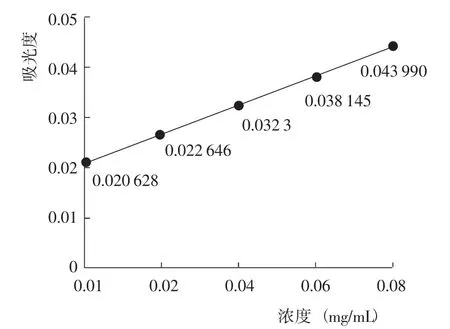
圖1 蘆丁濃度-吸光度標準曲線Fig.1 Standard curve between concentration and absorbance of rutin
2.2 藜麥葉黃酮提取方法的單因素試驗結果
2.2.1 乙醇體積分數對黃酮提取量的影響 在液料比25∶1、提取溫度60℃、提取時間100 min條件下,藜麥葉片黃酮提取量隨著乙醇體積分數的提高呈先增加后降低的變化,其中乙醇體積分數為70%時黃酮提取量最高(圖2)。因此認為,最佳乙醇體積分數為70%。
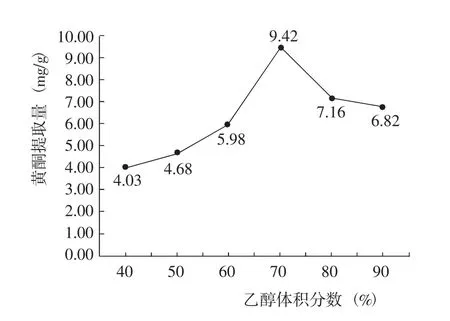
圖2 乙醇體積分數對黃酮提取量的影響Fig.2 Effect of ethanol volume fraction on the extraction amount of flavonoid
2.2.2 提取溫度對黃酮提取量的影響 在乙醇體積分數70%、液料比25∶1、提取時間60 min條件下,藜麥葉片黃酮提取量隨著提取溫度的升高呈先增加后降低的變化,其中提取溫度為60℃時黃酮提取量最高(圖3)。因此認為,最佳提取溫度為60℃。

圖3 提取溫度對黃酮提取量的影響Fig.3 Effect of extraction temperature on the extraction amount of flavonoid
2.2.3 提取時間對黃酮提取量的影響 在乙醇體積分數70%、液料比25∶1、提取溫度60℃條件下,藜麥葉片黃酮提取量隨著提取時間的延長呈先增加后降低的變化,其中提取時間為100 min時黃酮提取量最高(圖4)。因此認為,最佳提取時間為100 min。
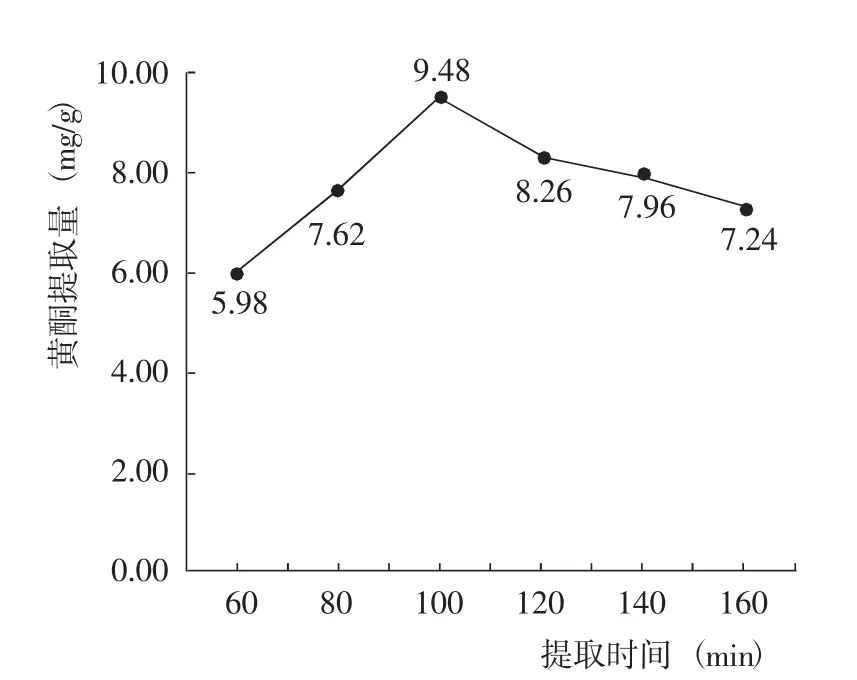
圖4 提取時間對黃酮提取量的影響Fig.4 Effect of extraction time on the extraction amount of flavonoid
2.2.4 液料比對黃酮提取量的影響 在乙醇體積分數70%、提取溫度為60℃、提取時間100 min條件下,黃酮提取量隨著液料比的增大呈先增加后降低的變化,其中液料比為30∶1時黃酮提取量最高(圖5)。因此認為,最佳液料比為30∶1。
2.3 藜麥葉黃酮提取方法的響應面優化分析結果
根據單因素試驗結果,應用Design-Exper 10軟件的中心組合設計方法,進行乙醇體積分數(A)、提取溫度(B)、提取時間(C) 和液料比(D) 四因素三水平(表1)的響應面試驗設計,共設計出29個組合(表2)。利用Design-Exper 10軟件對試驗結果進行分析,得到黃酮提取量(Y)對4個因素的二次多項回歸方程:
Y=11.951 81+0.915 00A+0.511 667B+0.186 67C+0.86857D+0.04000AB-0.22000AC+0.43000AD+0.25500BC-0.88000BD+0.09500CD-1.84614A2-1.996 14B2-1.473 64C2-2.267 27D2
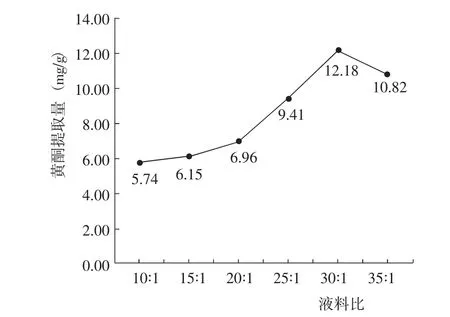
圖5 液料比對黃酮提取量的影響Fig.5 Effect of liquid material ratio on the extraction amount of flavonoid
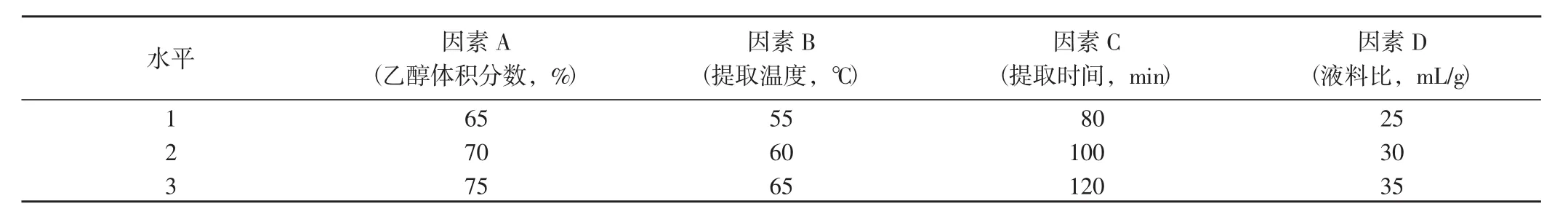
表1 響應面分析因素水平表Table 1 Factors and levels in response surface design
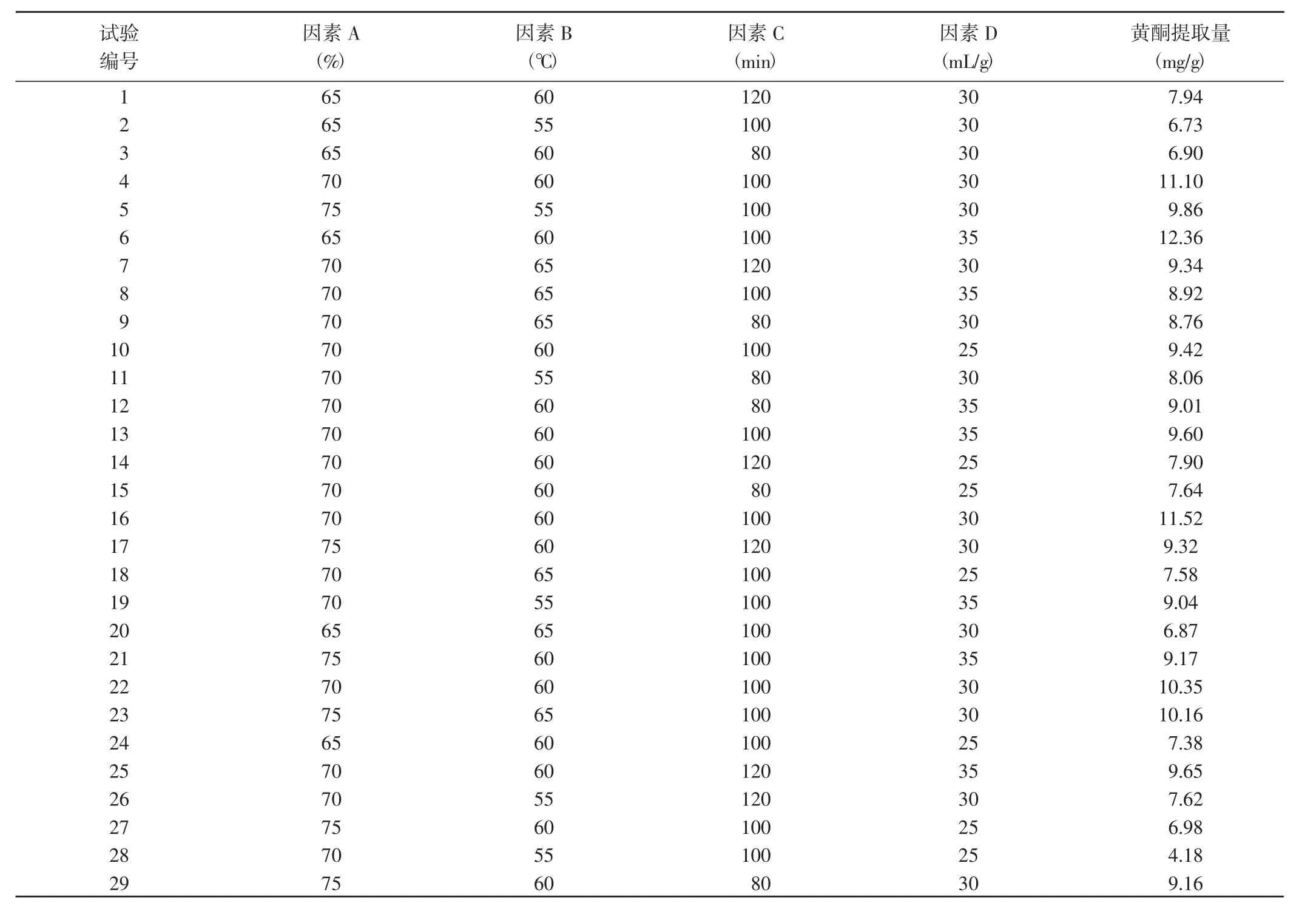
表2 藜麥葉黃酮提取量的響應面試驗設計與結果Table 2 Response surface test design and results of extraction amount of flavonoid from quinoa
對回歸方程進行方差分析,結果(表3)顯示,模型P(0.0004) <0.05,同時失擬項 P(0.2176) >0.1000,表示正交試驗結果可以與數學模型擬合良好。各因素對黃酮提取量的影響程度順序為提取時間<提取溫度<乙醇體積<液料比,其中乙醇體積和液料比對黃酮提取量的影響達到了極顯著水平。
響應面圖形是響應值對應于試驗因子A、B、C、D所構成的三維空間的曲面圖,從響應面分析圖上可以直觀形象地看出響應值與各參數之間相互作用產生的影響。根據回歸方程得出不同因子的響應面分析圖(圖6~11),可以較直觀地看出兩因素交互作用對藜麥葉中總黃酮得率的影響。若彎曲程度大,則表明該因素對總黃酮提取量的影響越大,相應表現為響應值變化的大小。通過軟件Design-Expert分析,確定最佳黃酮提取工藝為乙醇體積分數70%、液料比30∶1、提取時間100 min、提取溫度61℃,黃酮提取量最大值為12.41 mg/g。測定結果穩定,與理論預測值吻合。
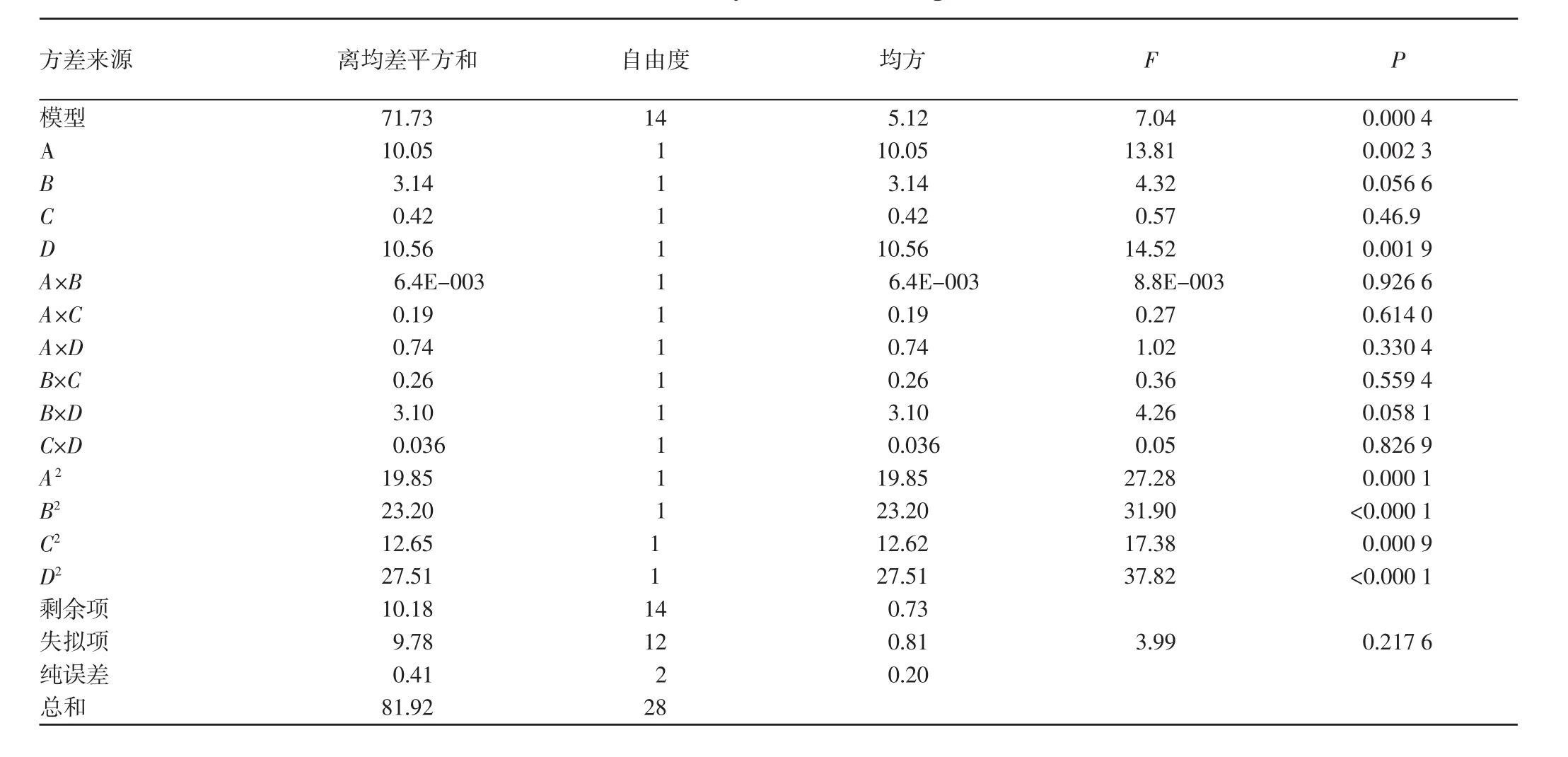
表3 回歸模型的方差分析結果Table 3 Variance analysis results of regression model
3 結論與討論
本研究中,首先分別考察了乙醇體積分數、浸提時間、浸提溫度和液料比對藜麥葉黃酮提取量的影響,結果顯示,隨著4個因素水平的升高,黃酮類物質含量呈先增加后降低的變化。隨著乙醇體積分數的增大,藜麥葉黃酮得量呈先增加后減少的趨勢,當乙醇體積分數為70%時,總黃酮得量最大。說明當乙醇體積分數大于70%時,溶劑的極性降低,導致黃酮類物質的溶解度降低。隨著提取溫度的升高,黃酮類物質的溶解和擴散速度加快,從而有利于物質的提取;同時,黃酮類物質氧化反應速度也加快,不利于提取。確定恰當的溫度是重要參數,本研究中最佳提取溫度為60℃。提取時間過短,不能充分提取黃酮類物質;提取時間過長,氧化反應會導致黃酮類物質結構破壞,也不利于提取。本研究條件下,提取時間為100 min時得到的黃酮量最多。液料比增大可促進藜麥葉粉的溶解和擴散,但是達到平衡后,繼續增加液料比反而不利于黃酮的提取,當液料比為30∶1時提取的黃酮量最多。在單因素試驗的基礎上設計響應面試驗,結果顯示,在乙醇體積分數65%、液料比35∶1、提取時間100 min、提取溫度60℃條件下,黃酮提取量可以達到12.36 mg/g。
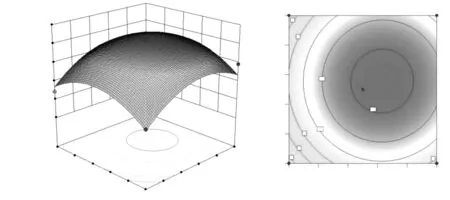
圖6 乙醇體積分數與提取溫度交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.6 Interaction effect of ethanol volume fraction and extraction temperature on the contour and response surface diagram of extraction amount of flavonoid
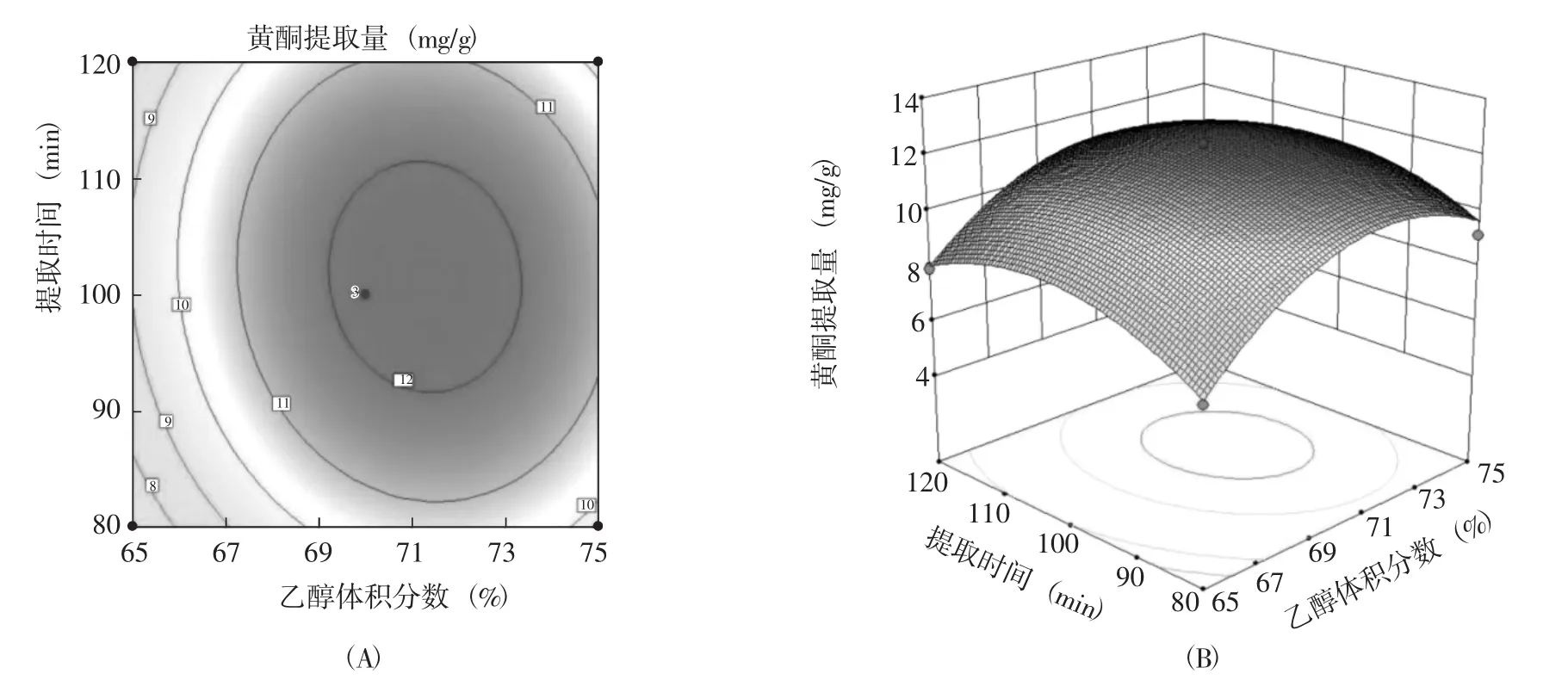
圖7 乙醇體積分數與提取時間交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.7 Interaction effect of ethanol volume fraction and extraction time on the contour and response surface diagram of the extraction amount of flavonoids
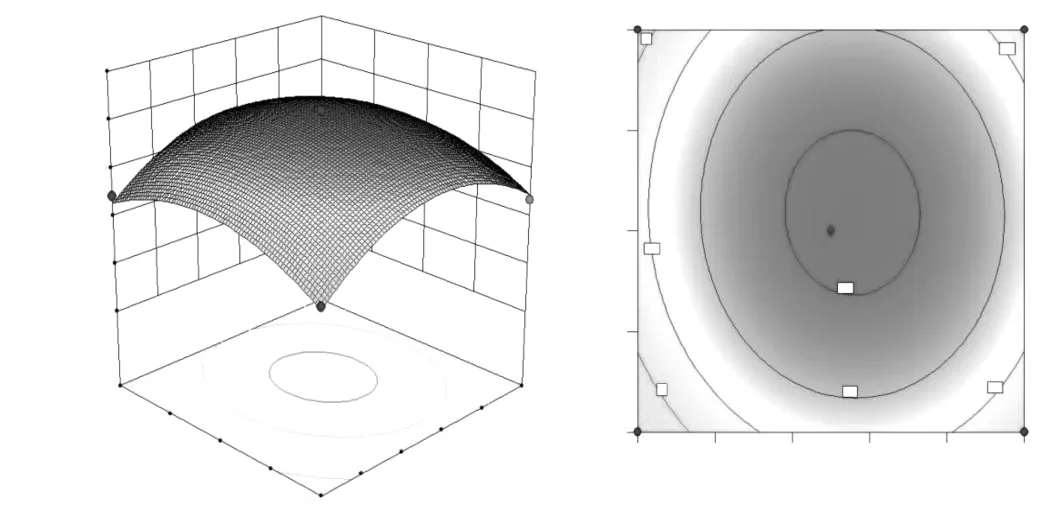
圖8 提取溫度與提取時間交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.8 Interaction effect of extraction temperature and extraction time on the contour and response surface diagram of extraction amount of flavonoid
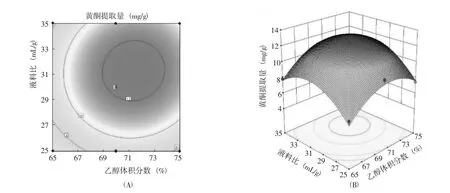
圖9 乙醇體積分數與液料比交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.9 Interaction effect of ethanol volume fraction and liquid material ratio on the contour and response surface diagram of extraction amount of flavonoid
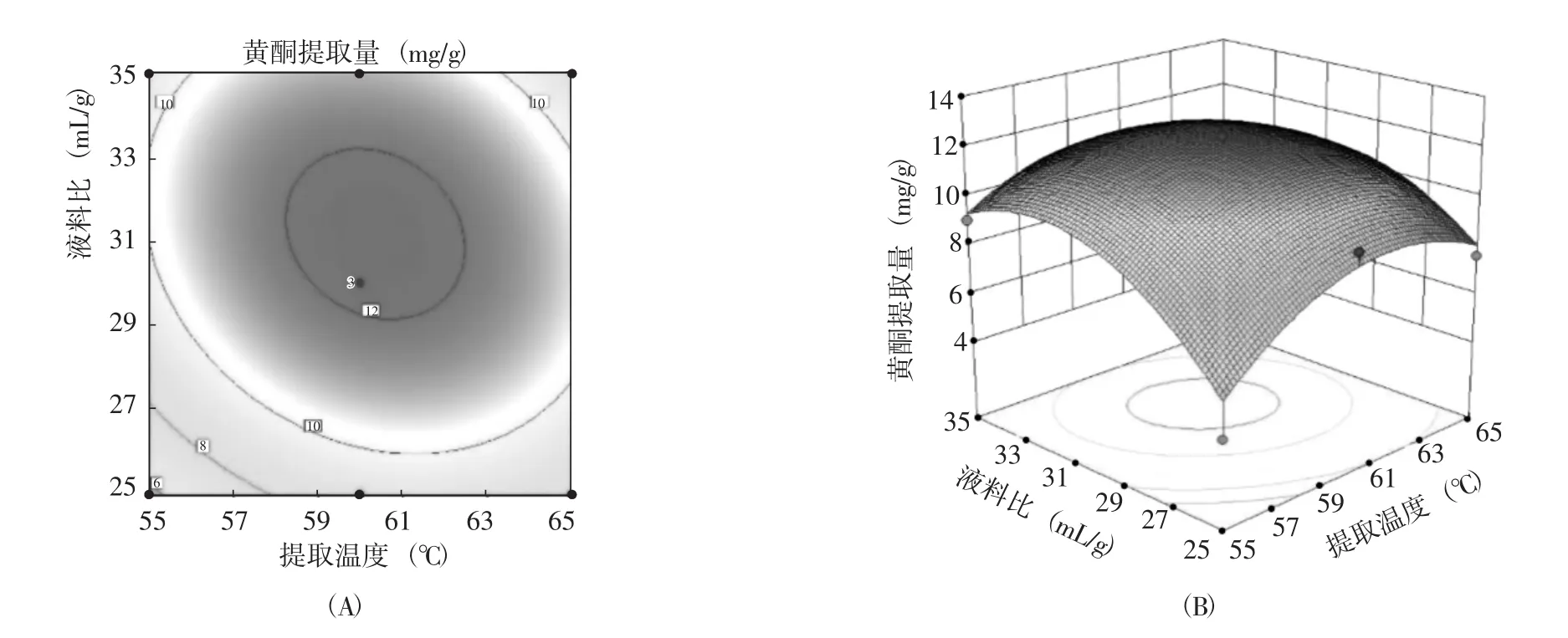
圖10 液料比與提取溫度交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.10 Interaction effect of liquid material ratio and extraction temperature on the contour and response surface diagram of extraction amount of flavonoid
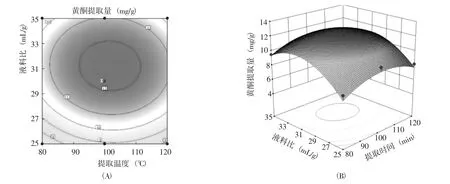
圖11 液料比與提取時間交互作用對黃酮提取量的等高線(A)和響應面圖(B)Fig.11 Interaction effect of liquid material ratio and extraction time on the contour and response surface diagram of extraction amount of flavonoid
采用Design-Expert軟件的中心組合設計方法設計響應面試驗,建立數學模型,得到了較優的提取工藝條件。并結合響應面分析得到的數學模型,預測更優的工藝條件,并進行3次驗證試驗,最后得到了從藜麥葉提取黃酮的最佳工藝條件為乙醇體積分數68%、液料比32∶1、提取時間100 min、提取溫度61℃,該條件下黃酮提取量可以達到(12.41±0.03) mg/g。預測值與實際測定值接近,說明此響應面法得到的回歸模型具有一定的可靠性。

