給衰老減速
徐寧

2007年,一次小鼠抗衰老實(shí)驗(yàn)揭開了一輪全新的抗衰老研究的序幕,此后的12年間不斷有關(guān)于抗衰老的重大科學(xué)發(fā)現(xiàn)被發(fā)表。和此前抗氧化、抗自由基、干細(xì)胞注射,甚至被廣泛看好的服用白藜蘆醇等抗衰老手段不同,今天科學(xué)家已經(jīng)找到導(dǎo)致細(xì)胞衰老的具體生化反應(yīng)。
什么是衰老呢?生物學(xué)家會(huì)告訴你,衰老的本質(zhì)其實(shí)是人體逐漸失去修復(fù)細(xì)胞的能力。以往科學(xué)家主要研究如何延長(zhǎng)壽命上限,但他們無法保證老人們能健康度過額外增加的生命,也就是無法保證額外增加的生命的質(zhì)量。可誰(shuí)也不愿意將這多出來的壽命花在醫(yī)院里茍延殘喘。晚年被慢性病折磨是很痛苦的,因此,科學(xué)家轉(zhuǎn)而開始研究如何讓人類擁有80年、甚至更長(zhǎng)時(shí)間的健康人生。
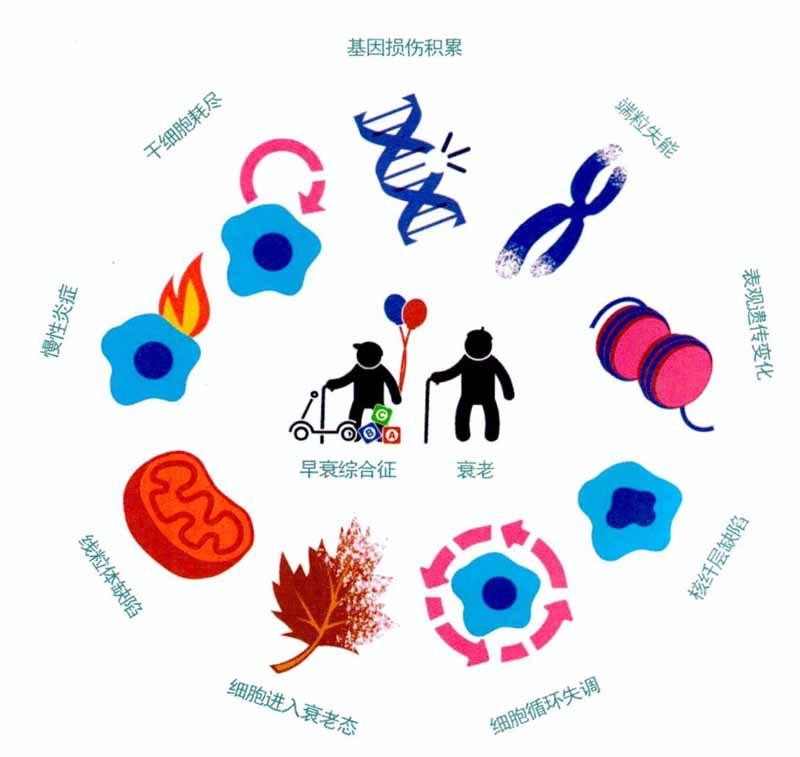
什么是細(xì)胞衰老?
人只要上了60歲,就要開始擔(dān)心心臟病和白內(nèi)障等老年病。這些疾病產(chǎn)生的原因是細(xì)胞的修復(fù)能力下降,導(dǎo)致細(xì)胞持續(xù)積累損傷。隨著年齡的增長(zhǎng),特別是進(jìn)入老年后,細(xì)胞修復(fù)基因受損和變異的能力下降,染色體開始解體,一些細(xì)胞出現(xiàn)癌變,另一些衰老細(xì)胞開始“罷工”:免疫系統(tǒng)開始變得脆弱不堪,細(xì)胞能量倉(cāng)庫(kù)——線粒體也失修破損。除了這些“罷工”細(xì)胞,人體各個(gè)器官和組織充斥著蛋白質(zhì)復(fù)合物等細(xì)胞垃圾,這些垃圾在老年人體內(nèi)造成“炎性衰老”,比如:老年人的牙周炎、膀胱炎和關(guān)節(jié)炎等總是反復(fù)發(fā)作。
現(xiàn)在我們已經(jīng)能夠確定是哪些生化反應(yīng)導(dǎo)致了衰老。當(dāng)動(dòng)物成長(zhǎng)到性成熟后,身體就會(huì)逐漸失去戰(zhàn)勝身體壓力、維持身體內(nèi)平衡的能力,這背后的原因是“細(xì)胞衰老機(jī)制”在作祟——一些受損細(xì)胞突然停止活動(dòng),等待被分解,這就是細(xì)胞衰老。老年人體內(nèi)的衰老態(tài)細(xì)胞如果不被及時(shí)清理,越積越多就會(huì)傷害器官和組織。這些處于衰老態(tài)的細(xì)胞無法被修復(fù),而且還會(huì)釋放多種促炎癥蛋白。只要人體組織中開始積累衰老態(tài)細(xì)胞,其周圍組織就會(huì)開始病變。它們能造成許多人們熟悉的老年疾病:2型糖尿病、癌癥、帕金森病、阿爾茨海默病、白內(nèi)障、骨性關(guān)節(jié)炎、動(dòng)脈粥樣硬化……
衰老態(tài)細(xì)胞的危害有多嚴(yán)重呢?科學(xué)家曾經(jīng)將衰老小鼠體內(nèi)的衰老態(tài)細(xì)胞移植到幼年小鼠體內(nèi),結(jié)果幼年小鼠出現(xiàn)了迅速衰老的跡象,并患上了一些衰老小鼠才會(huì)患的疾病。反之,如果清除衰老小鼠體內(nèi)的衰老態(tài)細(xì)胞,它們的健康狀況會(huì)得到改善,好像返老還童一樣。如果不同的老年病真的是由同一種機(jī)制引發(fā)的,那么只要攻破這一個(gè)難題,結(jié)果將是“一箭多雕”。
靶向抗衰老藥物
近年來,科學(xué)家開始專注于如何清除衰老態(tài)細(xì)胞。“靶向抗衰老藥物(Senolytics)”是指一類能夠靶向清除衰老細(xì)胞的藥物。所謂靶向,就是只作用于特定細(xì)胞的意思。科學(xué)家發(fā)現(xiàn),衰老態(tài)細(xì)胞對(duì)某些化合物的耐受性非常低,這些化合物只會(huì)引發(fā)衰老態(tài)細(xì)胞凋亡,而不會(huì)影響正常細(xì)胞。
2018年7月9日,《自然》雜志刊載了美國(guó)梅奧診所的詹姆斯·柯克蘭德教授的一篇研究文章。柯克蘭德發(fā)現(xiàn),用于治療白血病的化療藥物“達(dá)沙替尼”和水果、蔬菜、谷物中含有的黃酮類化合物“槲皮素”聯(lián)合使用能靶向清除實(shí)驗(yàn)小鼠體內(nèi)的衰老細(xì)胞。
2019年1月,柯克蘭德又對(duì)14名患有“特發(fā)性肺纖維化”的患者進(jìn)行了“達(dá)沙替尼+槲皮素”的聯(lián)合療法治療。在服用藥物三周后,其中13名患者沒有出現(xiàn)不良反應(yīng),1名病人反應(yīng)較嚴(yán)重。所有病人的步行速度得到不同程度提高,但遺憾的是患者的肺功能沒有恢復(fù)。這套“組合拳”是否真的具有抗衰老效果,還要等待長(zhǎng)期臨床試驗(yàn)結(jié)果。
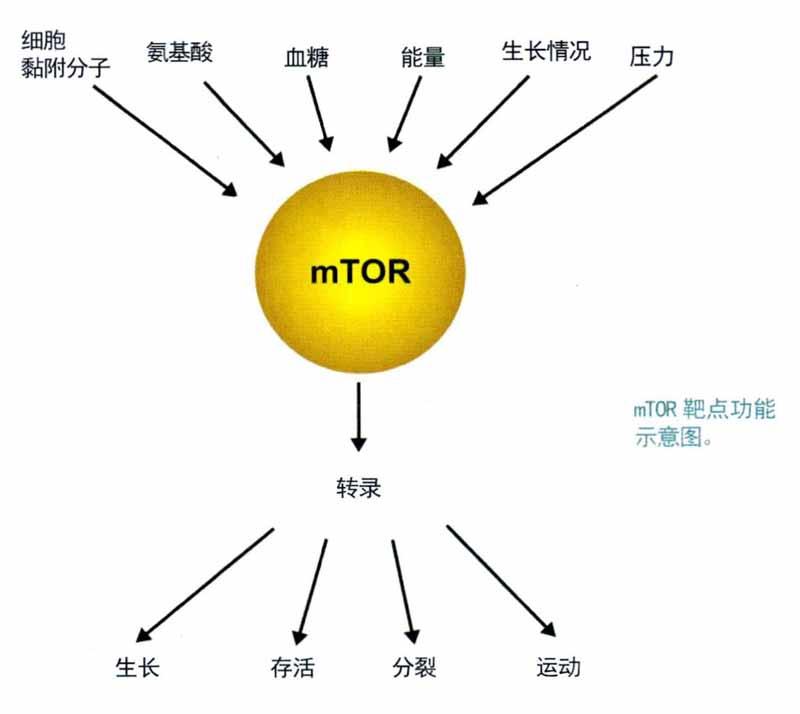
mTOR清除細(xì)胞垃圾
“限制熱量攝入”一直是熱門的抗衰老方案。科學(xué)家發(fā)現(xiàn),“限制熱量攝入”的背后機(jī)制是通過一種名為“哺乳動(dòng)物雷帕霉素靶蛋白”(簡(jiǎn)稱“mTOR”)的酶在起作用。mTOR能夠調(diào)節(jié)細(xì)胞生長(zhǎng)、分化等進(jìn)程。很久以前,科學(xué)家就猜測(cè)mTOR可能是延緩細(xì)胞衰老的關(guān)鍵靶點(diǎn)。
mTOR是控制細(xì)胞合成蛋白質(zhì)的開關(guān),能幫你適應(yīng)饑餓:當(dāng)你進(jìn)食時(shí)它被開啟,細(xì)胞就生長(zhǎng):當(dāng)你饑餓時(shí)它被關(guān)閉,細(xì)胞就開啟細(xì)胞自噬進(jìn)行維護(hù)和修復(fù)。細(xì)胞自噬通過分解、回收細(xì)胞內(nèi)無法發(fā)揮正常作用的細(xì)胞器和磷脂等分子,為細(xì)胞更新和再生提供能量和材料,還能清除組織細(xì)胞中積累的垃圾,實(shí)現(xiàn)延緩衰老、甚至逆轉(zhuǎn)衰老的效果。細(xì)胞自噬就好像細(xì)胞的垃圾處理、回收機(jī)制。通過動(dòng)物實(shí)驗(yàn),科學(xué)家發(fā)現(xiàn)隨著動(dòng)物衰老,mTOR開啟的時(shí)間間隔也越來越長(zhǎng)。
由此,科學(xué)家發(fā)現(xiàn)了多種能夠抑制小鼠體內(nèi)roTOR靶點(diǎn)的活性的藥物,雷帕霉素只是其中一種。和許多其他“靶向抗衰老藥物”一樣,作用于mTOR的靶向藥物正從動(dòng)物試驗(yàn)轉(zhuǎn)向治療人類。
mTOR恢復(fù)免疫系統(tǒng)活性
2018年,科學(xué)家公開了“mTOR逆轉(zhuǎn)免疫系統(tǒng)衰老臨床實(shí)驗(yàn)”的結(jié)果。在實(shí)驗(yàn)中,科學(xué)家將264名65歲以上的老人分成三組:一組服用BEZ235(mTOR抑制劑),一組服用依維莫司(mTOR抑制劑),剩下一組服用安慰劑。服藥期為六周,藥物劑量較低。六周后,研究人員要求所有老人接種了流感疫苗,想看看他們免疫系統(tǒng)對(duì)疫苗的反應(yīng)。結(jié)果顯示,服用低劑量mTOR抑制藥物的老年人對(duì)流感疫苗的免疫應(yīng)答效果比服用安慰劑的老年人更強(qiáng)。更加讓人欣喜的是,一年后,服用藥物的老年人呼吸道感染率也更低。這說明mTOR抑制劑對(duì)免疫系統(tǒng)的改善是長(zhǎng)期的。后續(xù)的一次規(guī)模更大的臨床試驗(yàn)再次驗(yàn)證了這兩種藥物的抗衰老效果。這兩種藥物有望在2019年底前進(jìn)入最終臨床實(shí)驗(yàn)階段。
只要BEZ235和依維莫司有一個(gè)能夠研發(fā)成功并通過審核,就會(huì)成為人類醫(yī)學(xué)發(fā)展史上的里程碑。因?yàn)檫@將是首批人類專門研發(fā)出的靶向抗衰老藥物。即便這兩種藥物的研發(fā)都失敗了,仍然還有許多其他作用于mTOR這個(gè)靶點(diǎn)的藥物正在研發(fā)之中,許多通過審核的藥物也是作用于這個(gè)靶點(diǎn)。
美國(guó)國(guó)家衰老研究院(簡(jiǎn)稱“NIA”)對(duì)許多作用于mTOR靶點(diǎn)的藥物進(jìn)行了小鼠抗衰老試驗(yàn)。在這些藥物中,NIA證實(shí)了6種藥物具有明確的抗衰老效果。同時(shí),一些曾經(jīng)被廣泛看好的抗衰老藥物,比如二甲雙胍,卻被研究人員從抗衰老藥物名單中排除。2018年以來的多項(xiàng)研究發(fā)現(xiàn),二甲雙胍可能會(huì)提高患上老年癡呆癥和帕金森病的風(fēng)險(xiǎn)。
另外,還有一些生物公司正在研發(fā)如何使胸腺細(xì)胞再生,恢復(fù)胸腺產(chǎn)生T細(xì)胞這種重要免疫細(xì)胞的能力。也有的公司專注于恢復(fù)細(xì)胞能量工廠——線粒體的活性。許多抗衰老研究都集中在IGF-1基因上。科學(xué)家發(fā)現(xiàn),讓小鼠體內(nèi)的該基因沉默后,小鼠體內(nèi)由氧化造成的細(xì)胞和器官損傷就減少了,小鼠似乎就不易患癌癥和其他老年疾病。一些公司研發(fā)中的“靶向抗衰老藥物”并不殺死衰老態(tài)細(xì)胞,而是誘導(dǎo)它們重新分裂。有趣的是,他們使用的成分竟是曾經(jīng)被宣告無法抗衰老的白藜蘆醇。現(xiàn)在一些科學(xué)家正在研究如何能讓白細(xì)胞返老還童,恢復(fù)白細(xì)胞清除衰老態(tài)細(xì)胞的能力。在所有被證實(shí)具有抗衰老作用的藥物中,大多數(shù)是通過抑制mTOR通路發(fā)揮作用,但也有一些的作用機(jī)制還不明確,這說明還有其他的底層抗衰老機(jī)制有待發(fā)現(xiàn)。
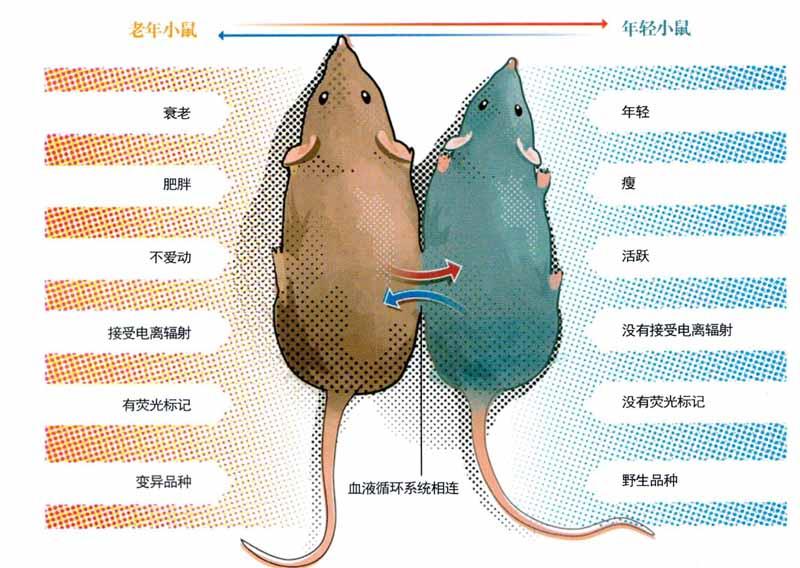
血液中蘊(yùn)含令人年輕的秘密?
2007年,斯坦福大學(xué)干細(xì)胞生物學(xué)家托馬斯·蘭道發(fā)現(xiàn),衰老小鼠的肌肉可以通過輸入年輕小鼠的血液而年輕化。幾年后,哈佛大學(xué)的艾米·維杰斯成功重現(xiàn)了實(shí)驗(yàn),得到了同樣的實(shí)驗(yàn)結(jié)果。而其他后續(xù)研究表明,輸入年輕小鼠血液的老年小鼠的胰腺、肝臟和心臟也可以觀察到類似的年輕化效果。
最振奮人心的消息是這種方法對(duì)大腦也有效果。斯坦福大學(xué)神經(jīng)生物學(xué)家托尼·維斯科瑞的團(tuán)隊(duì)將老年小鼠和年輕小鼠的循環(huán)系統(tǒng)相連,讓它們共享血液,這種實(shí)驗(yàn)?zāi)P捅环Q為“連體共生”。衰老小鼠接觸到年輕小鼠血液后,大腦中產(chǎn)生了新的神經(jīng)元,突觸活動(dòng)也增加了。小鼠大腦和人類一樣具有血腦屏障,照理說年輕小鼠的血細(xì)胞是無法進(jìn)入衰老小鼠大腦內(nèi)的。于是,維斯科瑞推測(cè),一定是能夠溶解于血漿的某些小分子在起作用。
血液中不僅有細(xì)胞,還有能在細(xì)胞之間、組織之間傳遞信息的信使分子——激素和類激素分子。維斯科瑞做過—個(gè)實(shí)驗(yàn),他的團(tuán)隊(duì)收集了近300個(gè)年齡為20~89歲的健康人血液樣本,并測(cè)量其中超過100種信使分子的水平。拿到分析結(jié)果后,研究人員首先注意到,在最年輕者和最年長(zhǎng)者的血液樣本中,半數(shù)信使分子水平有明顯不同。帕金森病和阿爾茨海默病等神經(jīng)退行性疾病都和腦細(xì)胞衰老有關(guān),延緩大腦衰老也有助于防止老年人脫離社交活動(dòng)。
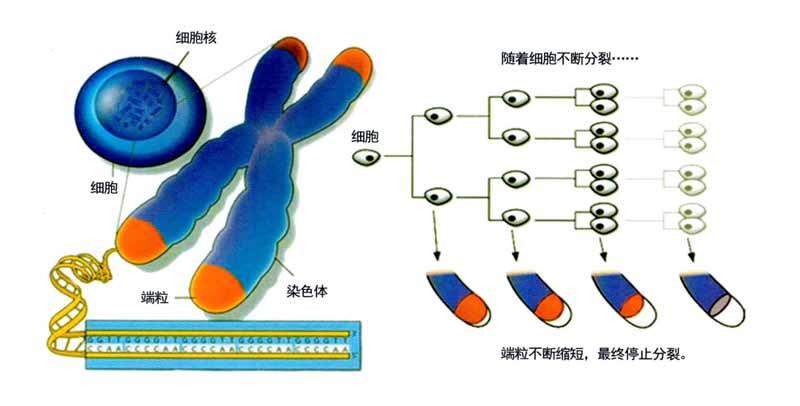
修復(fù)端粒能否延緩衰老?
人類體細(xì)胞的分裂次數(shù)是有限的。20世紀(jì)60年代,一位名叫李?yuàn)W納多·海佛烈克的科學(xué)家在研究人體胚胎細(xì)胞時(shí),發(fā)現(xiàn)其中一些體細(xì)胞會(huì)在某個(gè)時(shí)候突然停止分裂,并開始死亡。海佛烈克發(fā)現(xiàn)人體體細(xì)胞都在分裂50次后,也就是9個(gè)月后停止分裂。即便低溫停止了體細(xì)胞分裂,一旦溫度再次上升,體細(xì)胞依然會(huì)繼續(xù)冰凍前的分裂行為,直到分裂50次后停止分裂。海佛烈克意識(shí)到人類體細(xì)胞有一種深層內(nèi)在機(jī)制控制細(xì)胞分裂次數(shù)。
細(xì)胞分裂次數(shù)的極限也被稱為海佛烈克極限。老鼠壽命一般在2~3年,它們體細(xì)胞的海佛烈克極限為14~28次。壽命在150歲以上的加拉帕戈斯象龜體細(xì)胞的海佛烈克極限約為125次。但海佛烈克極限會(huì)隨著人類衰老而下降,有研究發(fā)現(xiàn),80歲以上的老人細(xì)胞分裂極限下降到20次。
是什么決定了人體細(xì)胞的海佛烈克極限呢?答案是染色體末端的端粒。如果細(xì)胞無法完整復(fù)制端粒,細(xì)胞就會(huì)停止分裂。這樣看來,我們只要注射用于合成端粒的端粒酶,不就能實(shí)現(xiàn)長(zhǎng)壽夢(mèng)想了么?有些癌細(xì)胞能產(chǎn)生獨(dú)立的端粒酶,用以合成端粒。這樣一來,它們就可以無限復(fù)制。因?yàn)閾?dān)心細(xì)胞可能會(huì)像癌細(xì)胞一樣失控并無限分裂,所以注射端粒酶并不是延長(zhǎng)壽命的明智選擇。
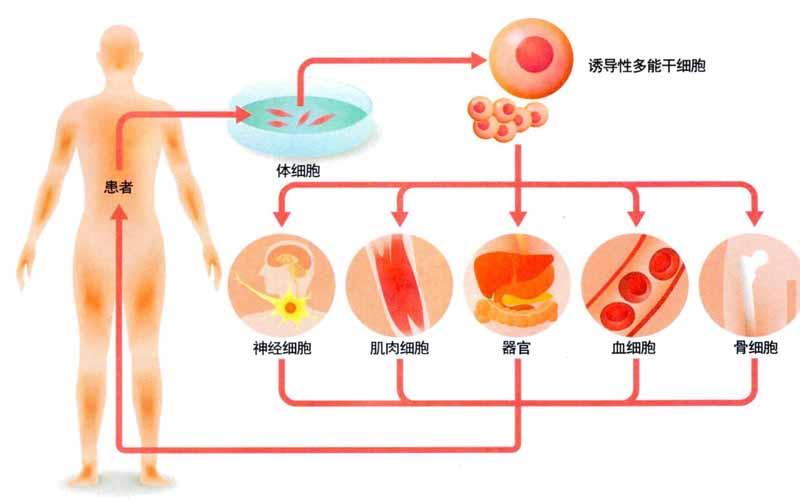
干細(xì)胞抗衰老效果如何?
骨折的嬰兒只需要1個(gè)月左右就能恢復(fù),成年人則需要2~3個(gè)月。差異背后是干細(xì)胞發(fā)揮了主要作用。干細(xì)胞是一類具有高度分化能力的體細(xì)胞,它們是我們身體重要的“修理工”。當(dāng)人超過25歲后,身體中的干細(xì)胞開始逐漸休眠。
如果注入其他人的干細(xì)胞,可能會(huì)引起排異反應(yīng)。你也可以從自己脂肪組織中提取一些干細(xì)胞,注射到面部。這樣做的確能讓你的臉更有彈性。而且,由于是你自己的干細(xì)胞,所以不會(huì)有排異反應(yīng)。不過,這種做法基本上是拆東墻補(bǔ)西墻,并不能延緩整體衰老速度。
如果你的父母為你保存了嬰兒時(shí)期的臍血干細(xì)胞,那就不一樣了。這部分干細(xì)胞是一支“援軍”,可以補(bǔ)充你體內(nèi)的干細(xì)胞數(shù)量。如果沒有保存臍血也不要失望。2006年,日本科學(xué)家山中伸彌發(fā)現(xiàn)體細(xì)胞可以被改造成“誘導(dǎo)性多能干細(xì)胞”(簡(jiǎn)稱“iPS”),iPS擁有接近胚胎干細(xì)胞的分化能力。通過將體細(xì)胞誘導(dǎo)成iPS修復(fù)甚至培養(yǎng)器官,2型糖尿病、骨性關(guān)節(jié)炎、慢性腎臟病等老年高發(fā)病的治療有望進(jìn)入一個(gè)嶄新時(shí)代。
現(xiàn)在抗衰老藥物領(lǐng)域的形勢(shì)看似充滿生機(jī),但冷靜的科學(xué)家們知道前面的路還很長(zhǎng)。一方面,雖然目前抗衰老這棵學(xué)術(shù)大樹上開出了許多花朵,但很可能只有極少數(shù)能結(jié)果,也就是被證實(shí)安全、有效。另一方面,科學(xué)家擔(dān)心一些藥品公司沒有耐心等待為期數(shù)年的臨床試驗(yàn)階段,過早推出抗衰老藥品,這又會(huì)導(dǎo)致一系列醫(yī)療安全問題。盡管科學(xué)家已經(jīng)發(fā)現(xiàn)mTOR抑制劑療法的優(yōu)越性,但我們還不清楚它的副作用和危害,貿(mào)然服用這類藥物是很危險(xiǎn)的。
大約每5000種試驗(yàn)室新藥中,只有1種能夠最終被推向市場(chǎng)。動(dòng)物和人類的差異性是其中原因之一。在所有對(duì)小鼠有效的藥物中,90%無法通過人類藥物試驗(yàn)。即便是被證實(shí)對(duì)人類有效,也要經(jīng)過一期、二期和三期臨床試驗(yàn)。普通藥物走向市場(chǎng)如此艱難,抗衰老藥物從實(shí)驗(yàn)室到市場(chǎng)的道路也一樣漫長(zhǎng)。
(責(zé)任編輯王川)


