MAPREC與MNVT評價III型Sabin株脊髓灰質炎病毒神經毒力的比較
李娜,丁玲,馬萌,孫千一,王紅燕,李拓
論著
MAPREC與MNVT評價III型Sabin株脊髓灰質炎病毒神經毒力的比較
李娜,丁玲,馬萌,孫千一,王紅燕,李拓
用 PCR 擴增及限制性酶切分析突變技術(MAPREC)和猴體神經毒力試驗(MNVT)評價同一批 III 型 Sabin 株脊灰病毒神經毒力的結果差異。
采用 MAPREC 技術,檢測 III 型 Sabin 株脊灰病毒神經毒力關鍵位點 472 位點突變率;采用 MNVT 病理切片分析,評價 III 型 Sabin 株脊灰病毒神經毒力。
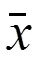
在III 型 Sabin 株脊灰病毒神經毒力檢測方面,操作簡單,試驗周期短的MAPREC 技術可作為金標準 MNVT 的有益補充。
神經毒力; III 型 Sabin 株脊髓灰質炎病毒; 分子水平; 動物水平
Sabin 株脊髓灰質炎病毒(脊灰病毒)由于其安全性高、免疫效果好的優勢,被世界衛生組織(WHO)推薦在發展中國家用于生產脊灰病毒疫苗。目前市面上使用 Sabin 株生產的脊灰病毒疫苗包括口服 Sabin 脊髓灰質炎減毒活疫苗(oral poliovirus vaccine,OPV)和 Sabin 脊灰病毒滅活疫苗(sabin inactivated poliovirus vaccine,sIPV)。自 Sabin 株脊灰疫苗使用以來,脊髓灰質炎病例自 1988 年以來已減少了 99% 以上,從 35 萬多例的估計數減少到 2017 年的 22 例報告病例,為全球消除脊灰病毒做出了巨大貢獻。如今,世界上只有巴基斯坦、阿富汗和尼日利亞三個國家沒有消滅脊髓灰質炎的傳播,偶有病例報告。Sabin 株脊髓灰質炎病毒是由野毒株 Salk 株經連續低溫傳代得到,Sabin 株 OPV 遺傳物質比較穩定,但接種 OPV 仍會出現極低概率的疫苗相關的麻痹性脊髓灰質炎(vaccine associated paralytic poliomyelitis,VAPP)及疫苗衍生脊髓灰質炎病毒(vaccine derived poliovirus,VDPV)現象[1]。主要原因是 Sabin 株毒株在傳代時候發生了基因突變,導致神經毒力恢復。因此在疫苗生產中,檢測 Sabin 株脊灰病毒神經毒力是必要的[2]。目前神經毒力檢測方法主要包括以下幾個方法:①猴體神經毒力試驗(monkeys neurovirulence test,MNVT),該方法是 Sabin 株脊灰病毒神經毒力檢測的金標準,2015 版《中國藥典》要求每批 OPV 疫苗需通過 MNVT 檢測;② Tg PVR21 轉基因小鼠神經毒力試驗方法,該方法轉基因小鼠表達脊灰病毒受體,使小鼠對脊灰病毒易感,從而評價神經毒力,該方法涉及專利問題,不被允許大規模應用[3];③ PCR 擴增及限制性酶切分析突變技術(mutant analysis by PCR and restriction enzyme cleavage,MAPREC),檢測重要毒力位點突變率,該方法基于分子生物學方法,操作簡單,要求較低;④深度測序技術,大規模平行測序,監控所有基因位點改變。本研究利用 MAPREC 從分子水平和 MNVT 從動物水平共同檢測一批 III 型 Sabin 株脊灰病毒神經毒力,對比檢測結果是否保持一致。
1 材料與方法
1.1 材料
1.1.1 標準品及樣品 MAPREC 實驗用標準品均購自英國國家生物制品檢定所(national institute for biological standards and control,NIBSC),具體信息如表 1 所示。猴體神經毒力實驗標準品為:脊髓灰質炎減毒活疫苗參考品,購自 NIBSC,批號 III-1981。試驗樣品為III 型 Sabin 株脊灰病毒,批號:III201101,來自北京生物制品研究所有限責任公司。

表 1 MAPREC 標準品信息
1.1.2 主要儀器及試劑 CF16RN 離心機為日本日立公司產品;Azure Sapphire 多功能分子成像系統為美國 Azure 公司產品;Hoefer-SE600-Ruby 垂直電泳儀為美國通用電氣公司產品;T-100 基因擴增儀為美國伯樂公司產品;EG1150 C 冰臺、EG1150 H 包埋機、HI 1220 烘片機、RM2245 切片機均為德國徠卡公司產品。限制性內切酶I(1501804)、I(10007459)購自 New England Biolabs 公司;病毒 RNA 提取試劑盒(R6423)購自天根生物科技有限公司;SuperScriptTMIV First-Strand Synthesis System(00599722)、AmpliTaq Gold 360 Master Mix(1710071)均購自美國賽默飛公司;沒食子藍(MKBT6206V)、加拿大樹膠(20150324)、正丁醇(20141114)、乙醚(20180201)、無水乙醇(20170902)、丙酮(20170210)、二甲苯(20170601)均購自國藥集團化學試劑有限公司。
1.1.3 引物探針序列 引物 pA-3/484 序列:5' CAGGCTGGCTGCTGGGTTGCAGCTGCCTGC 3',工作濃度均為 3 μg/ml。pS-3/470 序列:5' TGAGCTACATGAGAGTGCTCCGGCCCCTGAATGCGGCTGA 3',工作濃度均為 30 μg/ml。引物與 CY5 標記的 pA-3/484 探針(CY5-pA-3/484)均由生工生物(上海)科技有限公司合成。
1.1.4 實驗動物 實驗用恒河猴購自北京協爾鑫生物資源研究所有限責任公司,許可證號:SCXK(京)2015-0011。北京所實驗動物許可證號:SYXK(京)2016-0051。恒河猴為抗脊灰病毒抗體陰性、體重> 1.5 kg、檢疫合格的一級實驗用猴,未作其他實驗,2018087-2018108 號免疫參考品,2018109-2018130 號免疫樣品。
1.2 方法
1.2.1 MAPREC 檢測 III 型 Sabin 脊灰病毒 472-C 突變率
1.2.1.1 RNA 提取與反轉錄制備 cDNA 按照病毒 RNA 提取試劑盒說明書,提取待測樣品與標準品 LMVR、HMVR 的病毒基因組 RNA,隨后立刻按 SuperScriptTMIV First-Strand Synthesis System 說明書進行體外反轉錄,得到 3 種 cDNA。
1.2.1.2 非對稱 PCR 最佳模板濃度篩選[4]按以下比例配置非對稱 PCR 反應 Mix:2 × PCR Master Mix 25 μl,pA-3/484 和 pS-3/470 各 5 μl,H2O 10 μl,總體積 45 μl。
每個 cDNA 組有 7 管,除 1 號管加入56.25 μl 非對稱 PCR Mix 外,2 ~ 7 號管中各加50 μl 非對稱 PCR Mix。分別取 6.25 μl cDNA 加到對應的 1 號管中,混勻后取 12.5 μl 移到 2 號管,依次重復,直至 7 號管混勻后棄去 12.5 μl 液體。
另取 5 管為對照,每管加 45 μl 非對稱 PCR 反應 Mix,分別加入 0.01 μg/ml 100% DNA,2 支 0.01 μg/ml IS DNA,分別命名為 IS DNA-A 和 IS DNA-B,無菌水、反轉錄對照各 5 μl。
按照以下條件進行 PCR 反應:95 ℃ 10 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,運行 40 個循環,72 ℃ 7 min。取 10 μl 擴增產物,加入 PCR Master Mix 和 6 μg/ml 的標記探針 CY5-pA-3/484 各 1 μl,混勻離心后 72 ℃反應 10 min,進行 PCR 產物的熒光標記。取 4 μl 標記產物加入 1 μl 30% 甘油,進行 10% 聚丙烯酰胺凝膠電泳。Azure Sapphire 設備里 CY-5 模式下掃描、成像、分析。
1.2.1.3 突變率檢測 選擇目的條帶明顯,且引物剩余少的最高稀釋管的 PCR 產物用于酶切和
定量分析。取 6 μl 標記混合物,加入終濃度分別為 2 U/μl 的 Mbo I 酶切工作體系 1 μl,37 ℃孵育 2 h,電泳后在 Azure Sapphire 設備里 CY-5 模式下掃描、成像、分析,共進行 5 次重復實驗,對結果進行分析。
1.2.2 猴體神經毒力實驗[5-6]
1.2.2.1 樣品稀釋 供試品滴度調至 105.5~ 106.5半數細胞培養感染量(50% cell culture infective dose,CCID50)/0.1 ml。
1.2.2.2 猴體免疫 將已麻醉的猴子各 14 只分別免疫,在第一腰椎處,將針頭在正中略斜處刺入,免疫 0.1 ml 樣品及參考品,在籠上標記猴號,觀察 17 ~ 22 d。北生研根據《北京市實驗動物福利倫理審查指南》、《北京實驗動物管理條例》制定了《實驗動物福利倫理及動物實驗安全審查 SOP》,實驗中所涉及的實驗動物均嚴格遵守該 SOP,充分考慮動物的利益,善待動物,防止或減少動物的應激、痛苦和傷害,尊重動物生命,制止針對動物的野蠻行為、采取痛苦最少的方法處置動物。實驗方法和目的符合道德倫理標準和國際慣例。
1.2.2.3 組織切片染色計分 觀察期末將動物處死后,石蠟包埋大腦和脊髓不同部位并切片(厚度 9 ~ 15 μm),經沒食子藍染色后,鏡下檢查。根據病毒活性計分標準對每只猴腰髓切片,以猴腦及脊髓中線為界,左右分別計分,并判斷是否是有效猴(每只猴 29 塊組織切片中任意 1 切片評分≥ 2,則視為有效猴),評分標準[5]:沒有損傷為 0 分;僅有細胞浸潤為 1 分;細胞浸潤伴有少量的神經元損害,為 2 分;細胞浸潤伴有廣泛的神經元損害,為 3 分;大量的神經元損害,伴有或無細胞浸潤,為 4 分。再對其他部位切片左右分別計分,統計出腰、頸、腦部的各自平均分,統計單只猴的病變平均分。
1.3 統計學處理
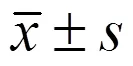
2 結果
2.1 最佳 PCR 模板濃度篩選
對于逆轉錄的 cDNA 進行 5 倍梯度稀釋,作為非對稱 PCR 的模板,待測樣品最佳 PCR 模板濃度篩選電泳結果如圖 1 所示,54倍稀釋度為最高稀釋度且不產生引物二聚體的稀釋濃度,待測樣品 cDNA 模板 54倍稀釋下的 PCR 產物作為我們下一步定量分析的目標。HMVR 和 LMVR 的最佳 PCR 模板濃度篩選電泳圖與圖 1 一致。HMVR 為 57倍稀釋,LMVR 為 56倍稀釋。
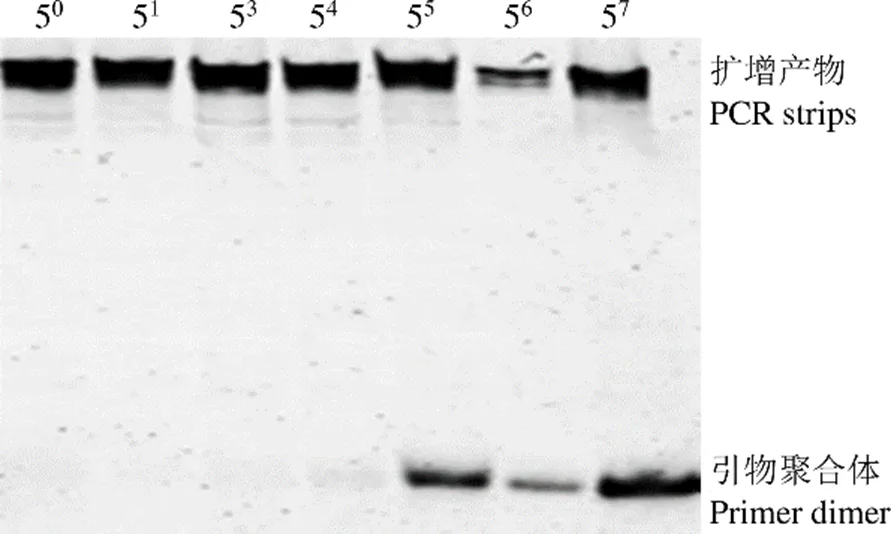
圖 1 PCR 模板篩選電泳圖
Figure 1 Electropherogram for PCR template screening
2.2 定量突變率檢測
利用篩選出的最佳 PCR 模板的產物進行熒光標記、酶切、電泳、掃描成像后對酶切條帶的灰度值進行分析,根據各個條帶的灰度值計算各個樣品的突變率,電泳結果掃描如圖 2 所示。5 次重復酶切突變率如表 2 所示,IS DNA-A 與 IS DNA-B 的比值為 1.004,結果接近 1。IS DNA-A與 IS DNA-B 的測定值波動小,檢測值在 ± 3之間。LMVR 的檢測突變率低于同步檢測的 IS DNA 的檢測突變率。HMVR 的檢測突變率高于同步檢測的 IS DNA 的檢測突變率,樣品合格。
2.3 猴體神經毒力實驗切片分析
由同一人采用計分法在顯微鏡下觀察并在鏡檢結果記錄表中記錄結果,并評分,圖 3 為試驗中神經元病變圖。圖 3A 為針跡反應;圖 3B 為正常神經元,評為 0 分;圖 3C 僅有細胞浸潤,評為 1 分;圖 3D 細胞浸潤伴有少量的神經元損害,評為 2 分;圖 3E 細胞浸潤伴有廣泛的神經元損害,評為 3 分。
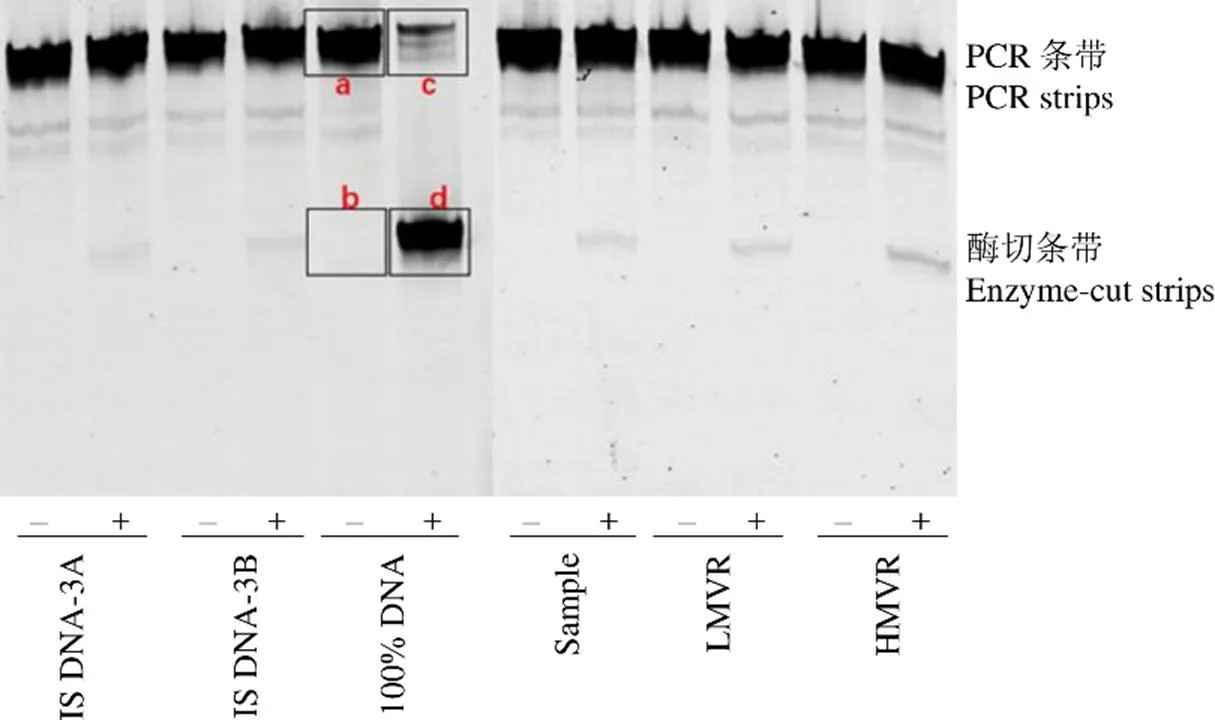
圖 2 定量檢測電泳圖(突變率 = d/(c + d) – b/(a + b),“–”表示非酶切,“+”表示酶切)
Figure 2 Electropherogram for quantitative detection of mutation rate (Mutant rate = d/(c + d) – b/(a + b), “–” represent non-digested DNA, “+” represent digested DNA)
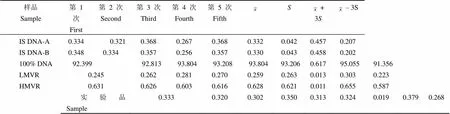
表 2 5 次定量檢測結果分析(%)
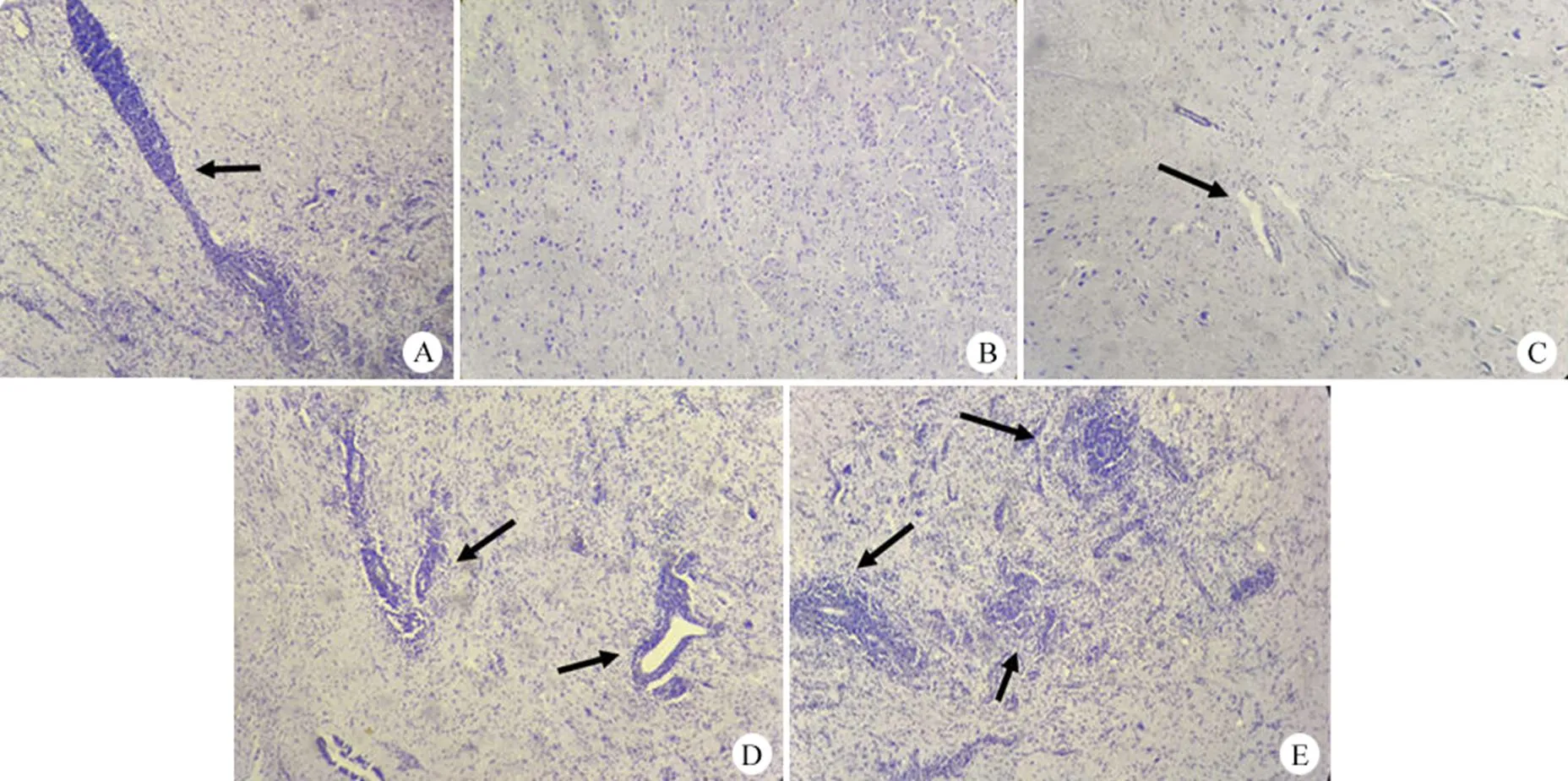
圖 3 猴體神經病變切片圖(40 ×)
Figure 3 Picture for monkey nerve tissue lesion slice (40 ×)
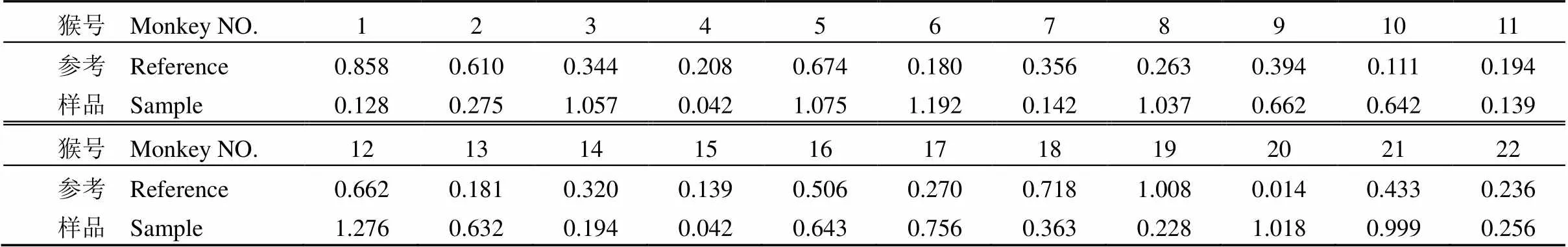
表 3 每只猴的 Ls 值
2.4 猴體神經毒力實驗數據分析
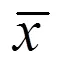
3 討論
Sabin 株脊灰病毒疫苗由于其成本低廉和免疫效果好的原因被發展中國家大量生產使用。2015 版《中國藥典》OPV 成品及 sIPV 毒種需要經過 MNVT 檢測,證明其神經毒力在可控范圍。MNVT 實驗作為脊灰病毒神經毒力驗證的金標準,是疫苗生產廠商目前檢測其疫苗安全性最可靠的方法。但是 MNVT 耗時周期長達一個月,在日常工作中會拖慢工作進度。MAPREC 實驗從分子水平檢測某個具體關鍵位點的突變率反映整體疫苗的安全程度,具有實驗操作簡單,實驗周期短等特點,MAPREC 實驗將實驗樣品與標準品同時檢測,能客觀反映待測樣品相對于標準品的突變程度。在目前階段,疫苗生產單位可以輔助使用MAPREC 技術用于 Sabin 株脊灰病毒的突變率的監測,作為風險監控的指標,快速指導生產工作的安排。在本文中,我們使用 MAPREC 技術和 MNVT 同時對一批 III 型 Sabin 株脊灰病毒神經毒力進行檢測。試驗表明,兩種不同的技術,得到的結果是一致的。但目前對于 Sabin 減毒株關鍵毒力位點的研究還不是十分明確,因此目前 MAPREC 實驗仍不能取代 MNVT。隨著分子生物技術的發展,對 Sabin 株脊灰病毒回復突變的研究的深入,Sabin 株脊灰病毒回復突變原理逐漸清晰,控制神經毒力的關鍵位點被明確找到后,一個替代MNVT 的分子生物學技術有望得到應用。
[1] Li HZ, Sun MB, Yang JS. Research progress of sequential immunization schedule for poliomyelitis vaccine. Chin J Vaccine Immun, 2016, 22(3):327-332. (in Chinese)
李洪哲, 孫明波, 楊凈思. 脊髓灰質炎疫苗序貫免疫程序的研究與應用進展. 中國疫苗和免疫, 2016, 22(3):327-332.
[2] Luo HM, Yu WZ, Wen N, et al. Application of poliomyelitis vaccine and recommendation on switch of immunization strategies in China. Chin J Vaccines Immun, 2014, 20(2):172-176. (in Chinese)
羅會明, 余文周, 溫寧, 等. 中國脊髓灰質炎疫苗使用歷史回顧及免疫策略調整建議. 中國疫苗和免疫, 2014, 20(2):172-176.
[3] Ohka S, Igarashi H, Nagata N, et al. Establishment of a poliovirus oral Infection system in human poliovirus receptor-expressing transgenic mice that are deficient in alpha/beta interferon receptor. J Virol, 2007, 81(15):7902-7912.
[4] World Health Organization. Standard operating procedure mutant analysis by pcr and restriction enzyme cleavage (maprec) for oral poliovirus (sabin) vaccine types 1, 2 or 3. Version 5. 2012 [2019-02- 26]. https://www.who.int/biologicals/vaccines/MAPREC_SOP_Final_ 09112012.pdf?ua=1.
[5] Qu Z, Yang YW, Lv JJ, et al. Establishment of a histopathology evaluation method of in vivo neurovirulence test in monkeys. Chin J New Drugs, 2014, 23(18):2117-2122. (in Chinese)
屈哲, 楊艷偉, 呂建軍, 等. 猴體神經毒力實驗組織病理學評價方法的建立. 中國新藥雜志, 2014, 23(18):2117-2122.
[6] Xie ZP, Chen HB, Shen D, et al. Analysis of pathological lesion caused by neurovirulence test of oral poliovirus vaccine in monkeys. Chin J Biol, 2007, 20(3):206-208, 218. (in Chinese)
謝忠平, 陳瀚博, 沈冬, 等. 口服脊髓灰質炎減毒活疫苗猴體神經毒力試驗病理結果分析. 中國生物制品學雜志, 2007, 20(3):206- 208, 218.
Evaluation of the neurovirulence of type III Sabin strain poliovirus through MAPREC and MNVT
LI Na, DING Ling, MA Meng, SUN Qian-yi, WANG Hong-yan, LI Tuo
To study the difference between the neurovirulence of the same type III Sabin strain poliovirus examined by MAPREC and MNVT.
The MARPEC assay was used to detect the point mutation rate of the 472 site, which are the key sites of the virulence of the type III Sabin strain poliovirus. The paraffin sections of the MNVT was analyzed to evaluate the neurovirulence of the type III Sabin strain poliovirus.
In the detection of virulence of poliovirus type III Sabin strain, the simple operation and short test period of MAPREC can be used as a beneficial supplement to the gold standard MNVT.
Neurovirulence; Type III Sabin strain poliovirus; Molecular level; Animal level
LI Tuo, Email: little0815@qq.com
Author Affiliation: Department of Quality Control (LI Na, DING Ling, MA Meng, SUN Qian-yi, LI Tuo), Department of Vaccine Facility 4 (WANG Hong-yan), Beijing Bio-Institute Biological Products Co., Ltd., Beijing 100176, China
10.3969/j.issn.1673-713X.2019.06.003
“重大新藥創制”國家科技重大專項(2018ZX09737008)
100176 北京生物制品研究所有限責任公司質量檢定室(李娜、丁玲、馬萌、孫千一、李拓),疫苗 4 室(王紅燕)
李拓,Email:little0815@qq.com
2019-08-02

