CRISPR靶向切割毒力因子tcdB基因抑制致病艱難梭菌生長
張大煒,夏 云,趙靳鑫,陳盈竹,鄒家齊,嚴 佳,楊 蜜
(重慶醫科大學附屬第一醫院檢驗科實驗室,重慶 400016)
艱難梭菌是一種革蘭陽性厭氧芽孢桿菌[1],是醫院感染性腹瀉的主要病原菌,主要引起自限性腹瀉到中度腹瀉、偽膜性腸炎。重癥患者會出現中毒性巨腸炎、腸穿孔、感染性休克等并發癥,甚至最終導致死亡[2-3]。隨著大量使用廣譜抗菌藥物、質子泵抑制劑,艱難梭菌感染的發病率、復發率和病死率越來越高,艱難梭菌感染已成為世界范圍內一個廣受關注的新型公共衛生問題[4]。甲硝唑、萬古霉素、非達霉素是2018年美國感染病學會推薦治療艱難梭菌感染的主要藥物[5],前兩者都不是特異性地針對艱難梭菌,這種非特異性的殺菌往往導致腸道相關菌群的改變,造成艱難梭菌致病核糖體型的選擇優勢。臨床常出現常規抗菌藥物治療效果不可預測、復發率較高的情況,并且目前已發現對甲硝唑和萬古霉素均耐藥的菌株[6]。非達霉素作為治療艱難梭菌感染的窄譜新藥,尚未有明確的臨床療效評估,且在不遠的將來有再度耐藥的可能。近年來有用滅活毒素制備艱難梭菌疫苗的報道[7-9],由于尚處于臨床試驗階段,療效尚未可知。艱難梭菌最主要的致病因子是其產生的毒素。有研究報道稱,tcdB是造成產毒艱難梭菌毒力的主要原因[10]。CRISPR/Cas9技術由于其高效的基因編輯能力而被廣泛應用于基因工程領域。目前CRISPR-Cas系統多應用于真核細胞基因編輯領域,而應用于原核生物特別是作為抗微生物藥物的研究尚不多見。有研究證明CRISPR/Cas9可以序列特異性的方式殺滅肺炎鏈球菌[11],且細菌基因組內的任何序列都可以作為基于CRISPR抗微生物藥物的靶標[12]。
本文旨在建立靶向抑制tcdB基因的CRISPR/Cas9系統,運用穿膜肽將sgRNA和Cas9導入菌體內,在體外特異性切割艱難梭菌主要毒力因子tcdB基因,以特異性抑制致病菌株的生長。為開發一種新的治療方法,降低臨床抗菌藥物非特異性的殺菌導致的腸道相關菌群失調的影響,提供思路。
1 材料與方法
1.1菌株和引物 艱難梭菌標準菌株ATCC43255,為本實驗室保存;根據 GenBank 數 據 庫 中 提 供 的 艱難梭菌 tcdB基因全長序列(Gene ID:491407 4)以引物設計軟件premier5.0 設計全長基因擴增引物,序列分別為上游引物:5′-ACT GTA GTA GAA TCA GCA ATA AAT GAT ACA C-3′; 下游引物:5′-TCC TCT CTC TGA ACT TCT TGC TAA TGA AG-3′,擴增產物長度為1 299 bp。引物由生工生物工程(上海)股份有限公司合成。在線設計sgRNA序列為:ATG AAC AAG AGT TGG TAG AAA GG。由于適當延長可以增強穩定性和剪切效果,利于轉化,上游延申后形成CTT ATA TGA ACA AGA GTT GGT AGA AAG G,作為靶向tcdB的sgRNA序列。用于與Cas9綴合的穿膜肽(CPP)序列為:4-馬來酰亞胺基-GGG RRR RRR RRR LLL L(m9R),用于與sgRNA連接的CPP序列為:CGG GRR RRR RRR RLL LLC(9R)。
1.2細菌培養 艱難梭菌培養:厭氧液體培養基(北京路橋技術有限責任公司),布魯菌血瓊脂(重慶龐通醫療器械有限公司),37 ℃厭氧袋培養;其他腸道菌培養:LB 培養基(Bioflux),哥倫比亞血平板(賽默飛世爾生物化學制品有限公司),37 ℃培養。
1.3儀器與試劑 Cas9和sgRNA(百奧邁科生物技術有限公司)濃度均為0.2 μg/μL、反應液(南京金斯瑞生物科技有限公司)、DL 2 000 DNA 標志物(Takara)、細菌DNA提取試劑盒(廣州欣研生物科技有限公司)、DNA產物純化試劑盒(北京索萊寶科技有限公司)、PCR 擴增儀(重慶道益醫療器械有限公司)、GelDocTMXR凝膠成像系統(美國BIO-RAD)、氣浴恒溫振蕩器(江蘇金壇市岸頭國瑞實驗儀器廠)、恒溫培養箱(Heal Force)、電泳儀(北京君意東方電泳設備有限公司)、冷凍離心機(德國艾本德公司)。
1.4CRISPR體外切割靶基因
1.4.1tcdB基因的擴增 擴增體系為20 μL:ddH2O 7.2 μL,上游引物 0.4 μL,下游引物 0.4 μL,模板2 μL,Taq酶10 μL;擴增步驟為95 ℃10 min 預變性;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃10 min延伸。擴增引物序列如1.1 所示,擴增產物用DNA產物純化試劑盒提純,瓊脂糖凝膠電泳證實目標基因擴增成功。
1.4.2CRISPR系統對tcdB的切割 (1)根據擴增產物濃度,設置反應混合物(擴增產物40 nmol/L×2.5 μL,sgRNA 0.2 μg/μL×2 μL,Cas9 0.2 μg/μL×2 μL,反應液 4 μL,用焦碳酸二乙酯處理過并經高溫高壓滅菌的純水(DEPC-H2O)9.5 μL。(2)將sgRNA與反應液預混 90 ℃孵育10 min,并緩慢冷卻至室溫使sgRNA退火。(3)在未加DNA的反應混合物中加入和sgRNA等摩爾量的Cas9蛋白,室溫下孵育30~60 min。(4)將靶DNA添加到反應混合物中,并立即在37 ℃下孵育1~2 h,開始切割反應。(5)取出10 μL樣品,加入1 μL蛋白酶K,37 ℃孵育30 min,以消化與DNA結合的Cas9。(6)配置1%瓊脂糖凝膠電泳,于1孔加入2 000 bp的 DNA 標志物,2、3、4孔加入1.4.1的擴增產物,并分別于2、3孔加入sgRNA和Cas9,5孔加入1.4.2處理后的切割產物。220 V 30 min瓊脂糖凝膠電泳,凝膠成像系統顯像。將1.4.2處理后的切割產物進行基因測序,以驗證是否在預期位點切割成功。
1.5CPP-sgRNA、CPP-Cas9的制備
1.5.1CPP-Cas9的制備 (1)在pH7.4的緩沖液(PBS)中純化Cas9蛋白(1 mg)、m9R肽(50 μg),用于綴合。(2)將m9R逐滴加入Cas9蛋白質中進行綴合,不斷輕拍管子以保證均勻混合。(3)使反應在振動器上室溫下持續2 h。(4)過量游離或未結合的m9R肽是通過在pH7.4的PBS中4 °C,24 h透析除去。透析過程中更換2~3次緩沖液(PBS)。(5)對于透析,使用相對分子質量50×103的截留膜來確保透析袋中僅保留Cas9-m9R蛋白(168 ×103),而游離m9R(2×103)被除去。(6)從透析膜收集Cas9-m9R蛋白,使用考馬斯亮藍法(Bradford法)測定蛋白質濃度檢測。
1.5.2CPP-sgRNA的制備 將sgRNA和9R肽以1∶3的摩爾量混合,室溫下孵育30 min,形成sgRNA:9R復合物。
1.6CRISPR對產毒艱難梭菌生長的抑制作用 配置0.5麥氏濃度菌液,取6支無菌試管編號,每管加入1 800 μL厭氧肉湯,200 μL菌液。管1作為空白對照,管2~6分別加入CPP-sgRNA、CPP-Cas9、CPP、CPP-sgRNA+CPP-Cas9、sgRNA+CPP-Cas9。6支試管震蕩混勻,37 ℃厭氧培養,分別于0、6、12、18、24 h接種布魯菌血瓊脂平板菌落計數,并測菌液A值。
1.7特異性驗證 用同樣的方法將CRISPR系統(CPP-sgRNA+CPP-Cas9)分別作用于不產毒艱難梭菌、大腸埃希菌、銅綠假單胞菌、肺炎克雷伯菌、金黃色葡萄球菌、陰溝腸桿菌、鮑曼不動桿菌等細菌,觀察細菌的生長情況。
2 結 果
2.1tcdB基因擴增產物的切割 瓊脂糖凝膠電泳及測序結果均顯示,加入sgRNA和Cas9后,靶基因在預期位點被成功切割開;單獨加入sgRNA或Cas9后,靶基因未被切割開。
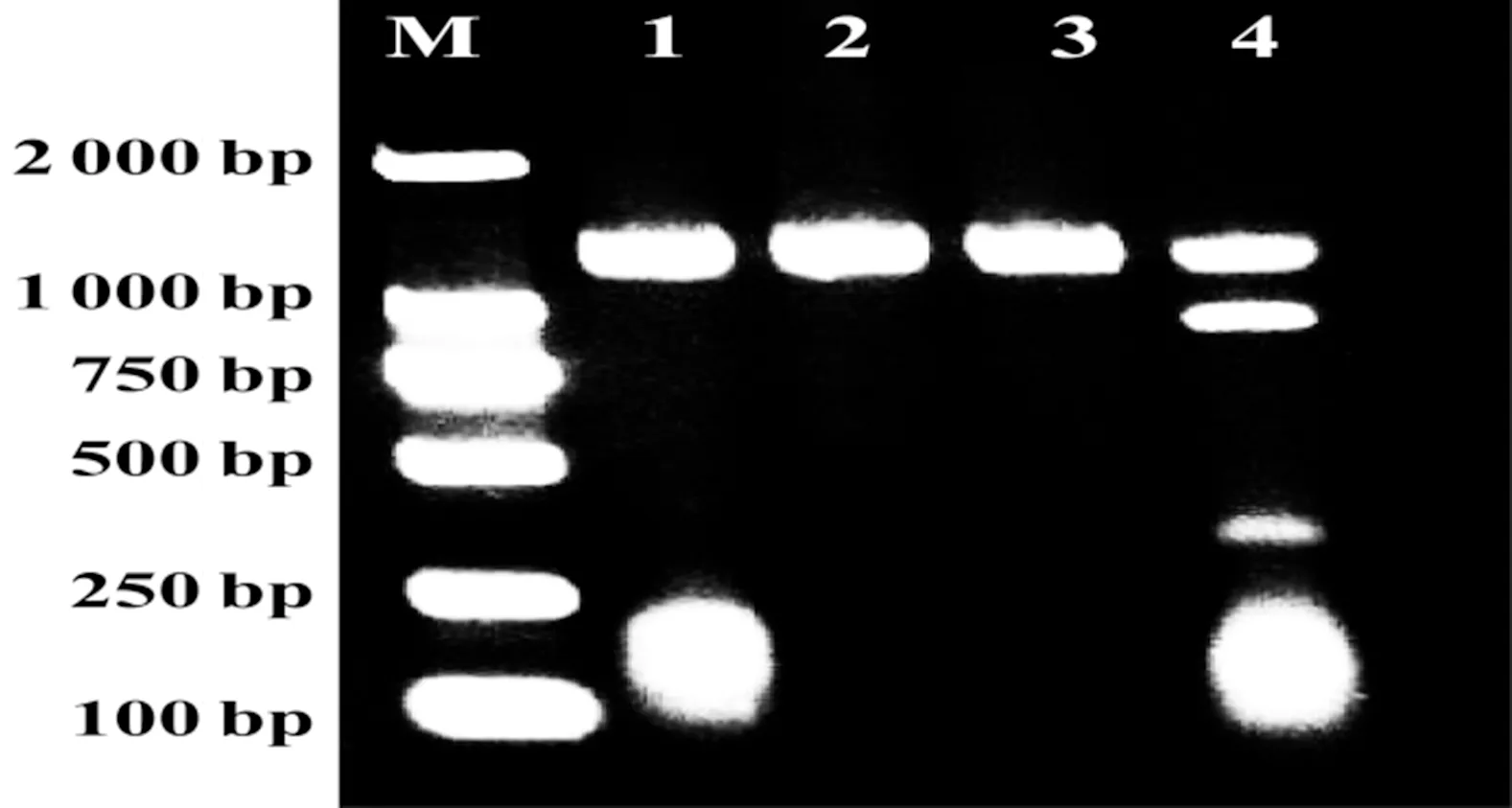
注:M為標志物、1為sgRNA、2為Cas9、3為空白對照、4為sgRNA+Cas9
圖1CRISPR系統切割tcdB基因擴增產物
2.2CRISPR對細菌生長的抑制作用 根據測定A值及菌落計數結果繪制經CRISPR不同成分處理產毒艱難梭菌的生長曲線,與空白對照比較,加入CPP-sgRNA+CPP-Cas9 顯著抑制產毒艱難梭菌生長,加入sgRNA+CPP-Cas9對產毒艱難梭菌生長有輕度抑制作用。而單獨加入CPP-sgRNA、CPP-Cas9或CPP對產毒艱難梭菌生長無影響。同時將CRISPR(CPP-sgRNA + CPP-Cas9)作用于不產毒艱難梭菌,根據測定A值及菌落計數的對數繪制細菌的生長曲線。發現CRISPR只對產毒艱難梭菌有作用,對不產毒菌株無作用,表明本研究設計的CRISPR系統只對含有tcdB基因的產毒株有切割效果。同樣的方法用其他細菌做效果驗證實驗,見圖 2、3,A值及菌落計數均和空白對照無差別。
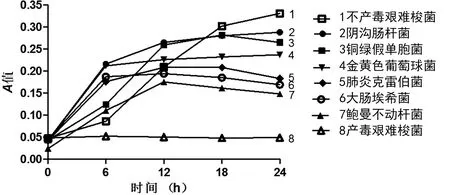
圖2 CRISPR系統對不同細菌生長的吸光度的影響
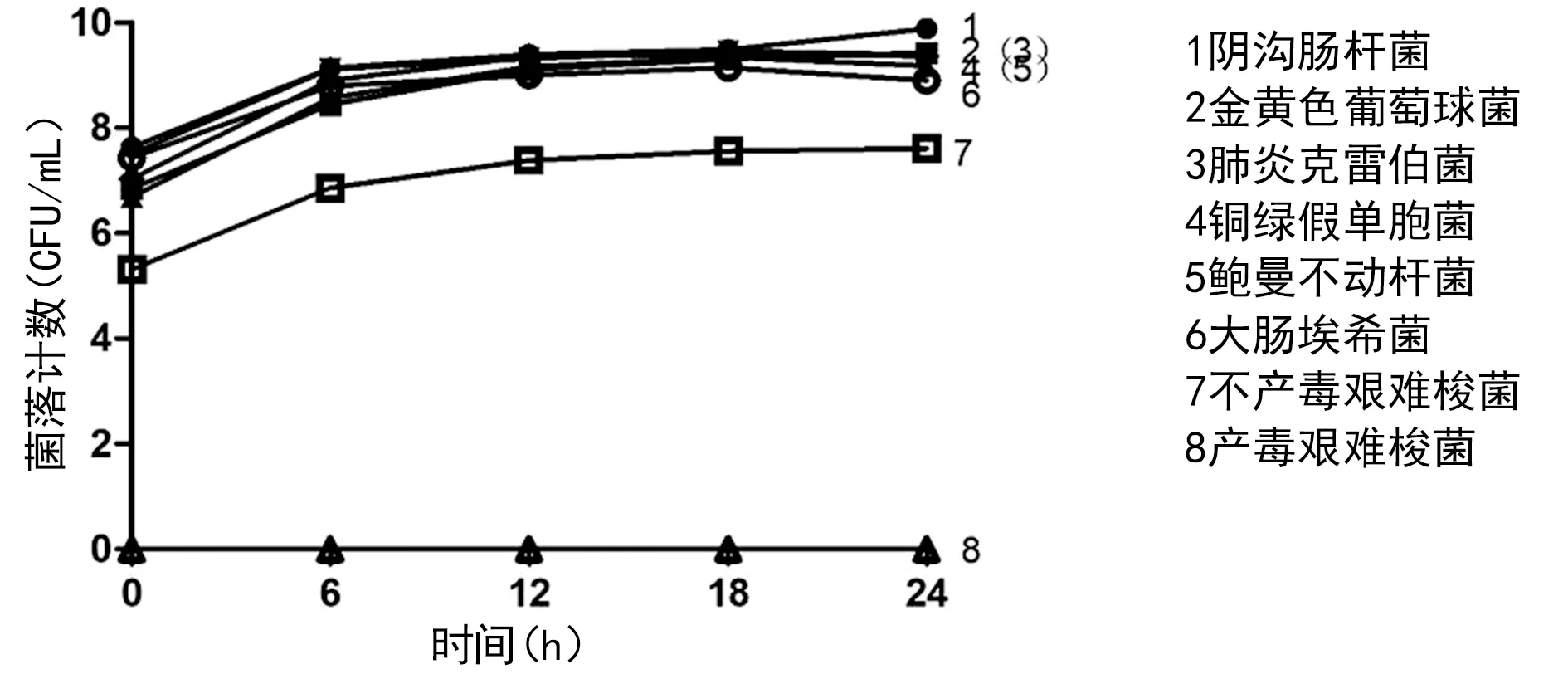
注:縱坐標菌落計數取Log10的對數
圖3CRISPR系統對不同細菌生長的菌落計數的影響
3 討 論
CRISPR/Cas9技術作為一種新型的基因編輯技術逐步被用于對病原微生物的研究中。CITORIK等[13]運用CRISPR技術使 blaNDM-1 和 blaSHV-18兩種耐藥基因的表達下降了100~1 000倍,這種高效的基因抑制作用可有效地阻止耐藥突變株出現,因此CRISPR-Cas系統作為全新的抗菌藥物制劑頗具開發潛力。這也使得運用CRISPR技術靶向切割毒力因子tcdB基因,抑制致病艱難梭菌生長成為可能。
本研究中,CRISPR/Cas9在體外直接切割靶基因:由圖1結果可知單獨添加sgRNA或Cas9對靶基因無切割效果;只有將sgRNA和Cas9共同作用,才能將靶基因在預期的靶點成功切割開來,證實了本研究設計的sgRNA在體外切割測試中取得了成功。
用CPP-sgRNA與CPP-Cas9共同作用,無細菌生長;單獨sgRNA與CPP-Cas9共同作用,對細菌生長影響輕微。表明單獨的sgRNA遞送能力差,CPP可以提高sgRNA的遞送效率,進而加強對細菌生長的抑制作用。sgRNA與CPP的預混能更好地將sgRNA遞送到菌體內,其原因可能是sgRNA和細胞膜本身都帶負電荷,不易導入;當將CPP和sgRNA混合時能形成縮合的帶正電的納米顆粒,有助于將sgRNA遞送到細胞中[14]。單獨加CPP-sgRNA、CPP-Cas9或CPP的菌落計數和A值與和空白對照管相差無異,表明CRISPR作用的發揮需要sgRNA和Cas9二者共同作用。另外單獨的CPP對細菌也無作用,這與ABUSHAHBA等[15]所持觀點一致。
CRISPR/Cas9載體的有效遞送是實現高效靶基因表達抑制的關鍵,應用CRISPR系統消除tcdB基因的表達的關鍵就是如何將sgRNA和Cas9有效地遞送至目標細菌體內。目前尚缺乏適宜的運載工具。將表達sgRNA和Cas9的質粒采用轉染劑或電轉的方式轉染進入目標細胞的方式轉染效率不高。獲得較高轉染效率的做法是采用噬菌粒為載體[16-17]。但因其難于純化、宿主范圍窄、要求細菌必須表達適宜的表面噬菌體受體等因素,實際轉染效率并不高[18]。而且目前還發現艱難梭菌細胞壁蛋白CwpV具有抵抗噬菌體的作用[19],因此采用噬菌粒作為質粒遞送工具對于艱難梭菌并不可行。
另一種比較有潛力的是使用CPP與重組Cas9蛋白和sgRNA結合后可以直接遞送到哺乳動物細胞內[20]。CPP以其穿膜效率高、細胞毒性低、可以攜帶各種生物活性分子等優點因而在細胞轉染方面得到廣泛應用[21-22]。目前常用的針對革蘭陽性菌的穿膜肽有(KFF)3K、GRKKKRRQRRRYK、(RXR)4XB,據報道,GRKKKRRQRRRYK、(RXR)4XB的穿膜效果最好[15]。有研究采用(KFF)3K、(RXR)4XB作為CPP攜帶靶向gyrA和ftsZ基因的肽核酸成功抑制多重耐藥的鮑曼不動桿菌和耐甲氧西林金黃色葡萄球菌的生長[23-24]。目前使用穿膜肽遞送CRISPR的應用鮮見報道。
本研究首次運用穿膜肽來遞送CRISPR系統。本研究中使用CPP遞送sgRNA和Cas9蛋白,與將同時表達sgRNA和Cas9蛋白的質粒轉染細胞相比,避免了通過質粒介導遞送到細胞中導致的質粒序列不可控制地整合到宿主基因組中,以及附加的免疫反應和由細菌序列引起的潛在的安全問題。CPP介導的RGEN傳遞系統,無需質粒和額外的轉染試劑,并且減少了脫靶效應[14]。本研究使用以穿膜肽為載體的CRISPR/Cas9系統,成功實現對艱難梭菌tcdB毒素基因的切割,抑制了艱難梭菌的生長。其原因可能與細菌缺少非同源末端連接的修復途徑,運用CRISPR后引起的DNA雙鏈斷裂缺口容易引起細胞死亡有關[25]。經其他細菌的特異性驗證,本研究中設計合成的CRISPR/Cas9系統對產毒艱難梭菌顯示了高度的特異性。
本研究構建的針對艱難梭菌毒素基因tcdB的CRISPR/Cas9系統,通過穿膜肽轉染的方法,明確了CRISPR-Cas9能夠高效特異切割艱難梭菌tcdB毒素基因,為CRISPR/Cas9系統應用于產毒艱難梭菌的精準特異治療奠定了基礎,同時成功構建了利用穿膜肽遞送CRISPR/Cas9的新型遞送系統,為臨床治療耐藥菌感染提供了新的思路。由于該系統只對產毒艱難梭菌有作用,對不產毒艱難梭菌、大腸埃希菌、銅綠假單胞菌、肺炎克雷伯菌、金黃色葡萄球菌、陰溝腸桿菌、鮑曼不動桿菌等細菌無作用,有利于保護腸道正常菌群,顯示了其良好的應用前景。同時本研究尚存在不足之處,比如由于未做小鼠模型驗證,本研究所建立的體系能否應用于體內環境及可能存在的問題和缺陷,尚有待于進一步探究。
4 結 論
本研究設計的CRISPR系統可靶向切割tcdB毒素基因,抑制致病艱難梭菌生長,且具有高度特異性,有利于保護腸道正常菌群,為解決臨床抗菌藥物非特異性殺菌導致腸道菌群失調的問題及耐藥菌感染的治療提供了新的思路。

