PD-L1 表達對術后接受氟尿嘧啶用藥方案為基礎輔助化療的結直腸癌患者預后影響
張德志 劉猛 朱少功 梅家轉 季節
結直腸癌(Colorectal cancer,CRC)是全球常見的惡性腫瘤之一[1]。美國2000~2003年發病率增加22%[2],上個世紀我國仍屬于結直腸癌發病率較低的國家,但隨著社會經濟的發展、人民生活水平的提高和飲食結構的改變,近年我國結直腸癌發病率逐年上升,且發病年齡也呈年輕化的趨勢[3]。結直腸癌的預防和治療仍面臨很大的挑戰[4]。目前,手術和化療是結直腸癌治療的主要手段,IDEA研究表明低危的Ⅲ期結直腸癌患者使用3個月的卡培他濱聯合奧沙利鉑輔助化療方案可明顯獲益[5]。相關研究也已證實氟尿嘧啶為主的輔助化療方案可顯著降低結直腸癌患者的術后復發風險[6]。然而,尚有很多影響該方案療效的因素需要進一步探索。
近年腫瘤的免疫治療已成為該領域的熱點話題之一,程序性死亡因子1(programmed cell death 1,PD-1)及其配體程序性死亡蛋白配體1(programmed death-ligand 1,PD-L1,也稱為B7-H1或 CD274)具有抑制免疫細胞的功能,兩者廣泛表達于活化的T細胞、B細胞、NK細胞、單核細胞及樹突狀細胞[7]。多種PD-1抑制劑,如派姆單抗、尼沃單抗正在被評估是否可以為消化道腫瘤患者帶來臨床獲益。PD-L1作為近年來研究最熱門的基因,成為目前免疫治療藥物重要的生物標志物之一[8]。PD-1和PD-L1的結合可導致腫瘤微環境中T細胞衰竭及發生免疫逃逸,促進腫瘤細胞生長[9]。
目前研究發現PD-L1在多種腫瘤細胞中呈現高表達[10]。且有研究表明,相對于癌旁正常組織,PD-L1在結直腸癌中高表達,而且相較于高分化狀態和分期較早的腫瘤細胞,低分化和分期較晚的腫瘤細胞PD-L1表達水平顯著增高,提示PD-L1的表達可能與結直腸癌進展和預后有關[11]。隨著免疫治療藥物在我國上市,免疫治療的療效逐漸被公認。此外,PD-L1的表達目前已經明確基本可以作為免疫治療藥物的療效預測因子。然而,PD-L1表達和術后接受氟尿嘧啶用藥方案為基礎輔助化療的結直腸癌患者的預后關系尚不清楚。因此,本研究旨在探討PD-L1表達對接受氟尿嘧啶用藥方案為基礎輔助化療的結直腸癌患者預后的影響,為結直腸癌的早期診斷、免疫治療及預后評估奠定基礎。
1 材料與方法
1.1 一般資料本研究回顧性分析2012年1月~2018年12月在我院普外科接受手術切除治療的結直腸癌患者。本研究入組患者年齡18~80歲,中位年齡49歲。男48例(53.93%),女41例(46.07%)。ECOG評分中0分患者69例(77.53%)。結腸癌和直腸癌分別45例和44例。腫瘤分化方面,分化較好、分化中等、分化較差患者分別為10例、69例和8例。腫瘤分期方面,其中Ⅱ期患者25例,Ⅲ期患者64例。接受氟尿嘧啶為基礎輔助化療患者27例,接受卡培他濱為基礎輔助化療患者62例。見表1。2015年以前患者以接受5-氟尿嘧啶為基礎的輔助化療,術后3~4周,第1天靜脈滴注奧沙利鉑85mg/m2超過2h,靜脈滴注亞葉酸鈣400mg/m2超過2h,靜脈推注氟尿嘧啶400mg/m2,然后每天1 200mg/m2,共計兩天持續靜脈滴注,每2周為1個周期。2015年以后患者以接受卡培他濱為基礎的輔助化療,術后3~4周,口服卡培他濱,1000mg/m2,第1~14天2次/d,每21天為1個周期。奧沙利鉑,80~130mg/m2,靜脈滴注,第1天。輔助化療結合患者情況給予6~8個周期治療。本研究最后一次隨訪時間為2018年6月,所有患者從納入研究到最后一次隨訪的中位隨訪時間為5.45年(0.60~7.50 年)。
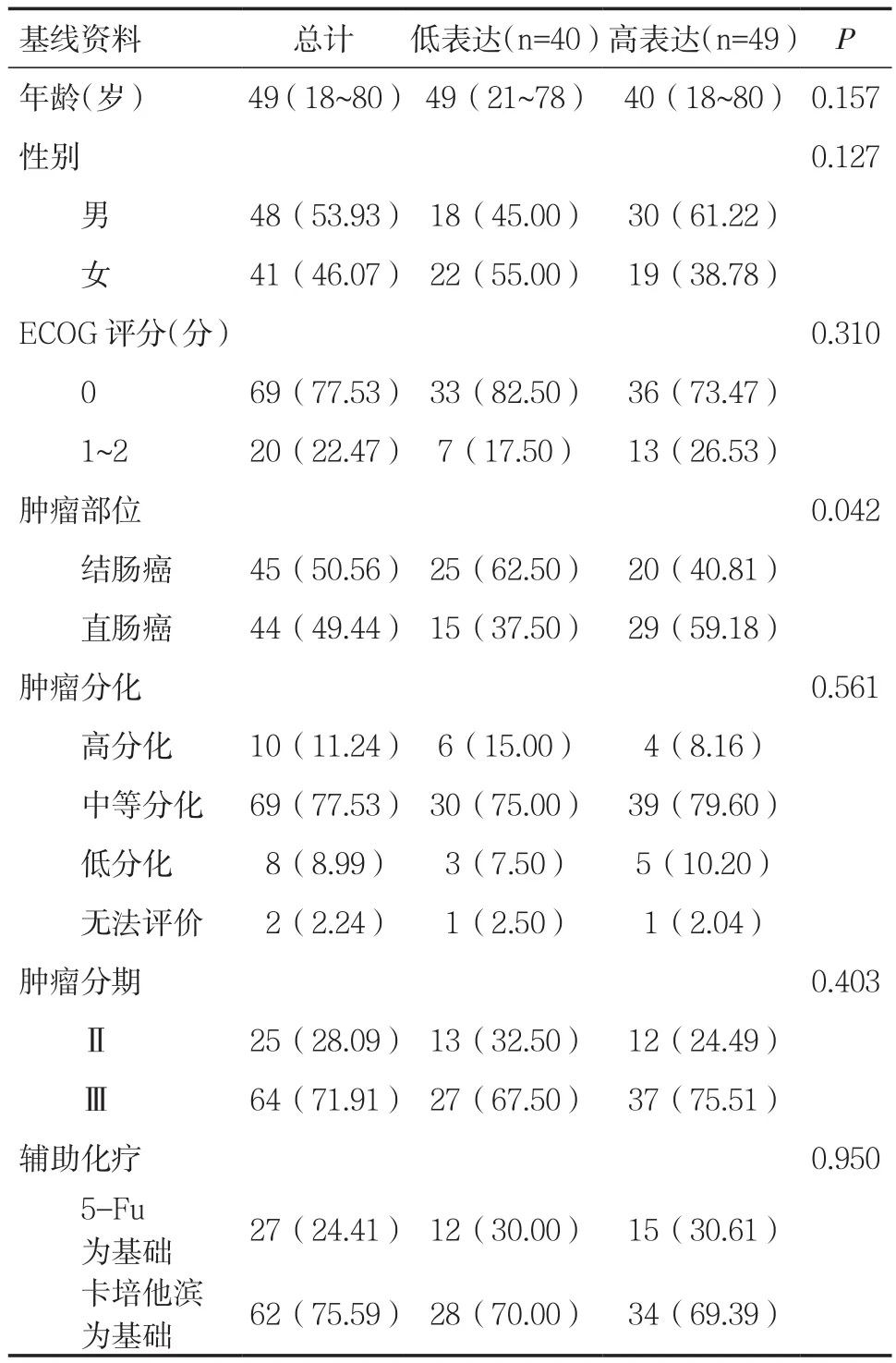
表1 腫瘤組織中PD-L1的表達情況[n(%)]
入選標準:①年齡18~80歲,ECOG評分0~2分者;②既往未接受過系統性治療者;③主要器官功能在治療前7天內符合標準者;④經病理確診為結直腸癌患者;⑤預期生存期至少3個月者。排除標準:①未接受氟尿嘧啶為基礎輔助化療的患者;②遺傳性結直腸癌綜合征患者。本研究得到我院倫理委員會的批準。在治療過程中依據NCI毒性分級進行相應的劑量調整,若出現Ⅳ級腎損害、神經毒性、心臟毒性、肝毒性等危及生命的不良反應,立即終止治療。
1.2 免疫組織化學(ICH)法采用免疫組織化學SP法進行檢測,按照SP試劑盒說明書進行操作,其中抗PD-L1(1∶100)4℃孵育過夜。鼠抗人PD-L1抗體購自美國Abcam公司;免疫組化SP-9000試劑盒購自北京中杉金橋生物科技有限公司。PD-L1的表達采用二級計分法,染色強度按顏色由淺入深依次為:0分(陰性),1分(弱陽性),2分(中度陽性),3分(強陽性);按陽性細胞占計數腫瘤細胞的百分比評分:1分(0~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。兩者計分相乘,低表達組為0~4分,高表達組為6~12分[12]。
1.3 統計學方法采用SPSS 19.0進行統計分析,繪制Kaplan-Meier曲線比較PD-L1低表達組和高表達組OS的差異。計數資料采用率(%)表示,組間比較采用χ2檢驗,P<0.05為差異有統計學意義。總生存期(OS)的計算為從開始做手術的時間到患者因為各種原因出現死亡的日期或最后一次隨訪結束的日期。采用Cox風險比例模型對OS構建多因素分析,P<0.05為差異有統計學意義。
2 結果
影響OS的風險因素如年齡、性別、ECOG評分、病理分期以及PD-L1表達納入該模型。Cox模型當中具有統計學差異的變量為ECOG評分(OR=2.85,P=0.006)、腫瘤分期(OR=3.11,P<0.001)和PD-L1表達(OR=1.77,P=0.010),見表2。
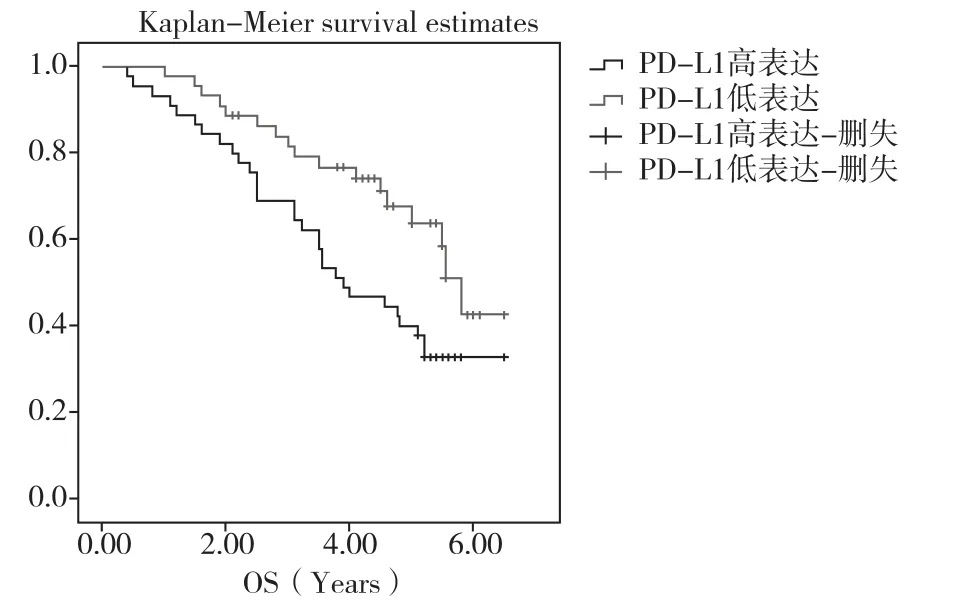
圖1 不同PD-L1表達水平的總生存期曲線對比

表2 對OS構建校正其他變量的多變量Cox風險比例模型
3 討論
2.1 PD-L1在結直腸癌患者中的表達情況結直腸癌組織中PD-L1的表達較正常組織明顯上調。
2.2 PD-L1表達對接受氟尿嘧啶為基礎輔助化療的結直腸癌患者預后的影響在總生存期(OS)方面,PD-L1高表達組和低表達組的中位總生存期(mOS)分別為3.90年和5.80年,具有顯著的統計學差異(P=0.032),見圖1。為了進一步校正其他混雜因素的影響,本研究構建了Cox風險比例模型,將可能
本研究共納入89例術后接受氟尿嘧啶用藥方案為基礎輔助化療的結直腸癌患者,研究發現結直腸癌組織中PD-L1的表達較正常組織明顯上調,PD-L1低表達組的生存時間高于PD-L1高表達組,提示PD-L1高表達的結直腸癌患者傾向于較差的預后。Cox風險比例模型也證實了PD-L1是影響臨床預后的獨立預測因素。研究結果與李海青等[12]對PD-L1在結直腸癌的表達及預后研究分析結果具有一致性。結合以上內容可推斷PD-L1可能參與了腫瘤細胞的免疫逃逸過程,促進了腫瘤細胞的侵襲和遷移,在一定程度上解釋了PD-L1高表達會影響結直腸癌患者的預后。
多項研究表明PD-L1在結直腸癌中呈現高表達,但一項納入454例CRC受試者的研究報道了只有12%的患者表達了PD-L1[13],可能與腫瘤細胞的分化狀態有關。有學者對具有微衛星不穩定性和突變狀態的結直腸癌進行PD-L1免疫組織化學檢測,并將PD-L1的表達與臨床預后相關聯,研究結果表明PD-L1陽性不能作為生存率預測的指標,微衛星不穩定性較高的患者與較低的生存率有相關性,研究結果解釋了PD-1或PD-L1抑制劑對微衛星不穩定性結直腸癌患者的作用機制,并提出PD-L1可能會作為結直腸癌患者的潛在預測及預后指標之一[14]。以上研究提示了PD-L1的表達與結直腸癌患者的預后關系尚不清楚。本研究探索了術后接受氟尿嘧啶用藥方案為基礎輔助化療的結直腸癌患者PD-L1表達與預后的關系,但缺少了進一步深入探討PD-L1在結直腸癌患者中的表達與微衛星不穩定性之間的關系,在后期研究中可做深入探索。
本研究結果表明腫瘤發病部位可能與PD-L1的表達具有相關性,與李甜甜[15]研究結果一致,結腸和直腸由于胚胎生長來源的不同周圍淋巴結數目也不同,結腸淋巴結數目要多于直腸,因此PD-L1表達在不同發病部位具有差異性。Cox風險比例模型中影響總生存OS的因素除了PD-L1表達外,還有ECOG評分和腫瘤分期,通常ECOG評分越高,患者預后越差,Ⅲ期患者的OS生存時間要低于Ⅱ期患者。本研究中27例患者氟尿嘧啶用藥方案以5-氟尿嘧啶為主,62例患者氟尿嘧啶用藥方案以卡培他濱為主,有報道5-氟尿嘧啶與卡培他濱兩種給藥方式存在差異,兩者療效無差異[16]。有報道在晚期結直腸癌研究中,奧沙利鉑聯合氟尿嘧啶類藥物時,患者可選擇使用5-氟尿嘧啶或卡培他濱或替吉奧膠囊[17]。
綜上所述,術后接受氟尿嘧啶為基礎輔助化療的結直腸癌患者腫瘤細胞中PD-L1的表達明顯高于正常組織,PD-L1高表達患者生存時間短,并提示PD-L1可能會成為術后接受氟尿嘧啶為基礎輔助化療的結直腸癌患者預后的重要預測指標之一。此項研究屬于回顧性研究,觀察的樣本量有限,檢測方法單一,存在一定的局限性,但本研究為后續關于PD-L1的表達對術后接受氟尿嘧啶為基礎輔助化療的結直腸癌患者預后影響的相關研究提供了一定的參考價值。

