基于宏基因組技術分析自然發(fā)酵高粱菌群結構
葛云飛,趙舒婷,劉德志,王維浩,2,曹龍奎,2,*
(1.黑龍江八一農墾大學食品學院,黑龍江大慶163319;2.黑龍江八一農墾大學國家雜糧工程技術研究中心,黑龍江大慶163319)
高粱又名蜀黍,因其高產性、高抗逆性及其在發(fā)酵、制糖、飼料行業(yè)中用途廣泛而被大量種植,其種植面積及產量僅次于小麥、玉米、水稻和大麥,成為世界上第五大糧食作物[1],是一種富含膳食纖維,蛋白質,脂肪,葉酸,鐵和其他微量元素的天然高營養(yǎng)功能性食品。高粱具有涼血、解毒之功,常吃高粱粥和高粱米飯,可治積食、消化不良等癥,可用于防治多種疾病[2]。在西方國家通常將高粱進行發(fā)酵生產“高粱粥”、“高粱發(fā)酵飲料”[3]及“高粱斷奶粥”等產品[4],而在國內由于高粱的適口性較差,膳食纖維的含量較高而不易被人體消化吸收,通常將其應用于飼料行業(yè)中,使其經(jīng)濟、營養(yǎng)價值受到限制,發(fā)酵是我國常見改善谷物口感及理化性質的方法,因此通過將高粱進行自然發(fā)酵處理,不僅可以擴大高粱的應用范圍,更能提高高粱的食用品質。目前國內外對發(fā)酵高粱研究主要集中在發(fā)酵高粱淀粉的理性化質、凝膠特性[5]及體外淀粉消化率[6]等,但對發(fā)酵高粱的微生物菌群結構變化涉略較少。發(fā)酵過程中微生物代謝產生的有機酸、淀粉酶類、醇類等小分子物質作用于高粱淀粉顆粒,改善高粱淀粉的理化性質,使高粱的營養(yǎng)價值提高,并賦予發(fā)酵高粱產品特殊風味改善其口感。
對于傳統(tǒng)發(fā)酵過程中的微生物研究通常采用實驗室分離培養(yǎng),生理生化反應定向鑒定菌種,但由于實驗室可培養(yǎng)的微生物種類僅占樣品環(huán)境的1%~10%左右,因此通過實驗室純培養(yǎng)不能進一步分析傳統(tǒng)發(fā)酵過程中的微生物群落構成、群落演替以及各種微生物的代謝特性[7],隨著分子生物學的發(fā)展,發(fā)酵微生物菌落變化研究不在需要通過純培養(yǎng)技術進行,大大減少了試驗工作量并為不可培養(yǎng)微生物的研究提供契機。宏基因組學利用現(xiàn)代基因技術,涵蓋生物信息統(tǒng)計分析和基因組學兩方面的意義和技術[8],宏基因組學以基因組技術為基礎通過對環(huán)境中全部DNA 系統(tǒng)全面的研究,以揭示發(fā)酵過程中微生物的菌落交替、相互作用關系及生理生化功能[9]。因此本文利用宏基因組技術研究自然發(fā)酵高粱過程中的菌群結構變化,代謝通路,為工廠化自發(fā)酵高粱產品調控提供理論基礎與數(shù)據(jù)支持。
1 材料與方法
1.1 材料與試劑
高粱:山東臨沂;DNA 提取試劑盒:上海科興責任有限公司;Tris 硼酸、瓊脂糖凝膠、核酸染料、TE 緩沖液和DNA Marker:青島高科園海博生物技術有限公司;AxyPrep DNA 凝膠回收試劑盒:AXYGEN 公司;蒸餾水:國家雜糧技術研究中心重點實驗室自制。
1.2 儀器與設備
Dgg-9053A 型電熱鼓風干燥箱:上海森信實驗儀器有限公司;MJ-10A 型磨粉機:上海市浦恒信息科技有限公司;PTC-200 型梯度擴增PCR 儀、CDS-8000 型凝膠成像分析系統(tǒng):美國Bio-Rad 公司;GS-FLX 型高通量測序儀:美國Roche454 公司;DYY-12 型電泳儀:北京六一儀器廠;Qubit2.0 熒光計:沃德生物醫(yī)學儀器公司;LS-3781L-PC 型高壓滅菌鍋:日本松下健康醫(yī)療器械株式會社。
1.3 試驗方法
1.3.1 樣品處理
將高粱進行自然發(fā)酵0~15 d,取發(fā)酵前期(3 d)、發(fā)酵中期(8 d)、發(fā)酵后期(14 d),裝入無菌離心管中,送去宏基因組高通量測序。
1.3.2 樣品總DNA 的提取
根據(jù)DNA 試劑盒說明書所示標準步驟,進行提取,具體操作步驟如下:
1)稱取發(fā)酵液樣品1 g 于2 mL 離心管中,加入0.8 mL SLX Mlus 緩沖溶液,振蕩混勻5 min。
2)加入80 μL DS 緩沖液并且振蕩混勻。
3)恒溫金屬浴70 ℃裂解10 min。
4)25 ℃室溫下離心5 min(13 000 r/min)。
5)吸取離心后上清液600 μL 于2 mL 無菌離心管中,加入200 μL SP2 緩沖液,振蕩混勻。
6)加入100 μL HTR 試劑,混勻10 s 后進行冰浴5 min。
7)25 ℃室溫離心5 min(13 000 r/min)。
8)吸取離心后上清液400 μL 于2 mL 無菌離心管中,加入450 μL Binding 緩沖液和40 μLMagsi Particles溶液,振蕩混勻,25 ℃下靜置2 min。
9)將2 mL 離心管放置在磁力架上吸附5 min,小心吸棄上層清液,并且移開。
10)加入500 μL Binding 緩沖液,振蕩混勻,25 ℃室溫放置2 min。
11)將2 mL 離心管放置在磁力架上吸附5 min,小心吸棄上層清液,并且移開。
12)加入1 000 μL PHB 緩沖液,振蕩混勻磁珠,放置在磁力架5 min,棄上清。
13)加入1 000 μL SPM Wash 緩沖液,混勻磁珠,放置在磁力架5 min,棄上清。
14)重復步驟(13)即加入1 000 μL SPM 緩沖液,混勻磁珠,放置在磁力架5 min,棄上清。
15)將2 mL 離心管于55 ℃烘箱中烘10 min,使殘留酒精完全揮發(fā)。
16)加入60 μL Elution 緩沖液到離心管中,充分震蕩混勻,65 ℃金屬浴10 min。
17)磁力架吸附5 min,小心吸取上清DNA 液體到新的1.5 mL 離心管中。
1.3.3 樣品DNA 測序文庫構建
1.3.3.1 樣品基因組DNA 片段化
將不同發(fā)酵時期發(fā)酵液樣品進行DNA 片段化,制備插入片段長度為500 bp 左右的文庫,初始DNA 總量為800 ng,使用Elution 緩沖液將DNA 稀釋到130 uL,裝入0.5 mL 的DNA 打斷管中,將DNA 片段化,即使最后打斷的DNA 片段大小集中在300 bp~500 bp 范圍內。使用核酸純化磁珠將破碎后的DNA 片段濃縮回收。
1.3.3.2 樣品基因組DNA 濃度測定
1.3.3.3 樣品基因組DNA 片段末端修復及連接接頭
通過Illumina 公司試劑盒進行建庫,其具體操作步驟如下:
1)將超端準備酶和末端修復反應緩沖液置于冰上解凍。
2)分別加入(綠色)端預酶混合物試劑3.0 μL、(綠色)末端修復反應緩沖試劑6.5 μL、片段化DNA 試劑55.5 μL 于不同發(fā)酵時期樣品片段化后DNA 中。
3)使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應液離心至管底。
4)將上述聚合酶鏈式反應(polymerase chain reaction,PCR)管置于PCR 儀,熱蓋設置為≥75 ℃,并運行以下程序:20 ℃保持30 min、65 ℃保持30 min。
5)將DNA 連接酶,連接增強劑和轉接酶置于冰上解凍。
6)分別加入(紅色)DNA 連接酶試劑15 μL、(紅色)連接增強劑試劑1 μL、轉接酶試劑2.5 μL。
7)使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應液離心至管底。
8)將上述PCR 管置于PCR 儀,并運行以下程序:20 ℃保持15 min。
1.3.3.4 純化后的接頭連接產物進行PCR 擴增富集
1)渦旋振蕩混勻核酸純化磁珠。
2)根據(jù)DNA 片段長度要求,向100 μL DNA 上清液中分兩次加入磁珠,渦旋混勻或移液器吹打10 次混勻,25 ℃孵育5 min。
3)將PCR 管短暫離心并置于磁力架中,待溶液澄清后(約5 min),小心移除上清,加入200 μL 新鮮配制的80%乙醇漂洗磁珠兩次。
4)將PCR 管從磁力架中取出,加入適量21 μL 雙蒸水,渦旋振蕩充分混勻,25 ℃靜置5 min。
5)將PCR 管短暫離心并置于磁力架中分離磁珠和液體,將20 μL 上清液轉移至干凈無菌管中。
6)向無菌管中加入DNA 片段連接酶試劑20 ng、(藍色)熱啟動聚合酶鏈反應母液試劑20 μL、Index Primer/i7 Primer(50 μmol/L)和Universal PCR Primer/i5 Primer(50 μmol/L)試劑各1 μL。
7)使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應液收集至管底后將PCR 管置于PCR 儀中進行擴增。
8)所得PCR 產物用2 g/100 mL 的瓊脂糖凝膠電泳檢測。
1.3.4 數(shù)據(jù)分析
通過不同軟件對微生物多樣性、基因組裝及基因功能注釋技術路線將樣品測序得到的原始序列經(jīng)過數(shù)據(jù)質控之后,進行組裝、注釋公共數(shù)據(jù)庫等分析。
2 結果與分析
2.1 發(fā)酵樣品總DNA 的提取
發(fā)酵樣品總DNA 瓊脂糖凝膠電泳檢測結果如圖1 所示。
由圖1 可知發(fā)酵樣本主條帶清晰,無明顯拖尾且濃度較高,說明發(fā)酵樣品不存在降解,污染,3 個樣品對應位置的條帶大小正確,濃度合適,為后續(xù)試驗的準確性提供了保障,由此可證明擴增片段可用于Illumina雙末端測序。
發(fā)酵樣品的DNA 濃度檢測結果如表1 所示。
發(fā)酵樣品總DNA 的濃度均達到了測序標準,因此可以構建二代測序文庫,可以進行下一步試驗。
2.2 發(fā)酵樣品Illumina 測序數(shù)據(jù)處理
發(fā)酵樣品的高通量測序檢測結果如表2 所示。

圖1 發(fā)酵樣品總DNA 的提取Fig.1 Extraction of total DNA from fermentation samples

表1 發(fā)酵樣品總DNA 的濃度Table 1 Total DNA concentration of fermentation sample
不同發(fā)酵時期所得序列數(shù)分別為4.7×107、7.9×107、4.5×107,為了保證信息分析質量,將測序得到的原始數(shù)據(jù)進行過濾,得到清晰數(shù)據(jù),將所得優(yōu)質reads 利用拼接軟件IDBA_UD 進行拼接組裝,根據(jù)序列間的重疊關系,獲得一定數(shù)目的重疊數(shù),并對多個組裝結果進行了綜合評定,選擇最佳組裝結果[10]。對拼接的拼接重疊數(shù)序列進行開放閱讀框(open reading frame,ORF)預測,選擇長度大于等于100 bp 的基因,并將其翻譯成蛋白序列以便后續(xù)物種注釋及京都基因百科全書與基因組(Kyoto Encyclopedia of Genes and Genomes,KEGG)功能注釋進行研究分析。
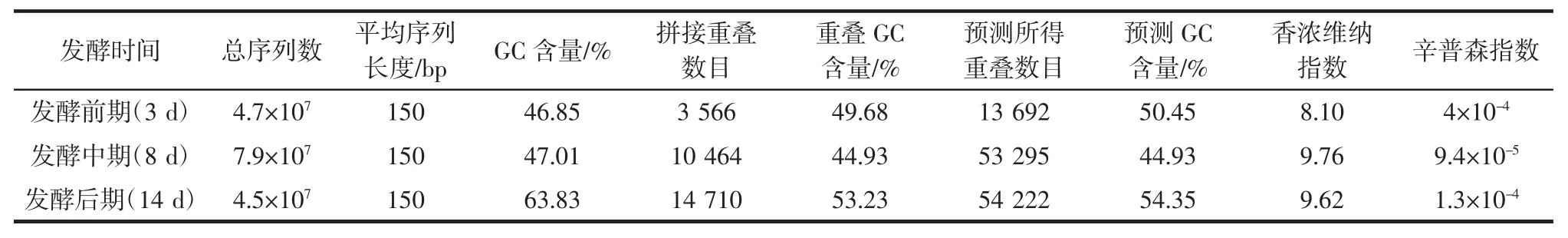
表2 高通量測序結果Table 2 High throughput sequencing results
基因在不同樣本間會出現(xiàn)基因個數(shù)及豐富度有差異的現(xiàn)象,香農維納(Shannon-Wiener)指數(shù)與辛普森(Simposon)指數(shù)被用來表征微生物基因多樣性。香農維納指數(shù)為物種種類數(shù)目,即豐富度又稱為種類中個體分配上的平均性,樣本種類數(shù)目多,其樣本的多樣性越高。同樣,種類之間個體分配的均勻性增加也會是多樣性的提高。如果每一個個體都屬于不同的種,多樣性指數(shù)就最大;如果每個個體都屬于同一種,則多樣性指數(shù)就最小。而辛普森指數(shù)為隨機取樣的兩個個體屬于不同種的概率,群落中種屬越多,各種個體分配越均勻,指數(shù)越高,表明多樣性越好。由表2 可知在發(fā)酵不同時期其香濃維納指數(shù)呈先增加后降低的趨勢,而辛普森指數(shù)為先降低后增加,說明隨著發(fā)酵時間的延長,發(fā)酵液中的微生物群落中種屬類別呈先增加后降低的趨勢,在發(fā)酵中期微生物種屬較多、菌屬的豐富度較大即發(fā)酵樣本多樣性較高。
2.3 發(fā)酵樣品菌群結構及菌種比例分析
將基因集蛋白序列與數(shù)據(jù)庫進行同源性比對,得到功能注釋和同源物種信息。同時根據(jù)美國國家生物技術信息中心(National Center of Biotechnology Information,NCBI)的微生物分類學信息數(shù)據(jù)庫,獲得基因的物種分類注釋信息,其中高粱在不同發(fā)酵時期的微生物菌群在物種分類學水平上的相對豐度如圖2所示。
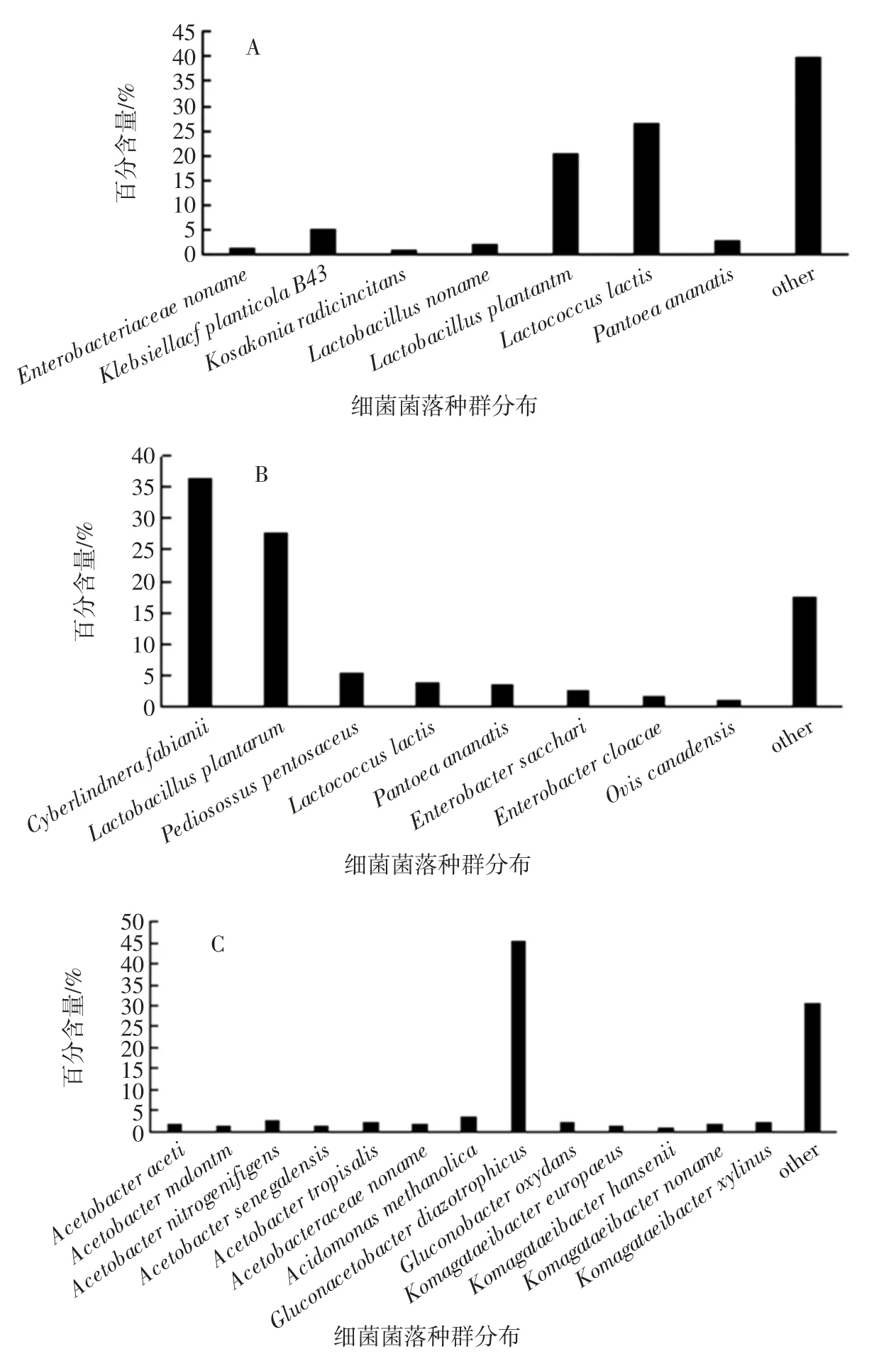
圖2 自然發(fā)酵過程中菌群結構變化Fig.2 Changes in bacterial structure during natural fermentation
在高粱自然發(fā)酵前期過程中,豐富度大于1%的菌群結構如下:乳酸乳球菌的豐富度較高,達到26.54%、乳桿菌屬含量約為22.68 %、其次是腸桿菌屬含量1.59%、固氮菌株豐富度為5.27%,隨著發(fā)酵時間的延長當發(fā)酵時間為8 d 即發(fā)酵中期時酵母菌的豐富度高達36.47%、植物乳桿菌及戊糖片球菌為發(fā)酵中期乳酸菌的主要菌種,其中植物乳桿菌的豐富度較發(fā)酵前期高出7.26%,腸桿菌屬豐富度上升至2.65%、而在發(fā)酵后期即自然發(fā)酵14 d 時葡糖醋桿菌屬豐富度最高,其中Gluconacetobacter diazotrophicus(固氮葡糖醋桿菌)菌種含量為45.54%,醋桿菌屬的豐富度隨發(fā)酵時間的延長而增加至11.38%,此時發(fā)酵液產生較大的刺激性酸味、酸度增加,說明高粱在自然發(fā)酵過程中優(yōu)勢菌為乳酸菌及酵母菌,Michael G 等[11]通過將高粱進行發(fā)酵生產酸面團研究發(fā)現(xiàn)其中優(yōu)勢菌種為羅伊氏乳桿菌,植物乳桿菌和發(fā)酵乳桿菌及干酪乳桿菌,棒狀乳桿菌等,而Sedjro Emile Tokpohozin 等[12]通過基質輔助激光解吸離子飛行質譜獲得的蛋白質組分析高粱啤酒中的優(yōu)勢菌為發(fā)酵乳桿菌,植物乳桿菌,瑞士乳桿菌,副干酪乳桿菌和短乳桿菌等,Jialiang Xu 等[13]通過宏基因組分析高粱米酒中優(yōu)勢菌屬為寡養(yǎng)單胞菌屬,蛭弧菌屬,溶藻屬,硫磺菌屬和無色桿菌等,本文通過將高粱進行自然發(fā)酵研究發(fā)現(xiàn)其發(fā)酵過程中的優(yōu)勢菌種為胚芽乳桿菌(Lactobacillus plantarum)、乳酸乳球菌(Lactococcus lactis)、費比恩畢赤酵母(Cyberlindera fabianii)、醋酸桿菌(Acetobacter malorum)、固氮葡糖醋桿菌(Gluconacetobacter diazotrophicus)等,說明在高粱自然發(fā)酵的過程中酵母菌是慢慢富集的過程,在發(fā)酵過程之中乳酸菌的大量存在增加了酵母菌的代謝潛能[14],而在發(fā)酵后期醋桿菌屬的大量富集使酵母菌豐富度下降,說明畢赤酵母等酵母菌耐酸性較差。
2.4 發(fā)酵樣品菌群主要代謝通路分析
發(fā)酵樣品中主要代謝通路及主成分分析結果如表3 所示。

表3 發(fā)酵樣品中主要代謝通路及主成分分析Table 3 Main metabolic pathways in fermentation samples
使用GhostKOALA[15]將基因集蛋白序列與KEGG數(shù)據(jù)庫進行比對,得到序列對應的基因數(shù)據(jù)庫(KEGG orthology,KO)基因號,根據(jù)KO 與通路和模塊的聯(lián)系得到序列的通路,模塊注釋信息,包括代謝通路、合成通路、膜轉運、信號傳遞、細胞周期以及疾病相關通路等,并統(tǒng)計KEGG 各功能層級在各個樣本中的豐富度。其結果如下:
在高粱自然發(fā)酵的過程中,微生物菌群的代謝結構發(fā)生變化,隨著發(fā)酵時間的延長,氨基酸代謝、碳水化合物代謝等基因數(shù)目較大,而發(fā)酵后期基因數(shù)目有一定程度的降低,通過宏基因組序列的代謝重建,揭示了蛋白質和碳水化合物異養(yǎng)發(fā)酵的特征,與檢測到乙醇和pH 值下降相符即發(fā)酵隨著發(fā)酵時間的延長醋酸菌屬的豐富度增加,使整個發(fā)酵體系的酸度增加pH值下降,使微生物生長的抑制效應逐漸增強,其中乳酸菌和醋酸菌自身具有一定的醋酸耐受力,逐漸成為豐度較高的主體微生物,而通過代謝途徑可知,碳水化合物代謝主要途徑為三羧酸循環(huán)、丙酮酸代謝、磷酸戊糖和糖酵解途徑等[16],其中間代謝產物所產生大量的檸檬酸、乙酸、丁酸等有機酸亦使溶液的pH 值逐漸降低。因此,除加工技術(麥芽化,糖化),高粱麥芽汁組成之外,發(fā)酵產生的代謝產物(有機酸,醇)和pH值等因素決定了發(fā)酵劑微生物菌群結構。
3 結論
通過紅宏基因組技術分析高粱在自然發(fā)酵過程中菌群演替變化及優(yōu)勢菌群的代謝途徑和特定功能的基因數(shù)目,結果發(fā)現(xiàn)在發(fā)酵過程中優(yōu)勢菌種為胚芽乳桿菌(Lactobacillus plantarum)、乳酸乳球菌(Lactococcus lactis)、費比恩畢赤酵母(Cyberlindera fabianii)、醋酸桿菌(Acetobacter malorum)、固氮葡糖醋桿菌(Gluconacetobacter diazotrophicus)等,其中酵母菌的豐富度隨著發(fā)酵時間的延長而增加,而發(fā)酵后期醋桿菌屬的大量富集使整個發(fā)酵體系顯酸性,說明發(fā)酵過程中的優(yōu)勢菌種為耐酸性菌種,其中發(fā)酵體系中醋酸菌的豐度較高,由于其具有較強的氧化能力,能夠較快地將乙醇氧化為醋酸[17],使發(fā)酵液pH 值降低。通過功能注釋聚類分析結果得知,高粱自然發(fā)酵過程中主要功能信息包括微生物代謝通路、合成通路、膜轉運、信號傳遞、細胞周期以及疾病相關通路等,其中間代謝產物有機酸等為微生物的繁殖生長提供了有利條件。本試驗通過高通量測序的宏基因學分析高粱發(fā)酵過程中的微生物菌群結構變化,進一步明確發(fā)酵高粱中微生物的群落結構演替、相互作用,同步確定各種微生物的豐度,通過了解高粱自然發(fā)酵過程中的代謝機理,并挖掘出新的功能基因,對高粱自然發(fā)酵的工廠化生產及品質調控提供理論基礎與數(shù)據(jù)支持。

