野生艾蒿內生菌的分離及其拮抗活性菌的篩選
冀玉良,肖一桐,王明迪
(商洛學院生物醫藥與食品工程學院,陜西商洛 726000)
植物內生菌是在植物生活史的一定階段或全部階段存在于其各種組織、器官的細胞間隙或細胞內的微生物。植物內生菌是一個十分豐富的類群,許多植物內生細菌、真菌及放線菌對植物病原菌都有拮抗作用,它們的防病機理主要表現在通過產生抗生素類、水解酶類、分泌植物生長調節劑和生物堿類物,與病原菌競爭營養物質或生存空間,增強宿主植物的抵抗力以及誘導植物產生系統抗性等途徑抑制病原菌生長繁殖[1-2],植物內生菌已經成為開發生防農藥不可忽視的資源。另外在長期與植物的協同進化中,通過基因的橫向轉移,內生菌還形成了與植物部分相同的代謝途徑,參加植物次生活性物質的積累[3-5],因此,植物內生菌也是天然活性物質的來源之一,藥用植物內生菌有望在醫藥開發上作為發酵生產菌生產植物的藥用成分。
野生艾蒿(Artemisia Argyi)是一種菊科蒿屬多年生草本植物,也是傳統的中藥之一,其主要化學成分為揮發油類、黃酮類、桉葉烷類和三萜類等化合物,艾蒿中的黃酮類化合物具有抗氧化、清除自由基、抗癌和抑菌等多種生物活性[6]。國內外的研究表明,植物不同,從其組織中所分離到的內生菌的種類和數量不同,即使是同一種植物,因其所處的生境、氣候特點、地理位置等因素的差異,從其組織器官中分離到的內生菌也會不同[7-9]。雖然徐亞軍等[10]對河南商丘地區野生艾蒿內生菌的研究已有報道,但對氣候和地理位置比較獨特、藥用植物道地性極為突出的商洛地區的艾蒿內生菌,目前尚未有研究報道。本研究從商洛野生艾蒿組織器官中分離內生細菌和內生真菌,并從中篩選出具有拮抗活性的菌株,旨在為醫藥生產、植物病蟲害的防治和生物農藥的研發提供有應用價值的菌種資源。
1 材料與方法
1.1 實驗材料
1.1.1 供試植物
新鮮無病害野生艾蒿整體植株,于2019 年4 月27 日采自陜西省商洛市商州區金鳳山,采樣后裝入保鮮袋內帶回實驗室,避光保存于4 ℃冰箱,2 d 內樣品處理完畢。
1.1.2 供試指示菌
本研究的供試指示菌購自陜西省微生物研究所,供試細菌依次是金黃色葡萄球菌(Staphylococcus Aureus),枯草芽孢桿菌(Bacillus Subtilis),大腸桿菌(Escherichia Coli);供試植物病原菌依次是棉花枯萎病菌(Fusarium Oxysporum),茄病鐮孢霉(Fusarium Solani),煙草赤星病菌(Alternaria Alternata)。
1.1.3 培養基
1)牛肉膏蛋白胨固體分離培養基:牛肉膏3 g、蛋白胨 10 g、NaCl 5 g、瓊脂 18 g、蒸餾水 1 000 mL、pH7.4~7.6;2)牛肉膏蛋白胨液體培養基(不加瓊脂);3)PDA 固體分離培養基:馬鈴薯 200 g、葡萄糖 20 g、瓊脂 18 g、蒸餾水 1 000 mL、pH7.0 左右;4)PDA 液體發酵培養基:PDA 培養基不加瓊脂。
1.2 艾蒿內生菌的分離
1.2.1 艾蒿內生細菌的分離
艾蒿內生細菌分離采用組織塊法[11]。將采集來的新鮮艾蒿用自來水沖洗干凈、晾干后剪成大小合適的組織塊,在超凈工作臺中紫外滅菌20 min,然后在75%乙醇中浸泡1~2 min,無菌水沖洗5 次;0.1%升汞中浸泡1~3 min,無菌水沖洗5 次。
用滅過菌的解剖刀將上述滅菌后的大塊組織按根、莖切去外皮后橫切為0.5 cm 的小塊,葉切為0.5 cm 的小片,用滅過菌的鑷子分別將根、莖靠內側切面和葉片貼向培養基接種于牛肉膏蛋白胨培養基上,每皿4 塊,接種后的培養基置入28 ℃的恒溫培養箱培養4~6 d。待接種組織塊與培養基接種面邊緣有菌落出現時,挑取位置、大小和形狀等不同的單菌落,用平行劃線法接入新鮮培養基,于28 ℃繼續培養,待長出新菌落后,根據菌落形態與顏色的不同,再次挑取菌落進行純化,反復純化至單一菌種保存于4 ℃冰箱備用。
為了判斷組織塊表面消毒是否徹底,分別取最后一次沖洗組織塊的沖洗液0.5 mL 涂布于牛肉膏蛋白胨培養基上,并于相同條件下培養作為對照。若無菌落長出則表明消毒徹底,否則分離到菌株不能證明是內生菌,棄之不用。
1.2.2 艾蒿內生真菌的分離
艾蒿內生真菌的分離基本同內生細菌。所不同的是,組織塊接種于PDA 培養基上,對照組沖洗液也涂布于PDA 培養基。待培養后接種面邊緣有菌絲長出時,用尖端菌絲挑取法[12]挑取位置、顏色和形態不同的單菌絲接種于新鮮PDA培養基,反復純化得到單一菌株。
1.3 內生菌在艾蒿中的分布統計
分別統計總組織塊數、分離到菌株的組織塊數、每個組織塊中分離到的菌株數、每組組織塊中分離到的菌株數、總分離到的菌株數。分別計算定殖率、分離率[13]:
定殖率=分離出菌株的組織塊數/總組織塊數
分離率=每組組織塊中分離到的菌株數/總分離到的菌株數
1.4 分離內生菌的形態學觀察
將分離純化得到的內生細菌接種在牛肉膏蛋白胨培養基上,28 ℃下培養4~6 d 后,用肉眼觀察菌落的形態、大小、顏色、透明程度、邊緣和突起等特征。通過革蘭氏染色,在油鏡下觀察細菌的形狀和特征。
1.5 拮抗性內生細菌的篩選
拮抗性內生細菌的篩選采用紙片法[14]:內生細菌接種于100 mL 牛肉膏蛋白胨液體培養基中進行搖瓶振蕩培養4 d,制得發酵液。靶標菌(金黃色葡萄球菌,枯草芽孢桿菌和大腸桿菌)接種于牛肉膏蛋白胨瓊脂斜面上培養后制成菌懸液,取0.1 mL 菌懸液涂布于牛肉膏蛋白胨平板中制成含菌平板。用無菌鑷子將濾紙片浸入內生菌發酵液中,取出并在瓶內壁除去多余的菌懸液,將紙片放到接好靶標菌的平板上,每個處理3 個重復,以無菌水代替發酵液浸泡濾紙片作對照,在28 ℃培養48~72 h 后,用十字交叉法測量抑菌圈大小,計算抑菌帶寬度:
抑菌帶寬度=(抑菌圈直徑-測量菌直徑)/2。
1.6 拮抗性內生真菌的篩選
拮抗性內生真菌的篩選采用菌餅對峙法[15]。在無菌條件下,打取病原菌菌餅接于PDA 平板培養基中央,另打取內生真菌菌餅接種于PDA 培養基平板距中央2.5 cm 處,以只接病原菌菌餅于平板中央為對照,在28 ℃恒溫培養4 d 后,測量對照菌落和處理菌落直徑,并計算抑菌率:
抑菌率=[(對照菌落直徑-處理菌落直徑)/對照菌落直徑]×100%
2 結果與分析
2.1 野生艾蒿內生菌的分離結果
在牛肉膏蛋白胨培養基平板上共接種81 個組織塊,其中根組織塊34 個、莖組織塊29 個、葉組織塊18 個;分離到內生細菌35 株,其中在野生艾蒿根中分離到18 株,莖中分離到15 株,葉中分離到2 株;根莖葉內生細菌的定殖率、分離率見表1。
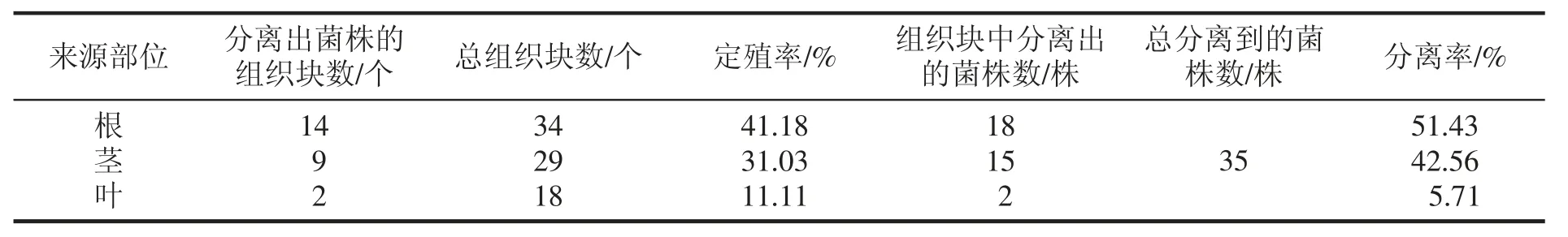
表1 野生艾蒿內生細菌的定殖率、分離率
從表1 中可以看出,野生艾蒿內生細菌在根中的定殖率、分離率分別是41.18%和51.43%,在莖中的定殖率、分離率分別是31.03%和42.56%,在葉中的定殖率、分離率分別是11.11%和5.71%。從定殖率與分離率來看,野生艾蒿根和莖中內生細菌含量較為豐富,這與任慧爽等[11]對桑樹內生細菌多樣性及內生拮抗活性菌群的研究結果基本一致。
本研究在PDA 平板上共接種69 個組織塊,其中來自根組織塊22 個,莖組織塊24 個,葉組織塊23 個;分離到內生真菌共19 株,其中在野生艾蒿根中分離到12 株,莖中分離到7 株,葉中未分離到內生真菌;根莖葉中內生真菌的定殖率、分離率見表2。
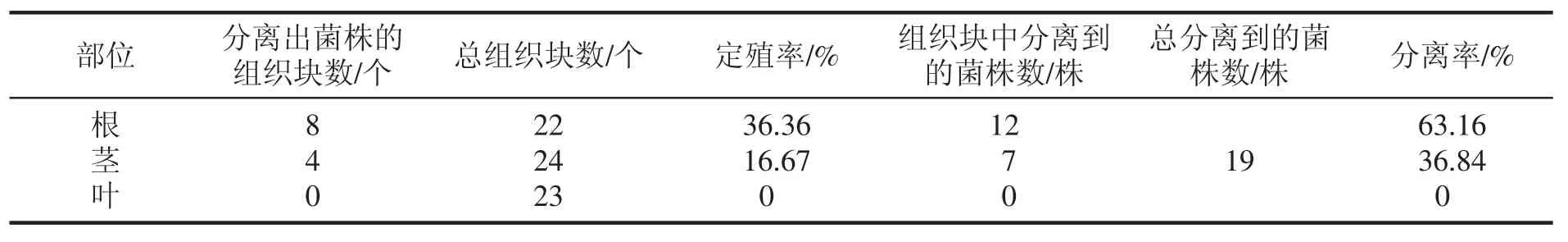
表2 野生艾蒿內生真菌的定殖率和分離率
從表2 中可以看出,野生艾蒿內生真菌在根中的定殖率、分離率分別是36.36%和63.16%,在莖中的定殖率、分離率分別是16.67%和36.84%,在葉中的定殖率、分離率均為0。說明商洛野生艾蒿內生真菌主要分布在根和莖中,并且野生艾蒿根中的內生真菌含量高出莖中近2 倍。
分離的內生細菌和內生真菌在野生艾蒿中的分布情況和菌株編號,分別見表3 和表4。

表3 野生艾蒿內生細菌的分布

表4 野生艾蒿內生真菌的分布
從表3、表4 分別可以看出,野生艾蒿中內生細菌和內生真菌在不同部位的分布表現既差異又相似的規律。內生細菌在艾蒿的根、莖和葉中分布比例分別為51.43%、42.56%和5.71%;內生真菌在艾蒿的根、莖和葉中分布比例分別為63.16%、36.84%和0,從中可以看出,商洛野生艾蒿植物中內生細菌、真菌的數量分布均表現為根中最高,莖中次之,葉中最少。
2.2 分離菌株形態學觀察
對分離獲得的35 株內生細菌進行了菌落形態、革蘭氏染色、菌株個體形態鑒定,結果見表5。

表5 內生細菌的形態特征
2.3 拮抗性內生菌篩選
2.3.1 拮抗性內生細菌
采用紙片法,以金黃色葡萄球菌、枯草芽孢桿菌、大腸桿菌為供試靶標菌,經反復篩選,得到4 株具有明顯拮抗性的內生細菌,其中BS-6 和BR-6 菌株對枯草芽孢桿菌具有拮抗性;BR-9和BS-12 菌株對大腸桿菌具有拮抗性。
圖1 是將枯草芽孢桿菌稀釋涂布于A、B 平板中,a 為用無菌水浸過的濾紙片,b 為用含BS-6的菌懸液浸過的濾紙片,c 為用含BR-6 的菌懸液浸過的濾紙片,與對照相比可以看出,b、c 均有明顯的抑菌圈,c 的抑菌圈更大,說明BS-6 和BR-6 菌株對枯草芽孢桿菌具有較強拮抗作用。抑菌帶寬度分別為 0.81±0.1 cm 和 1.64±0.1 cm(表 6)。
圖2 是將大腸桿菌稀釋涂布于A、B 平板中,a 為用無菌水浸過的濾紙片,b 為用含BR-9的菌懸液浸過的濾紙片,c 為用含BS-12 的菌懸液浸過的濾紙片,與對照相比可以看出,B 平板中的b、c 均有明顯的抑菌圈,說明兩者對大腸桿菌均有拮抗作用,抑菌帶寬度分別為0.93±0.1 cm和 0.86±0.1 cm(表7)。
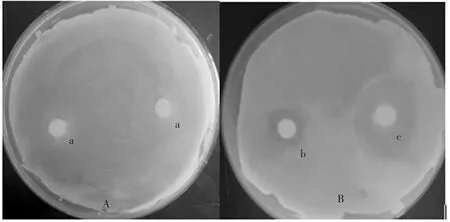
圖1 BS-6和BR-6 菌株對枯草芽孢桿菌的拮抗作用
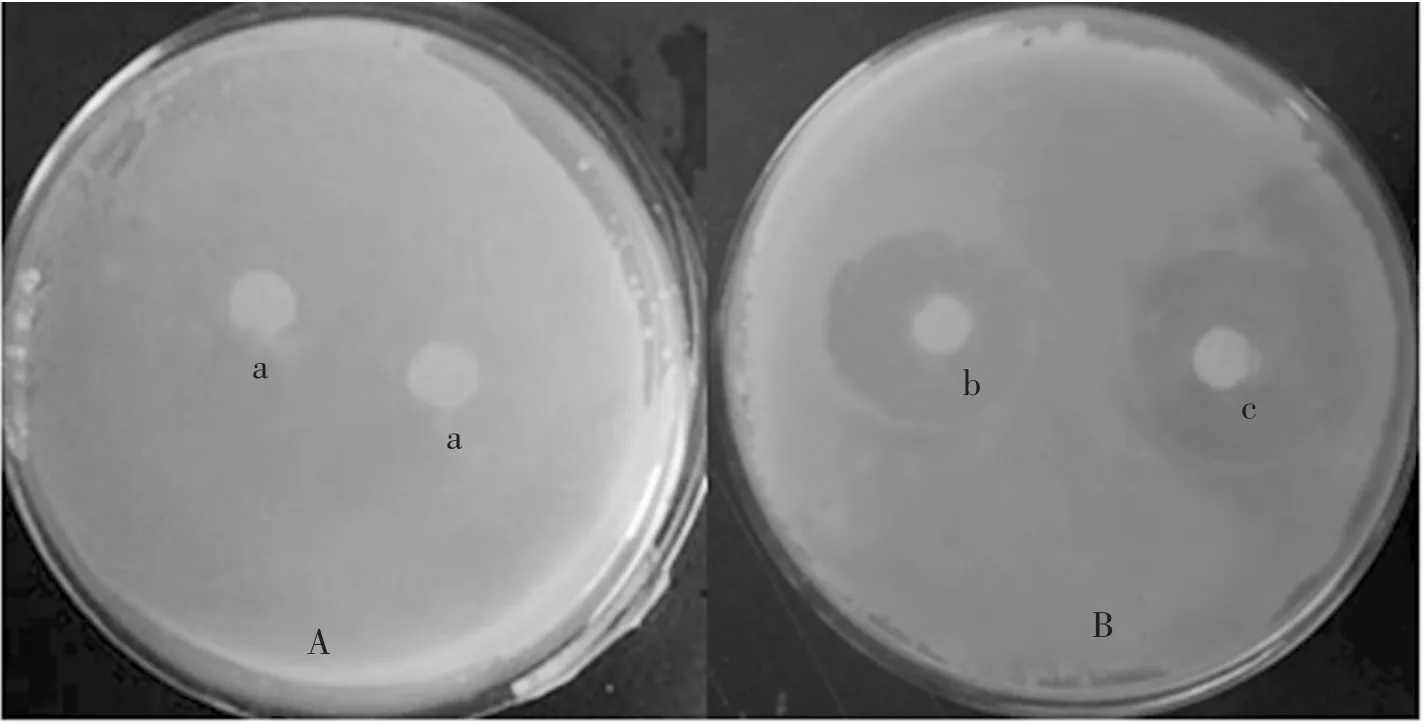
圖2 BR-9 和BS-12 菌株對大腸桿菌的拮抗作用
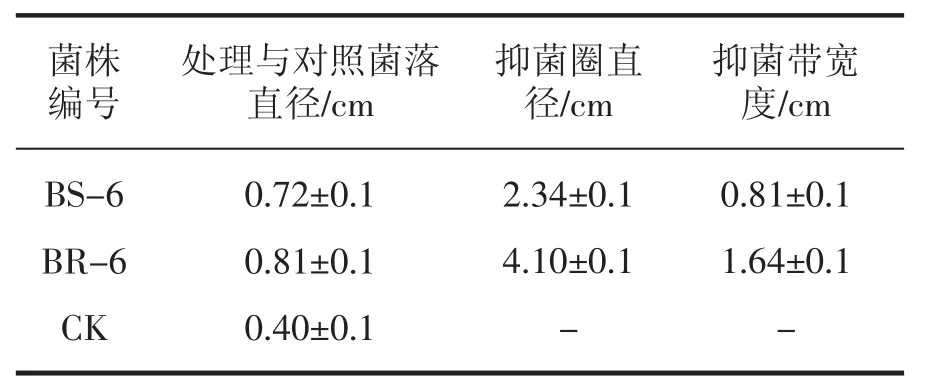
表6 BS-6 和BR-6 菌株對枯草芽孢桿菌的拮抗性效果
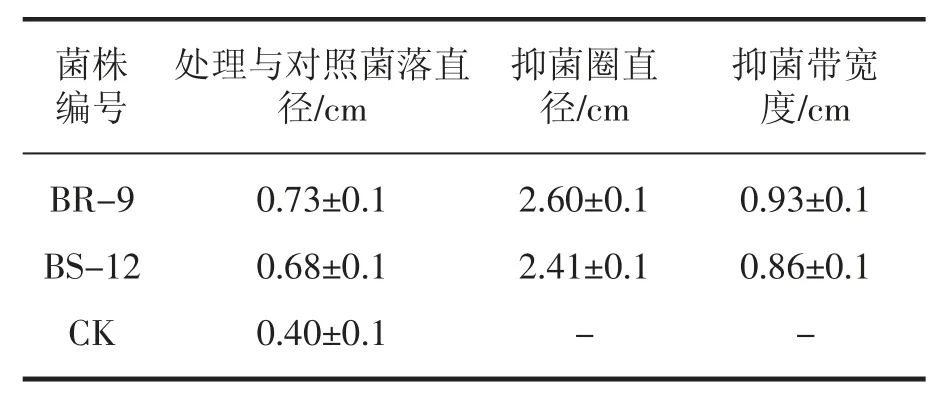
表7 BR-9 和BS-12 菌株對大腸桿菌的拮抗性效果
2.3.2 拮抗性內生真菌的篩選
采用平板兩點對峙法,以棉花枯萎病、煙草赤星病、茄病鐮孢霉為病原菌,對分離到的19 株內生真菌進行病原菌抗性篩選。結果表明,有2 株內生真菌有拮抗性,其中FR-4 菌株對茄病鐮孢霉具有拮抗性,但對棉花枯萎病菌和煙草赤星病菌無拮抗性。FS-8 菌株對棉花枯萎病菌具有拮抗性,但對茄病鐮孢霉和煙草赤星病菌無拮抗性。
圖3 中將含茄病鐮孢霉的菌餅置于A、B 平板a 的位置,含FR-4 菌株的菌餅置于B 平板b的位置,培養一段時間后發現,A 圖的茄病鐮孢霉生長良好,而從B 圖可以明顯的看出茄病鐮孢霉的菌絲生長受到FR-4 菌株的抑制,產生了月牙形狀,分別測定對照菌落直徑、處理菌落直徑,計算出FR-4 菌株對茄病鐮孢霉的抑菌率達38.61%(表8),表現出較強的拮抗作用。

圖3 FR-4 菌株對茄病鐮孢霉的拮抗性作用
圖4 中將棉花枯萎病菌的菌餅置于A、B 平板a 的位置,含FS-8 菌株的菌餅置于B 平板b的位置,培養一段時間后發現,A 圖的棉花枯萎病菌生長良好,而B 圖的棉花枯萎病菌的菌絲擴展受到FS-8 菌株的抑制,使得棉花枯萎病菌的右側區域凹陷進去,不再向四周擴展。測出FS-8菌株對棉花枯萎病菌的抑菌率為31.34%(表 8)。

圖4 FS-8 菌株對棉花枯萎病菌的拮抗性作用

表8 FR-4 和FS-8 菌株對植物病原菌的抗菌效果
3 結論與討論
本研究從商洛野生艾蒿根、莖、葉中共分離到54 株內生菌,其中內生細菌35 株,內生真菌19 株,分離到的內生細菌、真菌的含量分布均表現為:根部最多,莖中次之,葉部最少。以金黃色葡萄球菌,枯草芽孢桿菌,大腸桿菌為指示菌對分離內生細菌的拮抗性進行了測定,篩選得到4株具有明顯抗菌作用的菌株,分別是菌株BS-6和BR-6 對枯草芽孢桿菌具有明顯的抗菌作用,抑菌圈直徑分別為 2.34±0.1 cm 和 4.10±0.1 cm。菌株BR-9 和BS-12 對大腸桿菌的抑菌效果均較明顯,抑菌圈直徑分別為2.60±0.1 cm 和2.41±0.1 cm;以棉花枯萎病菌,茄病鐮孢霉,煙草赤星病菌為供試植物病原菌,對分離的內生真菌的拮抗性進行了測定,篩選得到2 株具有明顯抗菌作用的菌株,分別是FR-4 菌株對茄病鐮孢霉具明顯的拮抗作用,抑菌率達38.61%,FS-8 菌株對棉花枯萎病菌具有明顯的拮抗作用,抑菌率為31.34%。這表明內生菌在野生艾蒿中分布比較豐富,具有拮抗活性的菌株比例和拮抗活性都比較高。
內生菌普遍存在于植物組織中,但從不同植物體內分離得到的內生菌數量和種類有所差異,即使是同一種植物,也會因生境、品種和年齡等的不同而分離出不同數量和種類的內生菌。如徐亞軍等[10]從河南商丘地區野生艾蒿的根莖葉部位分離出內生細菌共68 株,篩選獲得對病原菌抑制效果最明顯的3 株菌并對其進行了分子水平的分類和鑒定。馬長樂等[16]從云南榧的新鮮莖與葉中分離得到10 株內生真菌和5 株內生放線菌,發現2 株內生真菌和2 株內生放線菌對植物病原菌均表現出了較強的抑菌活性。杜曉寧等[17]從寧夏枸杞各藥用組織器官中分離出內生細菌34 株,隸屬于 7 科 11 屬,內生細菌的數量和群落組成存在明顯的組織特異性,且遺傳多樣性豐富,對植物病原菌有較強的抑制活性。從不同植物不同環境下分離到的內生菌數量、類型和拮抗性大小不同,正說明了植物內生菌是一個極其豐富的群體,其中蘊藏著對人類有用的各種功能性菌種資源,值得人們進行廣泛的研究開發。
根據現有的研究,內生菌寄生于植物中與植物之間形成了一種協同進化、互惠互利的關系[18-19],對于藥用植物而言,內生菌對植物的作用表現為三個方面,其一可能通過分泌生長素,促進植物的生長;二是參與植物有效活性成分合成的部分代謝,有利于藥用植物活性成分的積累;三是寄生于植物組織中抑制植物病原菌,防止病原菌侵染和病蟲害的發生[20]。艾蒿是傳統的中藥材,具有活血通絡止疼、抗菌消炎驅蟲等功效。醫學和中藥材抗菌試驗中一般通用的指示菌為金黃色葡萄球菌,枯草芽孢桿菌和大腸桿菌,本研究中分離到的拮抗性內生細菌具體的抑菌機理雖然還有待深入研究,但推測可能與艾蒿有效成分對指示菌的抑菌作用機理有共同之處。如果是一樣的,分離到的內生細菌可能還可以作為醫藥的生產菌種用于工業發酵中生產艾蒿活性物質。
關于內生菌在防治植物病原菌侵害方面的研究,以前都廣泛集中于內生真菌對植物病原菌的抵抗方面,近幾年有不少內生細菌對植物病原菌抑制作用的研究。由于植物病原菌大多數為真菌,內生細菌一般是通過分泌抑菌物質對植物病原菌產生抑制的,而內生真菌對植物病原菌的抑制除可能分泌某種抑菌物質外,主要是通過空間占位、營養競爭和溶解菌絲等達到對病原菌抵抗的。本研究篩選到的2 株內生真菌抵抗植物病原菌作用明顯,FR-4 菌株對茄病鐮孢霉抑菌率達38.61%,FS-8 菌株對棉花枯萎病菌的抑菌率為31.34%,2 株菌都有作為生防菌種應用于農業生產中的潛力。
本研究對分離的內生真菌未進行鑒定,對內生細菌只從形態上作了初步鑒定,對內生細菌和真菌的抑菌作用機理也只從抑菌現象上進行了分析,對分離的內生細菌是否對植物病原菌也有拮抗作用未進行測定,下一步將研究內生細菌對植物病原菌的拮抗作用,結合形態學特征及細菌16S rRNA 序列的系統進化分析確定篩選到的拮抗內生菌的具體種屬類型[21],并提取和分析內生菌產生的拮抗性代謝物質,深入研究其拮抗作用。

