傳統發酵藍莓飲料中乳酸菌的分離鑒定及篩選
胡楠,雷鳴,王遠一飛,王俊平,王碩,2,*
(1.天津科技大學食品工程與生物技術學院食品營養與安全國家重點實驗室,天津300457;2.南開大學醫學院天津市食品科學與健康重點實驗室,天津300071)
乳酸菌是一種具有安全性且常用發酵食品的微生物[1]。乳酸菌能夠在適宜條件下快速繁殖、產酸,使發酵基質的pH 值迅速降低,不僅有效抑制耐酸能力較差的微生物在發酵基質中的生長繁殖,還能夠賦予發酵食品獨特的味道[2]。目前,乳酸菌被廣泛應用于酸奶[3]、泡菜[4]、酸菜[5]和發酵型飲料[6]等發酵食品中。
傳統發酵藍莓飲料主要采用自然發酵的方式,利用水果果皮、環境或地域等天然存在的微生物作為發酵菌株[7],通過微生物間的優勝劣汰來完成發酵。其中,主導發酵的菌株多為乳酸菌[8],但仍存在一些雜菌和少數致病菌,并且該方法存在發酵工藝不易控制和成品品質參差不齊等缺點。近年來,研究人員采用直投菌種的方式實現發酵藍莓果汁[9],但多采用商業化的菌株,缺少對其針對性的篩選。利用生物學手段從自然發酵的藍莓飲料中分離篩選出發酵性能優異的菌株,對于產品生產、質量控制和安全性具有實際意義[10],并可為后續研究發酵機理和功能成分代謝提供了理論基礎。
本文從傳統發酵藍莓飲料中分離和鑒定出乳酸菌,分析其產酸能力、耐受性能力和藍莓發酵過程中的生長能力,從而篩選出可用于發酵藍莓果汁的乳酸菌。
1 材料與方法
1.1 材料與試劑
傳統發酵藍莓飲料:黑龍江省伊春市。
MRS 培養基、MRS 肉湯:北京陸橋技術股份有限公司;細菌DNA 提取試劑盒:TIANGEN 生化科技(北京)有限公司。
1.2 儀器與設備
全自動生長曲線分析儀(FP-110-C):芬蘭Bioscreen C 公司;數碼生物顯微鏡(DN-117M):寧波永新光學股份有限公司;pH 計(FE-28):瑞士梅特勒公司;高壓滅菌器(HVA-85):日本 HIRAYAMA 公司;凝膠成像儀和電泳儀:美國Bio-Rad 公司;離心機(5804 R):德國Eppendorf 公司。
1.3 方法
1.3.1 樣品DNA 提取及16S rDNA 測序
傳統發酵藍莓飲料樣品送至天津諾禾致源生物信息科技有限公司,采用十六烷基三甲基溴化銨法(cetyltrimethylammonium ammonium bromide,CTAB)法[11]提取樣品DNA,以515F-806R 為引物擴增細菌16S V4 區,并進行高通量測序文庫的構建和Ion S5 XL平臺的單端測序。
1.3.2 乳酸菌的分離純化及保種
將傳統藍莓發酵飲料樣品等梯度稀釋后涂布于含有 2%碳酸鈣的 MRS 培養基[12],37 ℃厭氧培養(48±2)h。挑取平板上具有溶鈣圈的菌落進行三區劃線,重復3 次,得到純化菌株。將純化后的菌株接入MRS 肉湯中,37 ℃過夜靜置培養。吸取10 μL 該菌液再接入MRS 肉湯中重復培養3 次后,進行保種及菌種鑒定。
1.3.3 乳酸菌的鑒定與形態學分析
參照TIANGEN 基因組DNA 提取試劑盒[13]說明書進行DNA 提取。以DNA 為模板進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增,引物分別為27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和 1492R(5’-GGTTACCTTGTTACGACTT-3’)[14]。經瓊脂糖凝膠電泳檢測,將條帶清晰且單一[15]的PCR 產物送至金維智生物科技有限公司進行測序。序列比對采用GenBank 中的 BLAST 進行分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)[16]。
對鑒定后的菌株進行菌落特征觀察和細胞形態學觀察[17]。
1.3.4 乳酸菌初篩
利用Geneious 軟件將乳酸菌純化菌株的16SrDNA序列與樣品高通量測序中所有聚類單元(operational taxonomic unit,OTU)代表序列進行比對,選出與乳酸菌的OTU 代表序列匹配度為100%的菌株。
1.3.5 乳酸菌復篩
1.3.5.1 產酸試驗
將初篩得到的菌種以5%的接種量接入MRS 肉湯中,厭氧培養24 h 后測定菌液pH 值,確定各菌株產酸能力。
1.3.5.2 胃液及膽汁耐受能力
參考Charteris 和Pacheco 等[18-19]方法測定胃液及膽汁耐受能力,略有改動,具體方法如下:
取 1 mL 菌液,4 ℃、12 000 r/min 離心 5 min,棄去上清液,用生理鹽水洗滌2 次,將沉淀于1 mL 生理鹽水中充分混勻。在10 mL 人工胃液(pH 2.0)和10 mL 人工膽汁中分別加入100 μL 上述菌液,分別在37 ℃下孵育1 h 和2 h。參考GB/T 4789.35-2016《食品安全國家標準食品微生物學檢驗乳酸菌檢驗》進行活細胞計數[20]。
1.3.6 乳酸菌生長曲線的繪制
參考劉書亮等[21]方法測定生長曲線,略有改動,具體方法如下:
以5%的接種量將上述菌種分別接入MRS 肉湯中,轉至100 孔板中,利用全自動生長曲線分析儀測定其生長曲線。37 ℃培養,每隔1 h 測定吸光度(檢測波長600 nm)。以培養時間為橫坐標,菌液OD600值為縱坐標,繪制生長曲線。
1.3.7 乳酸菌發酵藍莓果汁終點活細胞計數
將乳酸菌培養至對數期,以5%的接種量接入藍莓果汁中,于37 ℃靜置發酵。取發酵72 h 的發酵液進行乳酸菌活細胞計數[22]。
1.3.8 數據分析
利用 Excel 2016、SPSS Statistics 20.0 等統計軟件進行數據處理和分析。
2 結果與分析
2.1 傳統發酵藍莓飲料的物種相對豐度
分析傳統發酵藍莓飲料中的微生物組成可以更好地控制生產工藝以及成品質量,通過16S rDNA 高通量測序得到的傳統發酵藍莓飲料中細菌屬水平物種相對豐度如圖1 所示(僅展示相對豐度排名前十的物種)。
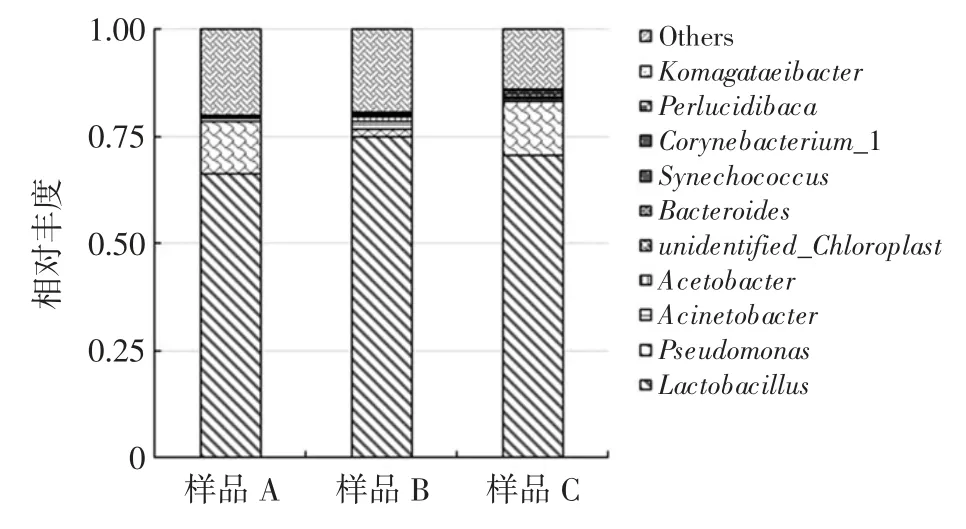
圖1 傳統藍莓發酵飲料屬水平物種相對豐度Fig.1 Relative abundance of traditional fermented blueberry beverages at genus level
傳統發酵藍莓飲料屬水平物種相對豐度中只有乳桿菌屬(Lactobacillus)和假單胞菌屬(Pseudomonas)超過1%,說明其優勢物種相對明顯。Lactobacillus 在各樣品中的相對豐度介于65.4%~73.2%之間,均值為69.1%,相對豐度排名第一,菌群優勢明顯。研究表明,Lactobacillus 是很多發酵食品中的主要發酵菌[3-6]。研究人員從發酵食品中分離得到該產品的主要優勢菌并加以利用[23],不但較大程度上還原了發酵食品的風味而且在產品質量上也得到較好的控制。Pseudomonas在各樣品中的相對豐度介于1.5%~12.1%之間,均值為8.5%,相對豐度排名第二,不是主要的發酵菌,可能在發酵過程中與發酵菌協同完成發酵,有報道稱其與Lactobacillus 為芥菜發酵過程中的主要微生物[24],或者是由于成品低溫儲存時間過長導致其生長[25]。
2.2 菌落和菌體形態學分析
通過分離純化得到部分純化菌株菌落和菌體形態,如圖2 所示。
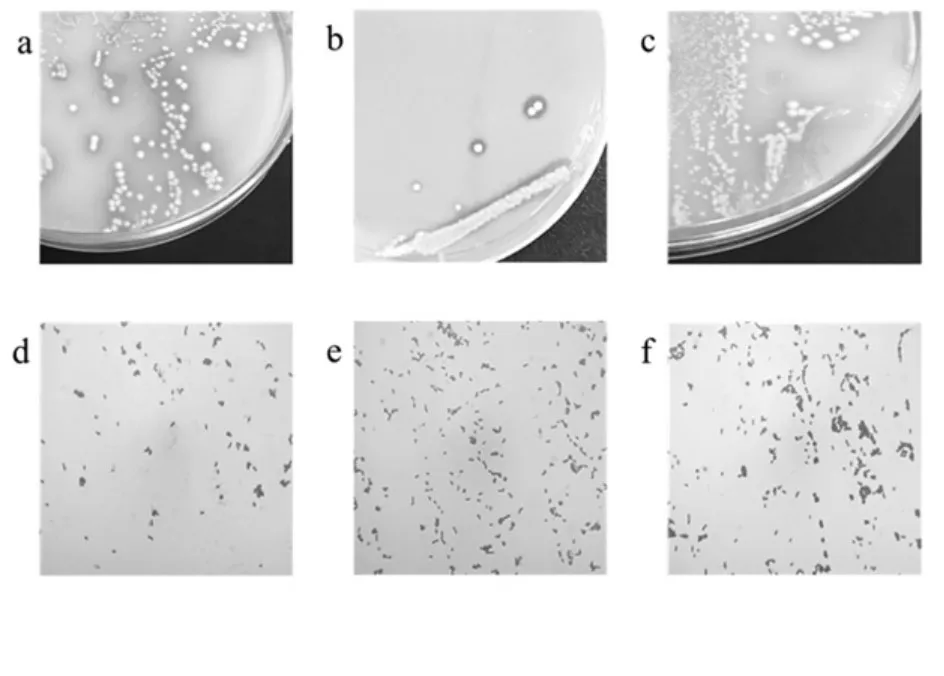
圖2 乳酸菌的菌落形態和細胞形態圖Fig.2 The colony morphology and cell morphology of lactic acid bacteria
圖a 和b 中菌落為圓形,邊緣整齊,菌落中心隆起,菌落為白色,不透明,菌落周圍有明顯透明圈,說明菌落周圍的碳酸鈣被分解;圖c 中菌落呈白色,不透明,邊緣整齊,較為扁平;圖d、e 和f 中菌體均為短桿狀,菌體顏色為紫色,說明其均為革蘭氏陽性桿菌。
2.3 乳酸菌鑒定結果
以提取的純化菌株基因組DNA 為模板,擴增產物瓊脂糖凝膠電泳圖如圖3 所示。

圖3 乳酸菌PCR 產物電泳圖Fig.3 PCR products electrophoretogram of inter-species primers of lactic acid bacteria
16S rDNA 擴增產物在 1 000 bp~1 500 bp 之間,產物的電泳條帶單一且清晰,滿足測序要求。
經過MRS 碳酸鈣平板劃線分離,共得到50 株疑似乳酸菌菌株。將50 株菌株的測序結果與GenBank中已知序列進行同源性比對,確定測序菌株的種屬信息,結果匯總于表1。

表1 乳酸菌純化菌株16S rDNA 鑒定結果Table 1 Results of lactic acid bacteria identification by 16S rRNA gene sequence analysis
50 株疑似乳酸菌菌株均為乳桿菌屬(Lactobacillus),其中 25 株為布氏乳桿菌(Lactobacillus buchneri);11 株植物乳桿菌(Lactobacillus plantarum);10 株干酪乳桿菌(Lactobacillus casei);3 株短乳桿菌(Lactobacillus breris);1 株戊糖乳桿菌(Lactobacillus pentosus)。本次分離鑒定得到的菌種在傳統發酵食品中均有過相關報道,如姜雪晶等利用布氏乳桿菌通過混合發酵,可有效改善了酸菜成品品質[26]。植物乳桿菌與人類的生活息息相關,常用于奶油、肉類及許多蔬菜發酵制品中,其能夠通過消化道進入腸道并定植從而發揮有益作用[27]。干酪乳桿菌能夠抑制和殺死食品中的許多腐敗菌和致病菌,并具有降膽固醇、抗腫瘤和提高人體抵抗力等益生功能[28]。由此可見,分離得到的菌種通過進一步的篩選試驗可作為發酵劑應用于發酵食品。
2.4 乳酸菌初篩
將上述50 株乳酸菌16S rDNA 序列與高通量測序得到的OTU 代表序列進行BLAST 比對。篩選與相對豐度排名前十的聚類單元代表序列匹配度為100%的菌株進行后續試驗,篩選結果見表2。

表2 乳酸菌初篩結果Table 2 Results of lactic acid bacteria preliminary screening
共篩選出8 株乳酸菌,其菌株編號分別為:TUSTL4、TUST-L26、TUST-L27、TUST-L36、TUST-L51、TUSTL123、TUST-L129 和 TUST-L138。這 8 株乳酸菌將作為后續乳酸菌復篩試驗的試驗菌株。
2.5 乳酸菌生長曲線
為了直觀反應乳酸菌純化菌株在培養基中的生長情況,對8 株乳酸菌進行了生長曲線測定。圖4 展示了8 株乳酸菌在MRS 肉湯中培養18 h 內OD600變化情況。
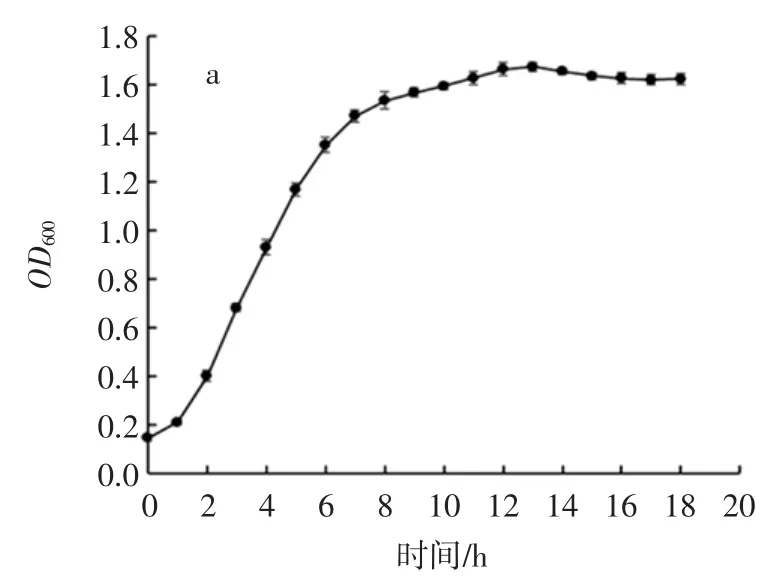
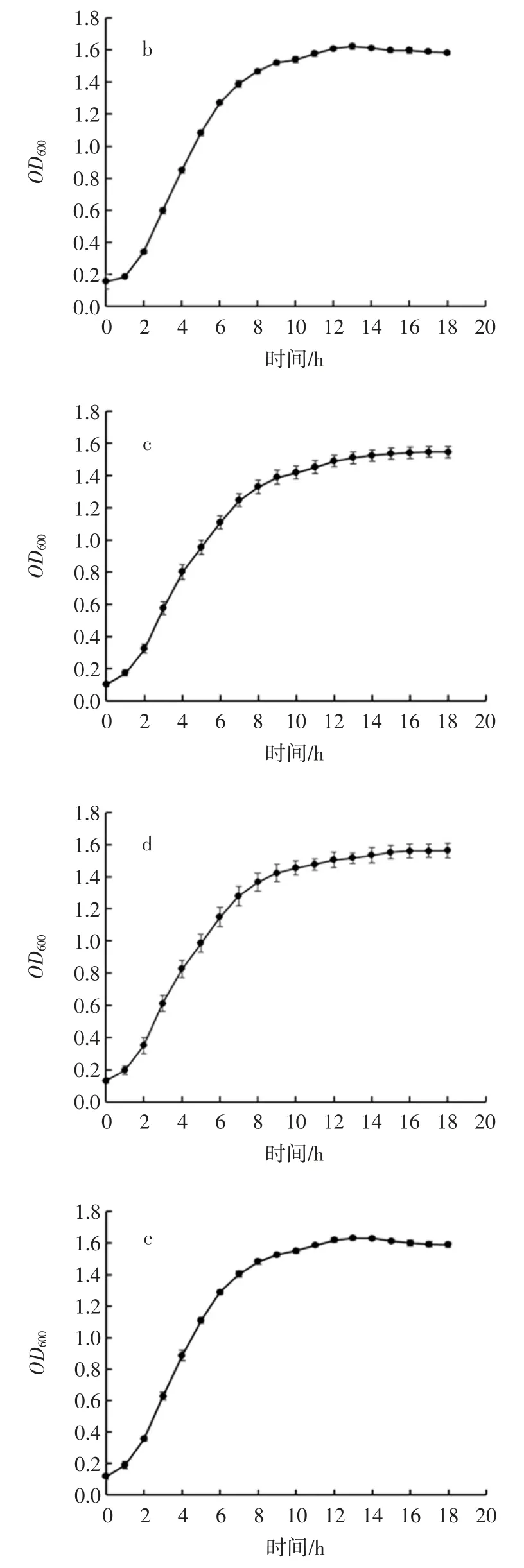
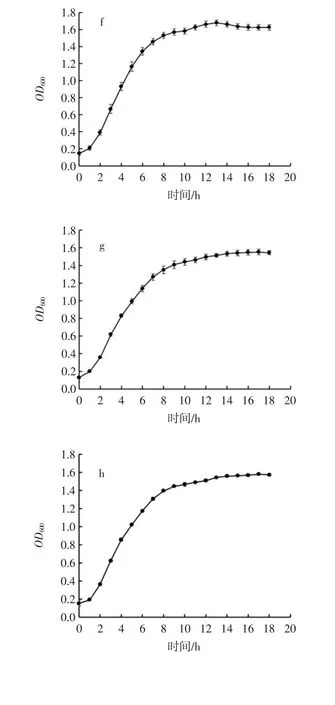
圖4 乳酸菌生長曲線Fig.4 The growth curve of lactic acid bacteria
從圖4 中可以看出,8 株乳酸菌均都在1 h 左右進入對數期,在8 h~10 h 時進入穩定期,穩定期的OD600值均在 1.4~1.6 之間。
2.6 乳酸菌復篩
2.6.1 乳酸菌產酸能力
乳酸菌發酵產生的有機酸能夠改善產品口感和風味,并能有效抑制耐酸性較差的微生物生長[29],預防發酵過程中雜菌污染。因此,對8 株乳酸菌產酸能力進行測定,結果匯總于表3。

表3 乳酸菌產酸能力Table 3 Acid production quantity of lactic acid bacteria
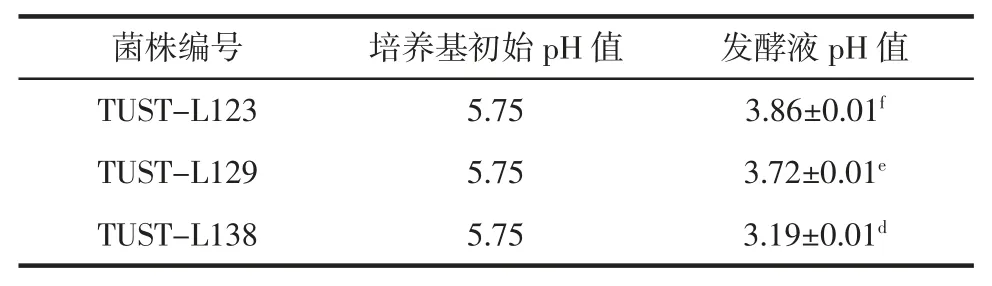
續表3 乳酸菌產酸能力Continue table 3 Acid production quantity of lactic acid bacteria
由表3 可見,TUST-L27 的產酸能力最強,TUSTL26、TUST-L4 和TUST-L51 次之,其余菌株的產酸能力較弱,發酵液pH 值均在3.00~4.00 之間。
2.6.2 乳酸菌胃酸及膽汁的耐受性
在益生菌開發和使用過程中,對其耐胃酸和耐膽鹽能力的篩選具有重要意義,是益生菌能否產生益生作用的前提[30]。為此對8 株乳酸菌進行了人工胃液及人工膽汁耐受試驗,試驗結果見表4。
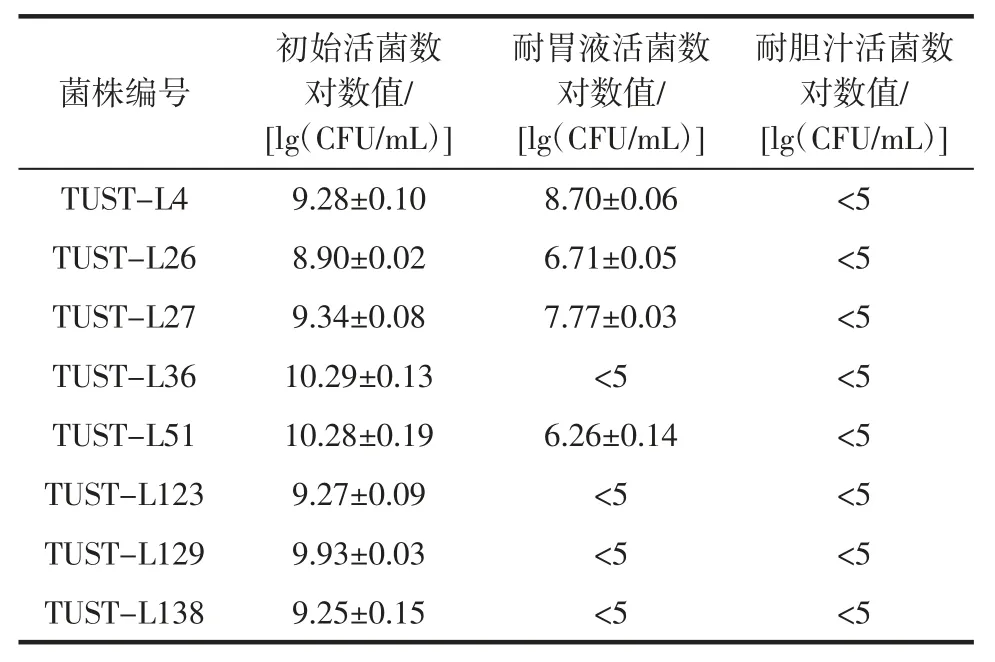
表4 乳酸菌耐受人工胃液和膽汁的能力Table 4 Assessment of viability of lactic acid bacteria after exposure to simulating gastric juice and bile salts
TUST-L51、TUST-L4、TUST-L26 和 TUST-L274株乳酸菌對人工胃液具有一定耐受性,在人工胃液中孵育1 h 后,其存活率分別為0.10%、2.48%、0.65%、2.71%,其中TUST-L4 和TUST-L27 的存活率相對較高,略高于范穎等報道的植物乳桿菌TD109 的耐人工胃液能力[31];其余4 株乳酸菌的存活率均小于0.01%。本研究中,不同乳酸菌在人工胃液中存活率差異較大,與Argyri 等[32]的研究結果相似。8 株乳酸菌在人工膽汁中孵育后,存活率均小于0.01%,說明其對人工膽汁中的耐受性較低,據Stuart 等[33]研究發現,乳酸菌的耐膽汁能力可通過馴化提高,在后續應用過程中可通過菌株馴化增強其耐膽汁能力。
2.7 乳酸菌發酵藍莓果汁的活細胞計數
考察乳酸菌在藍莓果汁中的生長能力。將8 株乳酸菌接入藍莓果汁中進行發酵,測定72 h 時各菌株的活細胞數量,其計數結果見表5。
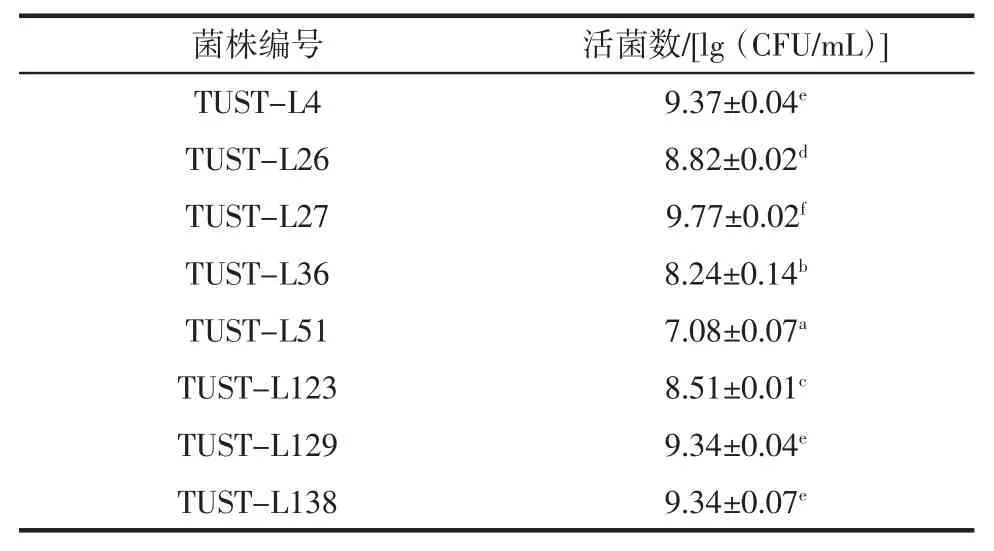
表5 乳酸菌發酵藍莓果汁的活細胞計數Table 5 Total lactic acid bacteria enumeration of fermented blueberry juice
發酵72 h 時,活菌數高于109CFU/mL 的菌株有TUST-L27、TUST-L4、TUST-L129 和 TUST-L138,其中,菌株 TUST-L27 最高;其余 4 株菌株(TUST-L123、TUST-L26、TUST-L36 和 TUST-L51) 的活菌數均低于109CFU/mL。
3 結論
本研究通過高通量測序技術對傳統藍莓發酵飲料樣品進行分析,發現乳桿菌屬(Lactobacillus)為主要發酵菌屬。進一步利用微生物方法對傳統發酵藍莓飲料中的乳酸菌進行分離,共得到50 株乳酸菌。利用分子生物學手段對純化菌株進行鑒定及初步篩選,有8株與傳統發酵藍莓飲料中相對豐度最高的乳酸菌聚類單元代表序列完全匹配。通過測定菌株生長曲線發現,8 株乳酸菌在MRS 培養基中均能在1 h 內進入對數期。TUST-L4、TUST-L26、TUST-L27 和 TUST-L514株乳酸菌具有較好的產酸能力和耐受性能力。TUSTL4、TUST-L27、TUST-L129 和 TUST-L1384 株乳酸菌在藍莓果汁發酵過程中具有較強的生長能力。綜上所述,注釋信息為植物乳桿菌的TUST-L4 和TUST-L27更適合應用于發酵藍莓果汁。

