環狀RNA PTENP1、HIPK3在甲胎蛋白陰性的肝細胞癌患者中的表達及意義
肝細胞癌患者約占原發性肝癌患者的85%,中國肝細胞癌發病和病死人數占世界總數的50%[1],及早診斷和準確評估病情是提高療效和改善預后的關鍵。目前臨床上主要依靠影像學和甲胎蛋白(AFP)對肝細胞癌進行診斷和病情評估,但約有30%~40%肝細胞癌患者的血清AFP處于正常水平(AFP<25 μg/L),這類患者稱之為AFP陰性肝細胞癌患者,因此,單獨檢測血清AFP存在較高的誤診及漏診率[2]。以往研究顯示,AFP陰性肝細胞癌患者的瘤體通常較小,易漏診[3]。因此,尋找可靠的診斷標志物一直是臨床研究的熱點。有研究發現環狀RNA(circRNA)PTENP1、HIPK3通過多種途徑參與了肝細胞癌的發生、進展[4-5],在肝細胞癌患者血清中異常表達,但其在AFP陰性肝細胞癌中的研究較少。本研究檢測了AFP陰性肝細胞癌患者、肝臟良性病變患者及健康人群血清中PTENP1、HIPK3表達情況,并初步探討了其在AFP陰性肝細胞癌診治中的價值。
1 對象與方法
1.1 研究對象
選擇2016年6月至2019年3月期間在西安大興醫院收治并確診的51例AFP陰性(AFP≤30 μg/L)肝細胞癌患者設為肝細胞癌組,38例肝臟良性病變患者設為良性病變組(肝細胞腺瘤8例,肝炎后肝硬化21例,先天性肝囊腫9例),另選擇35名同期健康體檢者設為對照組。肝細胞癌組和良性病變組均經肝穿刺活組織檢查或術中病理切片確診。納入標準:(1)精神正常,意識清楚,能配合完成本研究;(2)年齡>18歲。排除標準:(1)合并其他部位腫瘤者;(2)入組前曾接受放射治療、化學治療或其他抗腫瘤治療者;(3)精神疾病患者。所有入組者均知情同意,本研究經醫院醫學倫理委員會核準。收集研究對象的基本資料,包括年齡、性別、煙酒史及既往疾病史等,測量體質量、身高,計算體質指數(BMI)。3組的基本資料比較,差異無統計學意義,見表1。
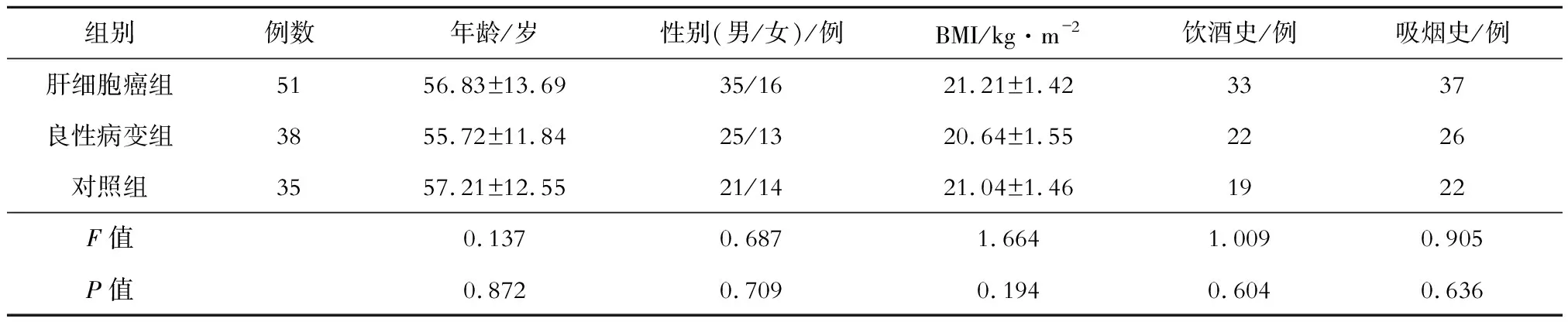
表1 3組的基本資料比較
1.2 方法
采集研究對象的清晨空腹外周靜脈血5 mL,3 000 r/min離心15 min,分離血清,置于-80 ℃冰箱保存待測。采用qRT-PCR法檢測3組的血清PTENP1、HIPK3表達水平:根據試劑盒要求和步驟提取血清總微RNA(miRNA)后,進行逆轉錄反應,以cDNA為模板,進行PCR擴增及熒光定量檢測。miRNA試劑盒購自天根生化科技(北京)有限公司,采用2-△△Ct法計算PTENP1、HIPK3相對表達水平,重復檢測3次,取平均值。
1.3 統計學處理
采用SPSS 22.0軟件進行統計學分析,計量資料組間比較采用t檢驗,多組間比較采用方差分析,計數資料采用卡方檢驗,二元Logistic回歸計算PTENP1、HIPK3預測AFP陰性肝細胞癌的OR和95%CI,受試者工作特征(ROC)曲線分析PTENP1、HIPK3鑒別AFP陰性肝細胞癌的價值,P<0.05為差異有統計學意義。
2 結果
2.1 3組的血清PTENP1、HIPK3表達水平比較
與對照組和良性病變組比較,肝細胞癌組的血清PTENP1表達水平明顯降低,而血清HIPK3表達水平明顯升高,差異均有統計學意義(P均<0.05);良性病變組的血清PTENP1、HIPK3表達水平與對照組比較,差異均無統計學意義(P均>0.05)。見表2。

表2 3組的血清PTENP1、HIPK3表達水平比較()
注:與對照組比較,aP<0.05;與良性病變組比較,bP<0.05
2.2 血清PTENP1、HIPK3對AFP陰性肝細胞癌的發病風險預測
校正表1中基本資料后,單因素和多因素分析顯示,血清PTENP1低表達水平和血清HIPK3高表達水平是AFP陰性肝細胞癌發病的獨立危險因素(P<0.05)。見表3。
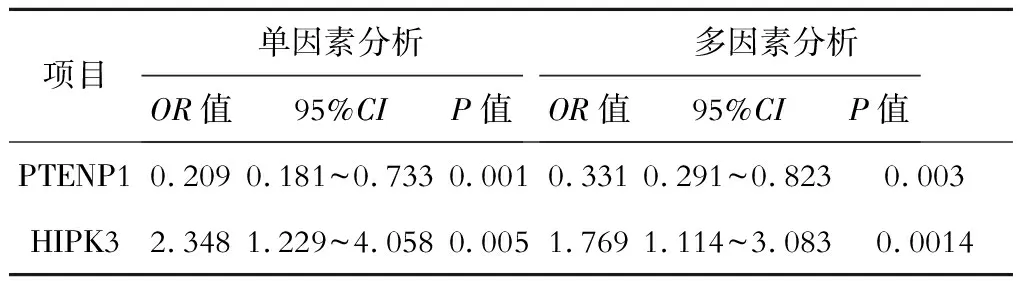
表3 血清PTENP1、HIPK3對AFP陰性肝細胞癌的發病風險預測
2.3 血清PTENP1、HIPK3對AFP陰性肝細胞癌患者的鑒別診斷效能分析
因變量為分類二變量,肝細胞癌組標記為1,對照組和良性病變組標記為0,自變量為血清PTENP1、HIPK3表達水平,ROC曲線分析提示,PTENP1、HIPK3聯合檢測的受試者工作特征曲線下面積(AUC)為0.951,大于PTENP1、HIPK3單獨檢測的0.756、0.855(Z=4.527,P=0.000;Z=3.561,P=0.000),且聯合檢測可提高診斷的靈敏度和特異度(P<0.05)。見圖1和表4。
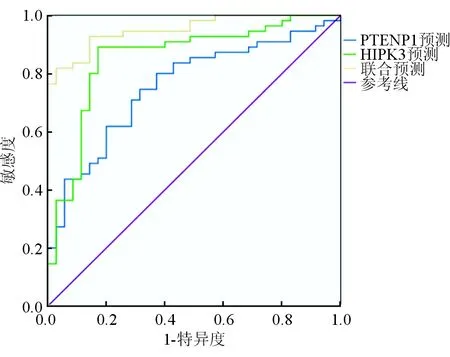
圖1 血清RNA PTENP1、HIPK3診斷AFP陰性肝細胞癌的ROC曲線
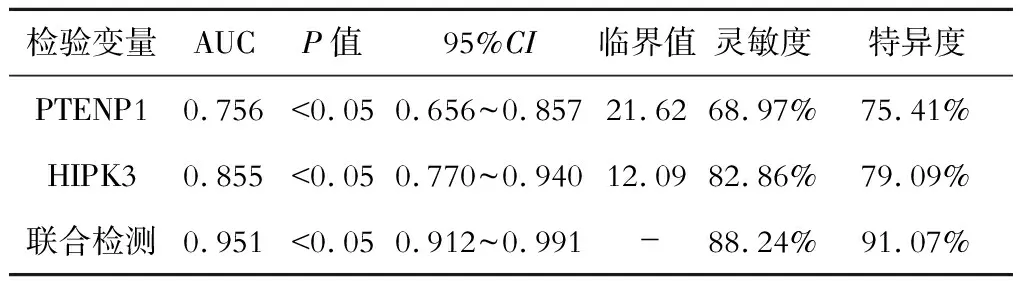
表4 血清PTENP1、HIPK3單獨及聯合鑒別診斷AFP陰性肝細胞癌的價值比較
3 討論
肝癌是消化系統常見的惡性腫瘤,具有發病率高、侵襲性強及預后較差等特點,因其發病隱匿,多數患者確診時已進展至中晚期,是威脅人類健康甚至生命安全的主要疾病[6-8]。肝細胞癌早期診斷標志物的相關研究較多[9-12],目前臨床上仍采用AFP結合影像學檢查的模式來診斷和評估病情。然而,對于肝細胞癌中30%~40%的AFP陰性患者,此模式局限性極大,易漏診、誤診,且不能準確判斷療效及預后[13]。因此,另尋找有價值的指標來提高AFP陰性肝細胞癌的診斷、療效監測及預后評估效能顯得尤為重要。
隨著分子基因研究領域的不斷進展,各種分子基因作為標志物在各種腫瘤中的異常表達陸續被發現。circRNA是長鏈非編碼RNA中的一種,具有種類豐富、進化保守及在機體中表達相對穩定等特性,具有作為標志物的潛質。以往研究發現,HIPK3異常表達與多種腫瘤的發生、發展密切相關,并參與了腫瘤化學治療耐藥及胃癌的發生、進展等生物調控[14];而PTENP1與miR-193a-3p相互作用,通過PTEN途徑抑制肝細胞癌的遷移和侵襲,有望成為肝細胞癌的生物標志物[15]。目前這兩種circRNA在AFP陰性肝細胞癌中的相關研究較少。本研究檢測了AFP陰性肝細胞癌患者、肝臟良性病變患者及健康人群的血清PTENP1、HIPK3表達情況,結果發現與對照組和良性病變組相比,肝細胞癌組的血清PTENP1表達水平明顯降低,而血清HIPK3表達水平明顯升高(P<0.05),良性病變組與對照組之間的差異則無統計學意義(P>0.05),這提示血清PTENP1、HIPK3在AFP陰性肝細胞癌患者中差異表達,具備作為此類患者鑒別診斷的有價值的指標。進一步分析發現,血清PTENP1低表達水平和血清HIPK3高表達水平是AFP陰性肝細胞癌發病的獨立危險因素(P<0.05),這提示血清PTENP1、HIPK3在AFP陰性肝細胞癌的發病風險評估中具有較高的潛在價值。此外,本研究應用ROC曲線分析了血清PTENP1、HIPK3對AFP陰性肝細胞癌的鑒別診斷效能,結果顯示血清PTENP1、HIPK3聯合檢測的AUC為0.951,大于PTENP1、HIPK3單獨檢測的AUC(0.756、0.855),聯合檢測的敏感度為88.24%,特異度為91.07%,均高于單獨檢測,這提示血清PTENP1、HIPK3檢測在AFP陰性肝細胞癌的鑒別診斷中均具有較高參考價值,且兩者聯合檢測可提高診斷的敏感度和特異度。
本研究尚存在不足:為單中心研究,納入病例可能會造成偏倚,影響結果的準確性;樣本例數偏少;未能就PTENP1、HIPK3對AFP陰性肝細胞癌的具體作用機制進行探討;未進行長時間隨訪不同的血清PTENP1、HIPK3表達水平對AFP陰性肝細胞癌患者預后的影響。這為后續研究指明了方向,為臨床靶向治療提供了參考。
綜上所述,AFP陰性肝細胞癌患者存在血清PTENP1、HIPK3異常表達,兩者聯合檢測具有較高的鑒別診斷和發病風險評估價值。

