基于一類雙官能團有機配體的稀土金屬中心配位聚合物的合成、結構及性質研究
王曉芳, 蔣志強, 田從學
(攀枝花學院 國家釩鈦檢測重點實驗室, 攀枝花 617000)
1 引 言
近年來,配位聚合物由于其引人入勝的拓撲結構和各種潛在的應用(如吸附、分離、催化、熒光和介電新特性等)倍受科學家們的關注,獲得了廣泛研究,得到了飛速的發展[1-5]. 由于構成配位聚合物材料的金屬離子和配體多種多樣,因此可以通過使用不同的金屬離子和配體構筑結構、功能多樣的配位聚合物. 這些配位聚合物在氣體分離和吸附以及催化方面都有應用,只是對于這些方面的研究仍為有限. 相比這些,稀土配位聚合物在光學方面的研究十分豐富. 有許多與稀土金屬配合物在光學方面的應用研究被報道[6-9]. 由于稀土金屬有機配合物的結構多樣以及可以調控的發光特性,稀土材料成為了光發射器組成材料的首選材料,并且目前已經有大量的通過稀土金屬有機配合物材料設計的光發射器被制造出來[10]. 鄭向軍課題組在2012年采用水熱法合成了Ln-Zn([H(H2O)8][Ln Zn4(imdc)4(Him)4] (Ln = La(1),Pr(2),Eu(3),Gd(4),Tb(5);H3imdc = 4,5-咪唑二羧酸;Him = 咪唑)五種三維結構配位聚合物,這五種有機配合物的晶體結構是同一構型,故可以用這五種物質相互摻雜來調節光的顏色,從而實現了白光的發射[11]. 蘇忠民課題組在2014年采用Eu和Tb兩種金屬相互摻雜,并改變這兩種金屬離子的比例,合成了不同比例的Eu和Tb離子配位聚合物材料,這些材料實現了從紅光到綠光的調節[12-13].
然而,值得注意的是,稀土金屬離子具有高的配位數而且變化幅度大,使得它與配體結合的空間結構很難控制和預測,并且不同的配位幾何構象之間的能差很小,因此在立體化學中優先選擇的構象并不明顯. 所以,稀土離子中心既有利于形成復雜的骨架結構,但以上因素的存在又使得合理地設計與合成稀土配位聚合物晶體材料面臨巨大挑戰.
本文選用一種同時含有間苯二甲酸和四氮唑有機片段的有機配體((5-四氮唑基-間苯二甲酸(H3TZI),(5-(4-(1H-四唑基)苯基)間苯二甲酸(H3TZPI))作為連接器,該類配體的間苯二甲酸的有機片段有助于實現理想籠狀結構的設計和調控[14];而包含四氮唑基團的5-取代的四唑類配體,其在配位聚合物的構筑中表現出諸多優勢:首先,其配位點豐富,具有多連接的配位能力;其次,其可以有效地形成金屬簇并且構筑類似于羧基基團構筑的剛性結構;另外,連接兩個片段的苯基則增加了配體的長度,有助于合成中骨架的延展[15]. 據我們所知,利用H3TZPI有機配體與稀土金屬中心配位的研究還十分有限.
2 實驗部分
2.1 試劑與儀器
實驗所需的試劑均為分析純,未經過進一步純化,實驗中所用的水溶劑為蒸餾水.所用儀器見表1.
表1 儀 器
2.2 配位聚合物的合成
2.2.1 配位聚合物1的合成 將硝酸鏑 (Dy(NO3)3,0.08 mmol, 0.03 g),H3TZI (0.04 mmol, 0.01 g),H2O 6 mL,乙醇 2 mL,混合后用2 mol/L HNO3調節pH~5,然后裝入25 mL帶有聚四氟乙烯內襯的不銹鋼反應釜中,在150 ℃加熱下反應72 h,得到塊狀晶體,過濾,用蒸餾水洗凈并在室溫下干燥. 對于Dy(TZI)(H2O)4·3H2O,產率為56% (以Dy計). 元素分析理論值(%),C9H17N4O11Dy:C, 22.82; H, 2.75; N, 11.83. 實驗值:C, 23.00; H, 2.50; N, 11.33. IR (KBr, cm-1): 3 398 (w), 1 634 (s), 1 542 (s), 1 493 (s), 1 458 (s), 1 394 (s), 1 110 (m), 1 046 (m), 790 (m), 755 (s), 714 (m).
2.2.2 配位聚合物2的合成 將硝酸鑭 (La(NO3)3,0.09 mmol, 0.03 g),H3TZPI (0.03 mmol, 0.01 g),草酸 (0.03 mmol, 0.003 g),溶解于混合溶劑(N,N-二乙基甲酰胺 4 mL,乙醇 1 mL)中,至澄清后裝入15 mL小瓶,常溫放置,緩慢揮發,反應約60 d,得到無色塊狀晶體,過濾,用蒸餾水洗凈并在室溫下干燥. 產率為50% (以La計). IR (KBr, cm-1): 3 299 (w), 1 557 (s), 1 443 (m), 1 408 (m), 1 373 (s), 1 315 (wk), 1 294 (wk), 1 259 (m), 1 187 (wk), 1 160 (wk), 1 011 (m), 925 (m), 854 (s), 784 (m).
3 結果與討論
3.1 X-射線晶體學衍射數據
化合物1和2的晶體衍射數據用石墨單色器進行收集,測試條件為Mo-K射線 (λ= 0.710 73 ?),室溫293 K.吸收校正在多重掃描技術下進行. 晶體結構均通過SHELXL-97軟件包以直接法解析,并運用最小二乘法F2精修. 所有非氫原子用各向異性溫度因子修正,碳原子采用理論加氫.相關晶體學數據及結構精修參數見表2,選擇性鍵長、鍵角列在表3中.
表2化合物1和2的晶體學數據a,b
Tab.2 Crystal data and structure refinement parameters for complexes 1 and 2a,b
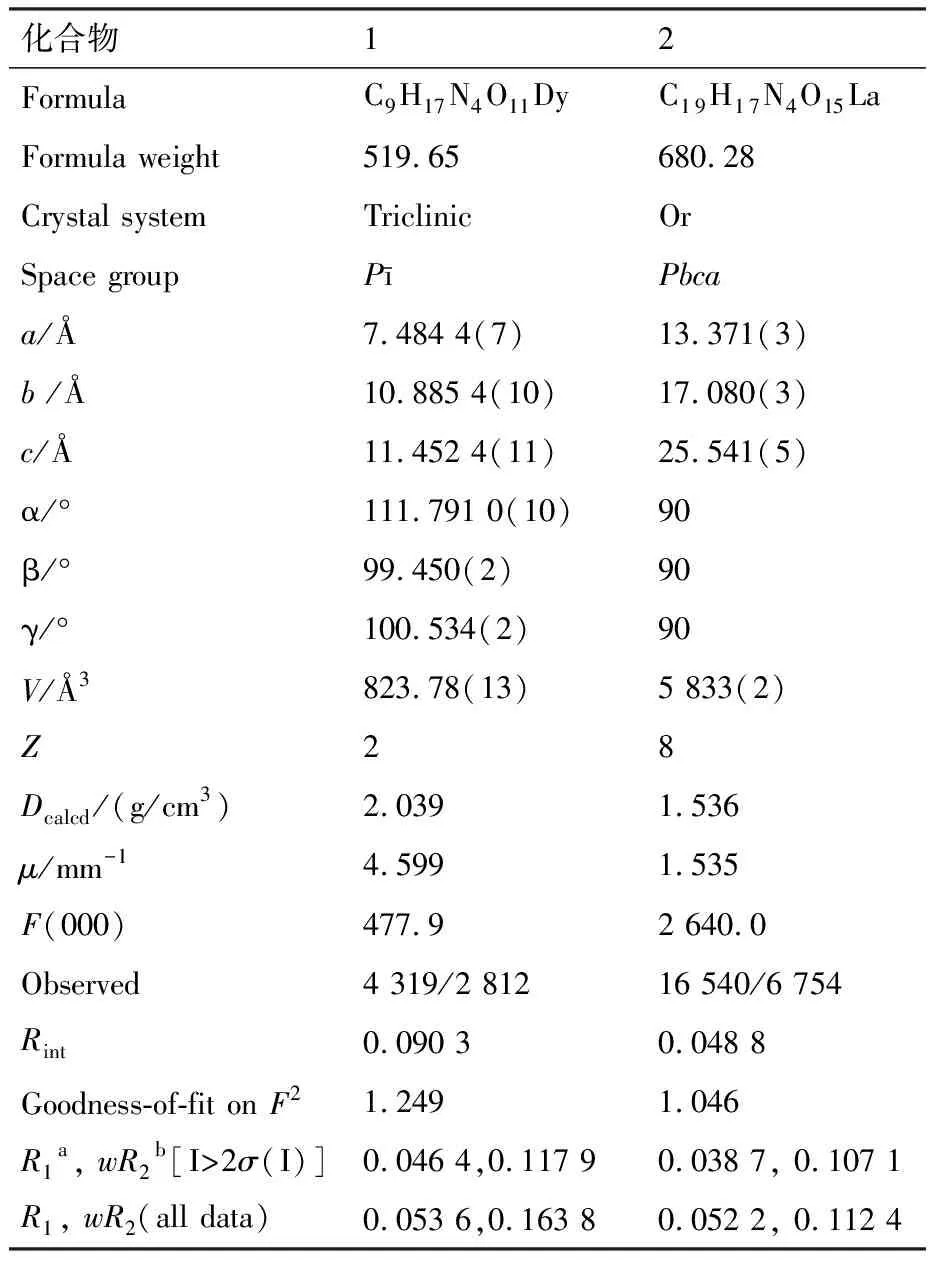
化合物12FormulaC9H17N4O11DyC19H17N4O15LaFormula weight519.65680.28Crystal systemTriclinicOrSpace groupPīPbcaa/?7.484 4(7)13.371(3)b /?10.885 4(10)17.080(3)c/?11.452 4(11)25.541(5)α/°111.791 0(10)90β/°99.450(2)90γ/°100.534(2)90V/?3823.78(13)5 833(2)Z28Dcalcd/(g/cm3)2.0391.536μ/mm-14.5991.535F(000)477.92 640.0Observed4 319/2 81216 540/6 754Rint0.090 30.048 8Goodness-of-fit on F21.2491.046R1a, wR2b [I>2σ(I)]0.046 4,0.117 90.038 7, 0.107 1R1, wR2 (all data)0.053 6,0.163 80.052 2, 0.112 4
aR1=∑||Fo|-|Fc||/∑|Fo|;bwR2=|∑w(|Fo|2-|Fc|2)|/∑|w(Fo2)2|1/2
3.2 化合物1和2的晶體結構描述
3.2.1 化合物1的晶體結構描述 單晶X-射線分析表明化合物1結晶于三斜晶系,Pī空間群.其不對稱單元包含一個Dy3+離子,一個TZI3-配體,五個終端配位水分子. 該結構中,配體連接三個金屬中心,配位方式可以描述為μ3-η1: η1: η1:η1: η0: η0: η0: η0(圖1a). 該結構中金屬中心為八配位,呈扭曲的雙帽三棱柱的配位幾何構型 (圖1b),是與來自于三個TZI3-配體的三個羧基氧原子、五個端基水氧配位(Dy-O鍵長范圍為從2.217(8)到2.500(8) ?, (附錄表3))配體連接金屬中心形成雙核基本單元 (圖1c),這些基本單元通過配體連接形成1D的雙鏈結構 (圖1d). 可以發現,在該結構中,四氮唑完全沒有參與配位,并且是以背離雙鏈內部的形式空在骨架中.

圖1 化合物1中 (a) Dy3+和TZI3-的配位方式; (b) Dy3+的雙帽三棱柱的幾何構型; (c) 雙核基本單元; (d) 一維雙鏈結構Fig.1 (a) The coordination modes of Dy3+ and TZI3-; (b) the tricapped double prismatic geometry of Dy3+; (c) the binuclear unit; (d) the double-stand 1D chain in complex 1
3.2.2 化合物2的晶體結構描述 單晶X-射線分析表明化合物2結晶于正交晶系,Pbca空間群.其不對稱單元包含元包含一個La3+離子,一個HTZPI2-配體,一個HC2O4-分子以及三個終端配位水分子. 該結構中,配體連接三個金屬中心,配位方式可以描述為μ3-η1: η1: η1:η2: η0: η0: η0: η0(圖2a). 金屬中心與九個氧原子配位,呈扭曲的三帽三棱柱的配位幾何構型(圖2b),氧原子來自于三個HTZPI2-配體的五個羧基氧原子、一個草酸氧原子以及三個端基水氧(La-O鍵長范圍為從2.464(4)到2.768(4) ? (表3)).配體連接金屬中心形成雙核基本單元 (圖2c),這些基本單元通過配體連接形成2D的層狀結構 (圖3d).類似的,可以發現,結構中四氮唑完全沒有參與配位,自由的空在骨架中.
3.3 熱重分析
我們測定了化合物1和2的TGA曲線以表征化合物的熱穩定性(圖3). 測試條件是在空氣氣氛下加熱,升溫速率為10 ℃/min. 分析結果表明:
化合物1在120 ℃之前失重12.93%對應于四個客體水分子的失去 (Calcd. 12.17%),120~200 ℃失重13.31%,可歸屬于配位水分子的移除 (Calcd. 12.93%),200 ℃之后骨架逐漸坍塌,最后殘余33.67%對應于DyO3/2(Calcd. 31.56%).
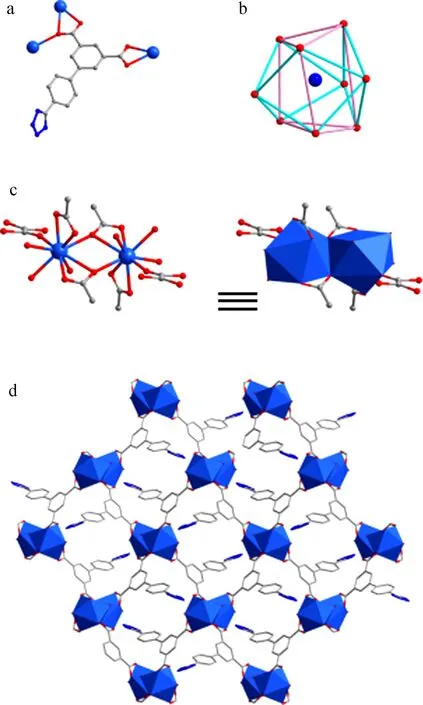
圖2 化合物2中 (a) 配體HTZPI2-的配位方式;(b) La3+的雙帽三棱柱的幾何結構;(c) 雙核基本單元;(d) 二維層狀結構Fig.2 (a) The coordination modes of HTZPI2-; (b) the tricapped double prismatic geometry of La3+; (c) the binuclear unit; (d) the 2D layer in complex 2
化合物2的TGA曲線表明化合物2在130 ℃之前失重11.96%,歸屬于客體失重 (Calcd. 10.23%), 130~500 ℃失重33.31%,可歸屬于配位水分子及草酸分子的移除 (Calcd. 34.63%),500 ℃之后骨架逐漸坍塌,最后殘余24.73 %對應于La2O3(Calcd. 25.14%).

圖3 化合物1和2的熱重分析曲線Fig.3 Thermogravimetric analysis of complexes 1 and 2
3.4 PXRD分析
經測試分析,化合物1和2的實驗粉末X-射線衍射和計算機的模擬譜圖 (圖4) 可以得出結論,所測量的PXRD圖的峰值位置與模擬的譜圖吻合,表明合成的材料有良好的純度,并且與所測量的單晶一致.
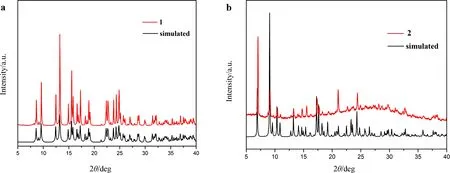
圖4 化合物1和2的X-射線粉末衍射譜圖(黑色: 理論模擬譜圖; 紅色: 實驗測試譜圖)Fig.4 The PXRD patterns of complexes 1 and 2 (black: simulated patterns; red: experimental patterns)
表3化合物1和2的選擇性鍵長(?)和鍵角(°)
Tab.3 Selected bond lengths(?) and selected bond angles(°) for complexes 1 and 2
化合物1對稱碼:#1-x+1, -y, -z+1; #2x,y-1,z; #3x,y+1,z
化合物2對稱碼:#1 -x+1/2,y-1/2,z; #2x-1/2, -y+1/2, -z+1; #3x+1/2, -y+1/2, -z+1; #4 -x+1/2,y+1/2,z
4 熒光性質分析
我們對化合物1和2的熒光性質進行了研究,其固體熒光光譜是在室溫條件下測定的. 為了作對比研究,我們在同樣條件下測定了配體的熒光. 配體H3TZI主要發射峰在372 nm (λex= 280 nm),配體H3TZPI主要發射峰在393 nm (λex= 280 nm),歸因于π* → π 或 π* → n 躍遷. 當配體與稀土中心配位,對于化合物1在377、550和578 nm處有熒光發射峰 (λex= 288 nm).其中377、 578 nm處為Dy3+的特征峰,可分別歸屬于6H15/2→4M21/2、4F9/2→6H15/2的電子躍遷. 除了出現Dy3+的特征發射峰外,550 nm處的特征峰認為是配體形成的共軛體系的特征峰,由于金屬與配體配位增加了體系的共軛程度,導致熒光發射峰相對于配體發生紅移. 對于化合物2,發射峰為404 nm (λex= 288 nm).相對于配體,化合物2的最大發射峰僅紅移11 nm. 眾所周知,La稀土中心的為符合洪特規則的全空(f0)電子構型,因此,化合物的熒光特征主要為配體的熒光. 而化合物熒光發射較配體之間的差異可歸因于配體與金屬中心配位所致(由于金屬中心配位對配體上羧基氫質子的取代會減小π* → π或 π* → n的躍遷能帶,從而會導致發射峰的紅移).
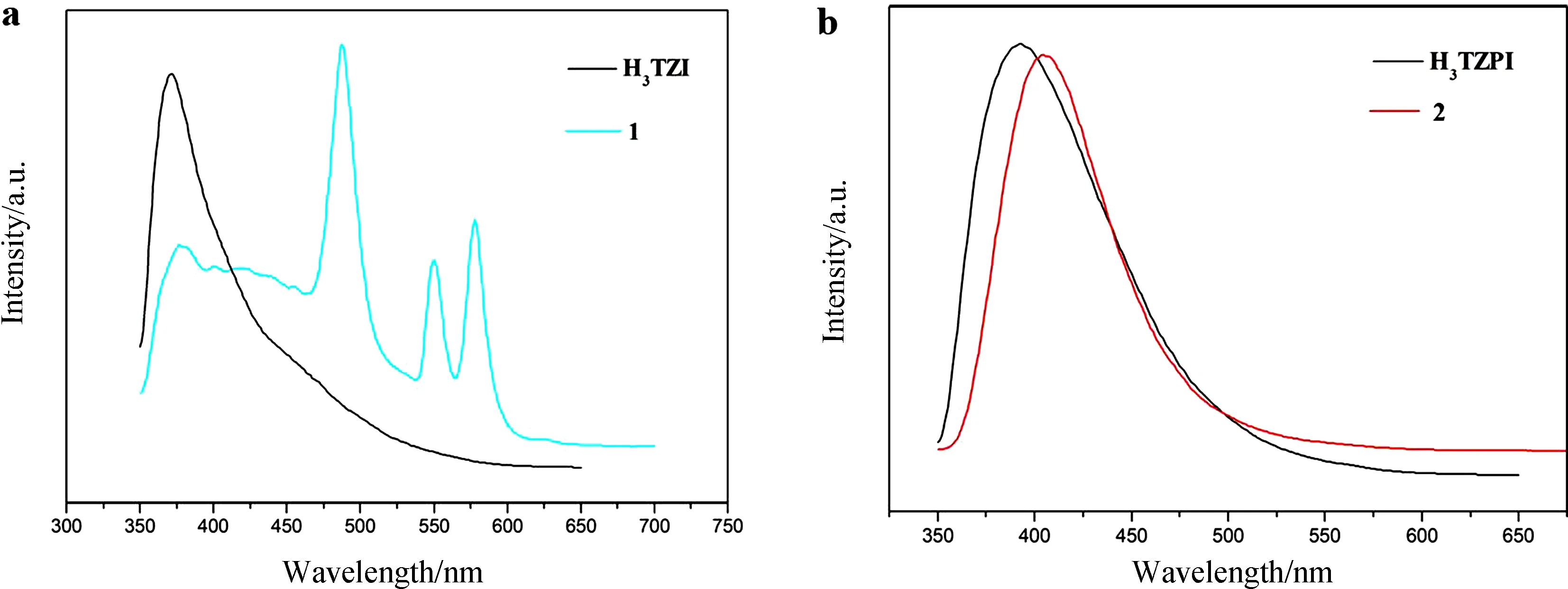
圖5 化合物1和2及有機配體的固態熒光發射光譜Fig.5 The solid state luminescent spectra of 1 and 2 and ligands at room temperature
5 結 論
本文采用溶劑熱合成法/溶劑緩慢揮發法合成了兩個稀土配位聚合物([Dy(TZI)(H2O)4]·4H2O (1), [La(HTZPI)(HC2O4)(H2O)3]·H2C2O4(2)). 單晶X-射線衍射分析表明化合物1與化合物2分別為包含雙核基本單元的一維雙鏈和二維層狀結構. 結構分析發現,我們選用的同時包含間苯二甲酸和四氮唑有機片段的雙官能團有機配體在與稀土金屬中心配位時四氮唑基團皆未參與配位,產生這種現象的可歸因于稀土金屬離子具有更易于與氧配位的親氧性. 這將對稀土配位聚合物的合成提供更多的實驗基礎和依據. 同時,對化合物的熱穩定性和熒光性質進行了研究.

