微生態制劑對草魚生產性能和腸道菌群的影響
王 穎,宋 明,張錦華,周秋白,張正洲,王自蕊,楊竹青
( 江西農業大學 動物科學技術學院,江西 南昌 330045 )
隨著水產養殖業養殖強度的日益增加和規模的逐漸擴大,抗生素濫用的情況也愈發嚴重,導致水源和水產品中抗生素殘留量大幅上升,最終危害人類健康。微生態制劑作為一種新型綠色的飼料添加劑,既能調節機體腸道微生態平衡、增強機體免疫力,促進生長,還可改善養殖水體的水質條件,使用方便、健康無藥物殘留[1-3],廣泛應用于水產業。對草魚(Ctenopharyngodonidellus)[4]、鯉魚(Cyprinuscarpio)[5]、中華鱉(Pelodiscussinensis)[6]、羅非魚(Oreochromis)[7]、凡納濱對蝦(Litopenaeusvannamei)[8]等的研究表明,添加微生態活菌制劑能提高水產動物的生產性能,但合理使用微生態制劑還缺乏足夠的科學依據,在飼料加工中添加微生態制劑經過膨化制粒后對草魚生產性能是否有影響還未見相關報道。
芽孢桿菌(Bacillus)、乳酸菌以及酵母菌是水產養殖中應用較為廣泛的3類菌種,對水生動物的生長發育等有著積極作用[9-11]。本試驗采用該3類菌種復配(8.0×109cfu/g),以麩皮為載體加工制成微生態制劑添加于草魚膨化飼料中喂養草魚,分析在飼料中添加微生態制劑對草魚生長、腸道消化酶、腸道組織學以及腸道菌群的變化情況,本研究還提出一個比較直觀,且簡單易行的“腸伸展率”指標來判別腸道的質量,旨在為草魚綠色飼料生產提供參考依據,促進草魚養殖提質增效。
1 材料與方法
1.1 材料
試驗分3組。第1組為基礎飼料(對照組),在滿足草魚基本營養需求的前提下,配制基礎飼料;試驗2、試驗3組分別向基礎飼料中添加0.5%、2%的微生態制劑。微生態制劑由枯草芽孢桿菌(Bacillussubtilis)、產朊假絲酵母菌(Candidautilis)和乳酸桿菌(Lactobacillus)復配,麩皮為載體,由廣東佛山市順德區健坤生物科技有限公司定制發酵加工而成;試驗飼料預混料的單體原料由江西大佑農生物科技有限公司提供;大宗飼料原料由江西格力特水產飼料有限公司提供;草魚膨化顆粒飼料由江西格力特水產飼料有限公司代加工,飼料粒徑2.0 mm。試驗飼料組成及營養水平見表1。
試驗用草魚購自九江市水產研究所,為長江四大家魚原種場原種草魚F1代。
1.2 方法
采用單因子試驗設計,篩選體質好、規格均勻的草魚1260尾[平均體質量為(110.23±0.43) g],隨機分為3組,每組6個平行,每個平行70尾,分別放入18個3.0 m×2.0 m×1.2 m加蓋網箱中。試驗于江西農業大學水產實驗基地進行,養殖水溫為自然水溫25~30 ℃。養殖時間為60 d。
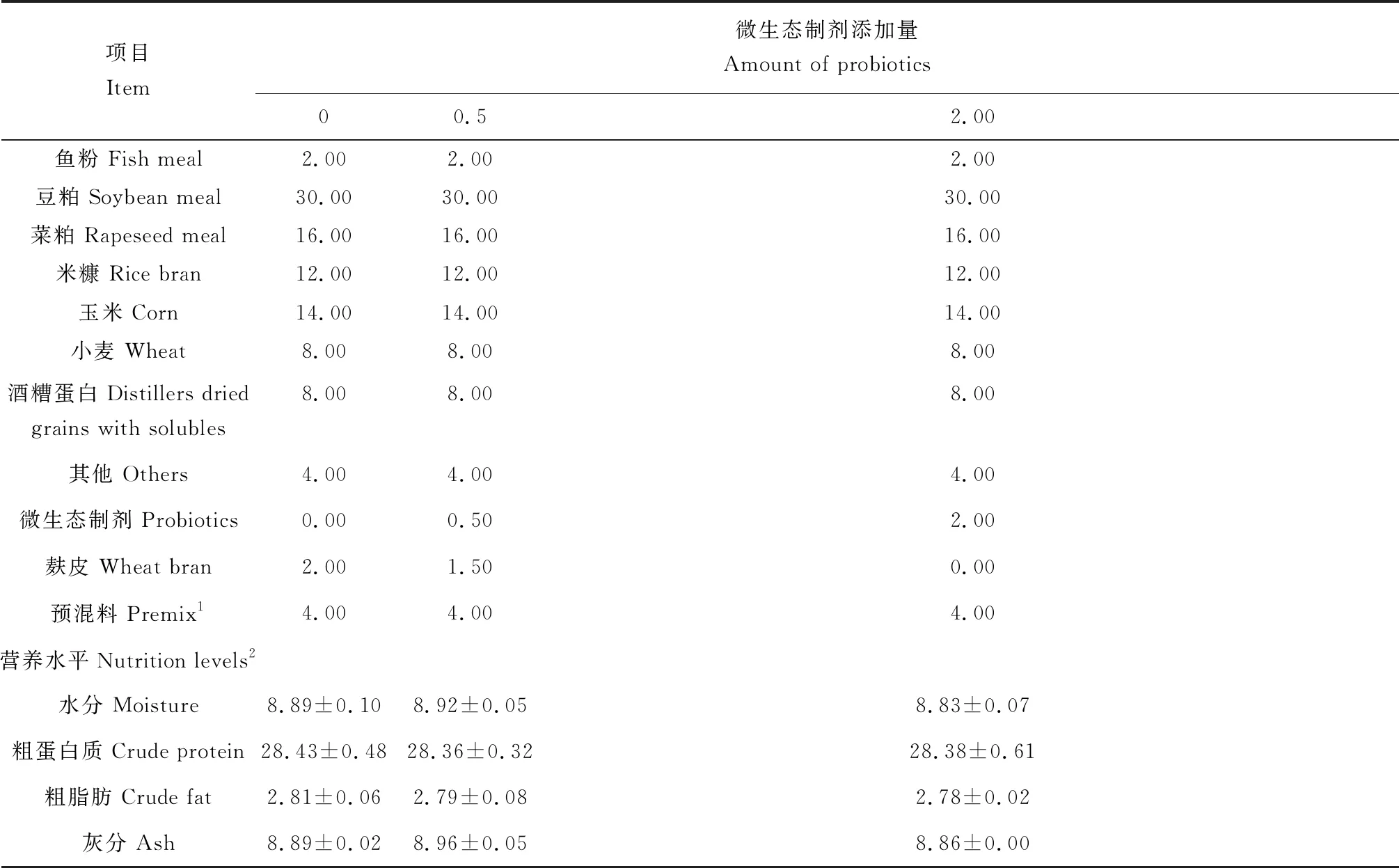
表1 試驗飼料組成及營養水平(風干基礎) %Tab.1 Ingredients and nutrient level in theexperiment diets (DM basis)
注: 1.預混料為每千克飼料提供The premix provides the followings per kg of diet: 維生素A VA 5 000 IU,維生素B1VB125 mg,維生素B2VB245 mg,維生素B6VB620 mg,維生素B12VB120.1 mg,維生素K3VK310 mg,維生素E VE 200 mg,維生素C VC 200 mg,維生素D3VD32 500 IU,肌醇 inositol 200 mg,泛酸鈣Calcium pantothenate 60 mg,煙酸 nicotinic acid 200 mg,葉酸 folic acid 10 mg,生物素 biotin 1.5 mg,氯化膽堿 choline chloride 2 500 mg,亞硒酸鈉NaSeO3·5H2O 0.3 mg,氯化鈷CoCl2·6H2O 0.4 mg,碘化鉀KI 0.8 mg,硫酸銅CuSO4·5H2O 10 mg,硫酸錳MnSO4·4H2O 20 mg,硫酸鋅ZnSO4·H2O 50 mg,硫酸亞鐵FeSO4·7H2O 150 mg,硫酸鎂MgSO4·7H2O 500 mg,氯化鈉NaCl 1 000 mg,亞磷酸鈣Ca(H2PO3)212 450 mg. 2.實測值 Measured values.
1.3 樣本采集與處理
養殖結束饑餓24 h,稱量各網箱內草魚總體質量,計算其終末均質量、質量增加率、特定生長率以及飼料系數等。從每個網箱中取6尾規格接近的試驗草魚,測定其體質量、去內臟質量、肝臟質量、內臟質量、體長、腸長等,計算其肥滿度、肝體比、臟體比、空殼率、腸伸展率等。其中3根腸道用于測定腸伸展率(腸伸展率是指腸道拉伸至斷裂為止的拉升長度與原始長度的比值。腸伸展率越大,表明腸道發育越好,肌層發達,損傷小)。另3根取其中腸做組織切片,蘇木精—伊紅染色,觀察其消化道形態結構。取草魚前腸、中腸、后腸測其相應的消化酶活性,采用南京建成生物工程研究所的試劑盒,按照相應的說明書進行測定。
計算公式如下:
特定生長率/%·d-1=(lnmt-lnm0)/t×100%
飼料系數=mf/(mt-m0)
質量增加率/%=(mt-m0)/m0×100%
肥滿度=100mt/Lt3
臟體比/%=mv/mt×100%
肝體比/%=mh/mt×100%
空殼率/%=(me/mt)×100%
腸伸展率=Le/LI
式中,mt為終末均質量(g);m0為初始均質量(g);mf為平均飼料攝入量(g);t為飼喂天數(d);mh為肝臟質量(g);mv為內臟質量(g);me為去內臟質量;Lt為體長(cm);Le為腸拉伸長;LI為初始腸長。
腸道菌群樣品的采集:投喂試驗飼料6 h后,無菌解剖草魚,取其腸道內容物于無菌的EP管中,放入液氮速凍,后轉入-80 ℃超低溫冰箱保存。之后每組選取部分樣本將其送至上海美吉生物醫藥科技有限公司進行細菌16S rDNA的V3+V4區高通量測序。
1.4 數據處理與分析
試驗數據用平均值±標準誤表示,用SPSS 17.0軟件進行統計分析,在單因素方差分析的基礎上,再用Duncan氏法進行多重比較,菌群分析采用t檢驗,顯著水平為0.05,極顯著水平為0.01。
高通量測序所獲得的原始數據經過數據過濾,濾除低質量的序列,整理后的剩余高質量的數據進行整理用于后期分析。采用Silva數據庫匹配細菌數據庫,區分樣本后,將樣品序列聚類,基于運算分類單元(OTU)在97%相似水平下分析樣品的測序深度。利用香農指數、辛普森指數公式計算細菌多樣性指數,利用Chao指數公式計算細菌豐富度指數。并在各個水平上統計每組樣品的群落組成和差異。通過PICRUSt對運算分類單元豐度表進行標準化,然后通過每個運算分類單元對應的green gene id,獲得運算分類單元對應的同源蛋白簇(COG)家族信息并計算各同源蛋白簇的豐度來進行16S功能預測。
2 結 果
2.1 微生態制劑對草魚生長性能的影響
3個試驗組草魚體質量、特定生長率、質量增加率以及空殼率隨著微生態制劑添加量的增加而增加,對照組與0.5%添加組差異不顯著(P>0.05),2%添加組顯著高于對照組和0.5%添加組(P<0.05);飼料系數隨著微生態制劑添加量的增加逐漸降低,2%添加組顯著低于對照組和0.5%添加組(P<0.05)。臟體比隨著微生態制劑添加量的增加逐漸降低,2%添加組顯著低于對照組(P<0.05),0.5%添加組與對照組、2%添加組差異不顯著(P>0.05)。肝體比各組之間差異不顯著(P>0.05)(表2)。
2.2 微生態制劑對草魚腸道消化酶活性的影響
0.5%添加組草魚前腸淀粉酶活性顯著高于對照組(P<0.05),2%添加組與對照組、0.5%添加組差異不顯著(P>0.05);中腸淀粉酶活性隨著微生態制劑添加量的增加逐漸升高,2%添加組顯著高于對照組、0.5%添加組(P<0.05),0.5%添加組顯著高于對照組(P<0.05)。3組間草魚后腸淀粉酶活性差異不顯著(P>0.05)。前腸脂肪酶活性差異不顯著(P>0.05);2%添加組草魚中腸脂肪酶活性顯著高于對照組和0.5%添加組(P<0.05),對照組和0.5%添加組之間差異不顯著(P>0.05);后腸脂肪酶活性逐漸升高,2%添加組顯著高于對照組(P<0.05),0.5%添加組高于對照組,但和對照組、2%添加組差異不顯著(P>0.05)。中腸脂肪酶活性最高,前后腸差異不顯著(P>0.05)(表3)。

表2 飼料中添加不同比例微生態制劑對草魚生長的影響(n=6)Tab.2 The effect of different proportions of dietary probiotics on growth in grass carp (n=6)
注:表中數值為平均值±標準誤,同一行中上標不同字母的平均值間差異顯著(P<0.05),下同.
Note:values are expressed as mean±SE; means with different superscripts in the same line are significantly different(P<0.05); et sequentia.

表3 飼料中添加不同比例微生態制劑對草魚腸道消化酶活性的影響(n=6)Tab.3 The effect of different proportions of dietary probiotics on activities of intestinal digestive enzymes in grass carp (n=6)
2.3 微生態制劑對草魚腸道組織結構的影響
微生態制劑對草魚中腸的組織結構影響較為明顯。隨著微生態制劑添加量的增加,草魚腸伸展率逐漸升高,2%添加組顯著高于對照組(P<0.05),0.5%添加組與對照組、2%添加組差異不顯著(P>0.05);草魚肌層厚度逐漸增加,2%添加組顯著高于對照組、0.5%添加組(P<0.05),對照組和0.5%添加組差異不顯著;絨毛長度逐漸增加,2%添加組顯著高于對照組(P<0.05),0.5%添加組與對照組、2%添加組差異不顯著(P>0.05)(表4)。

表4 飼料中添加微生態制劑對草魚腸道結構的影響(n=3)Tab.4 The effect of dietary probiotics on the intestinal structure in grass carp (n=3)
2.4 微生態制劑對草魚腸道微生物菌群多樣性的影響
香農曲線趨于平緩,覆蓋率為99.86%~99.92%,說明對草魚腸道樣本微生物群落的檢測比率接近飽和,目前的測序量能覆蓋樣本中的絕大部分物種。對照組、0.5%和2%添加組數據分別可劃分為259、395和428個運算分類單元。通過樣品測序序列計算各樣品的多樣性指數,其中2%添加組的香農指數最大,為2.7288,辛普森指數最小,為0.1675。對照組和0.5%添加組的香農指數和辛普森指數差異較小,多樣性相似;通過樣品測序序列計算各樣品的物種豐富度指數Chao,2%添加組的物種豐富度指數最大,物種豐富度最高。2%添加組香農指數、豐富度指數顯著高于對照組(P<0.05),0.5%添加組香農指數和豐富度指數與對照組、2%添加組差異都不顯著(P>0.05)。2%添加組辛普森指數顯著低于對照組(P<0.05),0.5%添加組與對照組、2%添加組差異不顯著(P>0.05)。2%添加組的運算分類單元、多樣性指數和豐富度指數均最高(表5)。

表5 各組微生物菌群和多樣性指數(n=3)Tab.5 Bacterial community and diversity index in each group (n=3)
從屬水平上進一步分析各個樣品中菌群多樣性的相互關系,選取3個試驗組中每組3個平行樣的并集,并構建維恩圖(圖1)。由圖1可知,3組共有屬的數量為134,分別占這三組腸道樣品全部屬的88.16%、70.53%、66.34%。對照組與0.5%添加組共有屬較少,而0.5%添加組和2%添加組中共有屬較多,分別占全部屬數量的22.63%和21.29%。對照組、0.5%添加組和2%添加組其特有屬數量分別為4、8和16。

圖1 3組腸道微生物在屬水平上維恩圖Fig.1 Horizontal Venn diagram of the intestinal microorganisms in the three groups at genus level
2.5 微生態制劑對草魚腸道微生物組成的影響
3種不同處理的草魚的9個腸道內含物樣品微生物菌落主要由17個門組成,合并小于1%的區域,在門水平上對每組樣品的菌群結構及分布進行統計分析,結果表明,對照組梭桿菌門和厚壁菌門優勢度較高分別占樣本所包含物種的總數目的63.56%、32.52%,此外變形菌門和擬桿菌門分別占1.83%、1.45%;0.5%添加組梭桿菌門和厚壁菌門優勢度也較高,分別占樣本所包含物種的61.82%、20.27%,此外變形菌門、放線菌門和綠彎菌門分別占9.75%、4.21%和2.66%;2%添加組厚壁菌門優勢度較高占樣本所包含物種的64.20%,此外變形菌門、梭桿菌門、放線菌門、藍藻菌門、擬桿菌門和綠彎菌門分別占9.94%、3.86%、6.14%、5.12%、4.55%和4.50%(圖2)。通過三元相圖(圖3)分析也可得出,不同組中微生物的組成和分布比例有所不同,2%添加組中厚壁菌門豐度較高,而對照組和0.5%添加組梭桿菌門較高。
從門水平上對其進行多組、兩組之間差異性檢驗分析,發現2%添加組與對照組在梭菌門、變形菌門、放線菌門、藍藻菌門、衣原體們、螺旋體菌門水平上差異顯著(P<0.05)(圖4)。對照組與0.5%添加組以及0.5%添加組與2%添加組在各門水平上差異不顯著(P>0.05),但在對照組和0.5%添加組之間,變形菌門、放線菌門和綠彎菌門呈現上升趨勢,厚壁菌門、擬桿菌門呈現下降趨勢;在0.5%添加組和2%添加組之間,厚壁菌門豐度明顯升高,由20.27%升至64.20%,而梭桿菌門豐度明顯降低,由61.82%降至3.86%。此外,變形菌門豐度基本不變,藍藻菌門、放線菌門、擬桿菌門和綠彎菌門呈現上升趨勢。以上結果表明,在飼料中添加微生態制劑會改變草魚腸道菌群組成,2%添加組在厚壁菌門、擬桿菌門、放線菌門和綠彎菌門上豐度高于對照組,在梭桿菌門豐度低于對照組;0.5%添加組在變形菌門、放線菌門和綠彎菌門上豐度高于對照組,在厚壁菌門和擬桿菌門豐度低于對照組。
在屬水平上對3組樣品的菌群結構及分布進行統計分析,合并小于1%的區域(圖5),結果表明,對照組和0.5%添加組的優勢菌屬均為梭桿菌門的鯨桿菌屬(Cetobacterium),對應的屬各占各組全部屬的63.31%、61.79%,2%添加組優勢菌屬為厚壁菌門的Paeniclostridium、Erysipelatoclostridium分別占該組全部屬的25.07%、13.74%,而在2%添加組中鯨桿菌屬的豐度較低,僅為3.83%,在對照組和0.5%添加組中Paeniclostridium、Erysipelatoclostridium的占也比較低。厚壁菌門的Dielma在對照組和0.5%添加組分別占9.04%、11.93%而在2%添加組中僅占2.64%,可進一步得出2%添加組的優勢菌屬與對照組和0.5%添加組存在明顯差異。此外,在0.5%添加組和2%添加組中存在大量未分類的其他物種。

圖2 三組腸道微生物在門水平上的豐度Fig.2 Abundance of intestinal microflora in three groups at phylum level

圖3 三組腸道微生物門水平上三元相圖Fig.3 Ternary phase diagrams of intestinal microflora in three groups at the phylum level 圖中相同顏色的圓形代表來自于同一個門,圓形面積的大小代表豐度的大小. The circle of the same color represents the same phylum, and the size of the circle represents the size of abundance.

圖4 對照組和2%添加組腸道微生物門水平上差異檢驗Fig.4 The difference test of intestinal microbial between the control group and the 2% group at phylum level 縱坐標表示不同分類水平下的物種名,橫坐標表示該樣本的某一物種豐度的百分數數值,不同顏色表示不同分組. *,P<0.05,**, P<0.01,***, P<0.001,下同. The ordinate is the species name at different levels of classification, the abscissa is the percent of a species abundance of the sample, and different colors show different groups. *, P<0.05, **, P<0.01, ***, P<0.001, et sequentia.
再從屬水平上采用student′st檢驗對3組樣本兩兩進行差異分析,結果表明,對照組和2%添加組在鯨桿菌屬、藍藻細菌(norank_c__Cyanobacteria)、norank_f__MNG7、分支桿菌(Mycobacterium)、甲基孢囊菌科細菌(unclassified_f__Methylocystaceae)之間差異顯著(P<0.05)(圖6)。0.5%添加組和2%添加組在Romboutsia、藍藻細菌(norank_c__Cyanobacteria)之間差異顯著(P<0.05)(圖7)。而對照組和0.5%添加組之間在各屬水平上差異不顯著(P>0.05),但各屬比例有所差異。2%的微生態制劑使草魚腸道優勢菌屬直接發生改變。
并且隨著微生態制劑含量的升高,草魚腸道本身的優勢菌屬——鯨桿菌屬豐度先升高,后大幅下降。
2.6 微生態制劑對草魚腸道微生物代謝功能的影響
所有樣本主要的同源蛋白簇功能有:氨基酸轉運與代謝、轉錄、能量生產與轉換、碳水化合物轉運與代謝、無機離子轉運和代謝、膜轉運、復制、修復、輔酶轉運和代謝、脂質轉運與代謝、蛋白質轉換、核苷酸轉運和代謝、防御機制、細胞過程和信號傳導等功能。該結果表明,草魚樣本中的微生物代謝功能非常豐富(圖8)。
與物種組成相比,所有組樣本的同源蛋白簇功能組成較為相似,涉及代謝、轉運以及細胞修復、信號傳導的功能均有一定程度的變化。由圖9可知,隨著微生態制劑含量的升高,無機離子轉運和代謝、碳水化合物轉運與代謝、能量生產與轉換、氨基酸轉運與代謝、膜轉運、復制、修復、翻譯等功能的豐度越來越高,說明微生態制劑可增加腸道微生物的各種功能的豐度,調節草魚的生長代謝。
3 討 論
3.1 微生態制劑對草魚生產性能的影響
本試驗結果表明,在飼料中添加不同比例的微生態制劑對草魚的生產性能有一定的促進作用,特定生長率、質量增加率以及空殼率均隨微生態制劑添加量的增加逐漸升高,0.5%添加組和2%添加組質量增加率分別比對照組提高了13.34%和31.73%。Wang[12]在飼料中添加3種微生態制劑,促進了草魚魚種的生長,提高了魚種成活率。陳玉春等[13]在飼料中添加微生態制劑對草魚魚種有明顯的促生長作用,并提高魚種成活率。尹惠霖[14]在飼料中添加納豆芽孢桿菌(B.natto),促進草魚幼魚生長,提高草魚幼魚的特定生長率和質量增加率,增加營養物質的吸收利用,并在一定范圍內,隨納豆芽孢桿菌添加量增加,草魚幼魚質量增加率和特定生長率呈上升趨勢。此外,在軍曹魚(Rachycentroncanadum)[15]、仿刺參(Apostichopusjaponicus)[16]、大菱鲆(Scophthalmusmaximus)[17]、淇河鯽(Carassiusauratus)[18]、建鯉(Cyprinuscarpiovar.jian)[19]等其他水產動物的研究上也得出相似結果。但本試驗從添加微生態制劑后再膨化制粒的角度去探索其對草魚生長的影響,仍能得到與直接添加微生態制劑相似的結果。推測微生態制劑的菌種不是影響草魚生長的唯一原因,菌種在飼料中所產生的發酵產物可能也是影響草魚生長的關鍵原因。

圖5 3組腸道微生物在屬水平上的豐度Fig.5 Abundance of intestinal flora in 3 groups at genus level

圖6 對照組和2%添加組腸道微生物屬水平上差異檢驗Fig.6 The difference test of intestinal microorganism between the control group and the 2% group at genus level

圖7 0.5%添加組和2%添加組腸道微生物在屬水平上差異檢驗Fig.7 The difference test of intestinal microorganism between the 0.5% and 2% groups at genus level

圖8 3組腸道微生物同源蛋白簇功能分類預測Fig.8 The functional classification prediction of homologous protein clusters of intestinal microorganisms in the three groups

圖9 3組腸道微生物同源蛋白簇功能分類柱狀圖Fig.9 The functional classification histogram of homologous protein clusters of intestinal microorganisms in the three groups
3.2 微生態制劑對草魚腸道消化酶以及腸道組織的影響
本試驗中,隨著微生態制劑添加量的增加,腸伸展率、中腸肌層厚度和絨毛長度逐漸增加。腸道是魚類重要的消化器官,腸道組織學和形態學指數在確定攝食與同化之間功能關系中具有重要作用,腸道絨毛結構的完整與攝食相關[20]。腸絨毛形態變化直接影響絨毛的表面積和對營養物質的吸收能力[21],說明添加微生態制劑擴大草魚營養物質吸收的有效區域,增加草魚對營養的吸收效率。黃燦等[22]報道,枯草芽孢桿菌可修復嗜水氣單胞菌(Aeromonashydrophila)造成的草魚腸黏膜結構損傷,對維持腸道的正常形態與功能起到了重要的作用。邱燕[23]研究表明,在草魚飼料中添加枯草芽孢桿菌或酵母培養物,隨添加量的增加,各試驗組肌層厚度、微絨毛高度、淀粉酶均高于基礎組,這與本試驗結果一致。本研究引入一個評價腸道質量的新指標——腸伸展率,添加微生態制劑后腸伸展率有顯著的提高,表明草魚消化道結構更好、厚薄更均勻,腸道更富有彈性,有利于蠕動,進而促進飼料在草魚腸道中消化吸收。而腸道中消化酶的活性直接關系著動物的消化吸收能力,間接影響了動物的生長。據報道,枯草芽孢桿菌可產生許多消化酶,對多種營養物質的消化均有促進作用[24]。王子彥等[25]用芽孢桿菌飼喂鯉魚后,腸道淀粉酶活性比對照組提高3.82倍。本試驗中草魚中腸淀粉酶和脂肪酶活力隨微生態制劑添加量的增加而升高,2%添加組顯著高于對照組和0.5%添加組,這與已有報道一致。
3.3 微生態制劑對草魚腸道菌群的影響
腸道內正常的微生物菌群能促進魚類消化吸收營養物質,調節魚類的免疫功能,維持其機體的健康[26]。機體的飲食影響魚類腸道菌群的數目和種類[27]。在本試驗中2%添加組草魚腸道菌群豐富度指數、多樣性指數以及菌群結構與對照組間存在較大差異。0.5%添加組與對照組差異不顯著,其原因可能是0.5%添加量較少,還不足以引起顯著差異。維恩圖顯示,3組草魚腸道的核心菌群相似。對照組主要由梭桿菌門、厚壁菌門、變形菌門以及擬桿菌門組成,與Wu等[28]研究結果類似。本試驗中,隨著微生態制劑添加量的增加,梭桿菌門豐度持續下降。Koren等[29]認為,梭桿菌門中的一些成員與低密度脂蛋白膽固醇和總膽固醇的含量呈正相關。推測梭桿菌門相對豐度的降低可能會促進機體對脂類的利用。在屬水平上,2%添加組鯨桿菌屬豐度由63.31%降至3.83%,李東亮[30]研究得出,易感染腎致病菌草魚腸道鯨桿菌屬豐度增加,這為本研究提供了一個反證,提示鯨桿菌屬相對豐度的降低可提高機體免疫力。本研究中,草魚腸道菌群中厚壁菌門的豐度先降后升,但其中的Paeniclostridium和Erysipelatoclostridium豐度大幅上升。這兩個菌屬在水產上的相關研究較少,Nguyen等[31]發現,PaeniclostridiumsordelliiATCC9714T能產丁酸。而Erysipelotrichaceae通常被認為是丁酸的產生菌[32]。在飼料中添加適宜量的丁酸鈉可提高草魚特定生長率和飼料效率,使腸道更健康,各種消化酶活力升高[33]。丁酸也可為機體上皮生長提供能量,改善腸道屏障功能以及保護機體免患結腸疾病[34]。Pozuelo等[32]發現,健康人腸道內Erysipelotrichaceae相對豐度更高,而腸道易激綜合征患者Erysipelotrichaceae相對豐度減少,可能是由其產生的丁酸含量較少,使上皮的通透性增加。Woting[35]研究表明,Clostridiumramosum的存在與小腸葡萄糖和脂肪轉運蛋白相關,且可以改善飼料效率。Yutin等[36]將Clostridiumramosum重新分類到Erysipelotrichaceae科的Erysipelatclostridium屬。因此,可推斷在本研究中Erysipelatoclostridium相對豐度的增加可能在機體體內丁酸的產生以及葡萄糖和脂肪的轉運中起重要作用。2%添加組藍藻細菌和分支桿菌的相對豐度較高,藍藻細菌可在一定程度上改善水質,而分支桿菌和鯨桿菌屬其具體作用機理在水生動物研究較少,有待進一步研究。本試驗使用的復合微生態制劑中的3種菌在草魚腸道菌群中均未發現,或豐度較低,推測可能是飼料膨化過程中菌均被殺死,主要起作用的是菌的發酵產物。在本試驗中,隨微生態制劑添加量增加,“能量產生與轉換”、“碳水化合物運輸與代謝”、“氨基酸運輸與代謝”、“脂質運輸與代謝”等相關代謝功能的豐度有所增加。Wu等[37]研究結果也顯示,在正常草魚腸道菌群中上述功能相關的腸道微生物占主導地位,并且草魚的腸道微生物群在碳水化合物的轉化和發酵中起作用,可為機體及其自身提供能量。推測本試驗微生態制劑的添加可使草魚腸道菌群朝更健康的方向變化。

