一種用于活體細胞Zn2+檢測的高靈敏度比例計量熒光探針
張長麗 徐 鑒 黃 芳 趙海榮 陳昌云
(南京曉莊學院環境科學學院,新型功能材料南京市重點實驗室,南京 211171)
過渡金屬在生命體系中是一個矛盾的存在,一方面這些金屬在許多蛋白質中擔任必需的輔因子,另一方面游離的或者水合形式的過渡金屬具有一定毒性。 Zn2+是許多參與水解和基團轉移反應酶中的一種輔因子[1],也為蛋白質(如轉錄因子)提供了結構穩定性[2-3],并被認為是神經傳遞中的一種信號分子。然而,不穩定的Zn2+會干擾許多生物過程,如缺血或癲癇發作后以及頭部損傷后鋅穩態被破壞, 不穩定的Zn2+增加從而導致神經損傷[4-6],由鋅攝入不足是導致腸肢端皮炎重要原因[7],因此在生命體系中Zn2+被要求維持在低游離濃度[8-9]。 為了更好地了解鋅在生物系統中的作用, 實時監測細胞中不穩定鋅的分布和濃度是非常重要的。
光致發光技術以其高靈敏度、高選擇性、高時空分辨率被認為是檢測Zn2+最有效的手段之一。 在過去的幾十年中, 人們報道了大量具有不同特性的光致發光Zn2+探針[10-16]。 尤其是比例計量型探針,可以避免光散射和探針濃度引起的偽影, 達到定量檢測活體樣本中Zn2+目的。 廣泛應用于構建比例計量探針的機理有光誘導電荷轉移(PCT)[17-25]、熒光共振能量轉移(FRET)[26-35]、金屬離子配位抑制激發態分子內質子轉移(ESIPT)[36-43]、熒光團互變異構[44-45]和雙熒光團方法[46-48]等。
除了上述一些機理以外, 利用Zn2+配位誘導芳環共面化引起分子熒光光譜的改變這一特性[49]設計Zn2+比例計量型熒光探針。 基于此機理,Ajayaghosh等構建了含5,5′-二乙烯基-2,2′-聯吡啶衍生物的比例Zn2+探針, 該探針與Zn2+配位后,Zn2+誘導的芳香共平面增加了熒光分子的共軛, 導致發射波長紅移[50]。 該小組后來又設計多個Zn2+探針,進一步證明了這一結論[51-53]。 然而,基于這一機制構造的比例計量型探針很少[54-56]。我們課題組基于此機理設計Zn2+熒光探針PBITA,其分子模型研究表明,Zn2+誘導的PBITA 的紅光發射位移可能與2-PBI 的2 個異芳族平面的共面有關[57]。 雖然PBITA 的發射在與Zn2+結合后呈現38 nm 的紅移, 但Zn2+誘導的熒光增強完全覆蓋了自由PBITA 的發射。 因此,PBITA 更被認為是一個增強型的Zn2+探針。 為了進一步證實該機理,將探針PBITA 進行修飾,研制了新的Zn2+探針DBITA。在DBITA 中,在PBI 的5-位修飾供電子基N,N-二甲基, 通過分子內電荷轉移促進探針的ICT(intramolecular charge transfer,ICT)效 應,一 方 面 使新Zn2+/探針配合物發生較長波長的紅移,探針在與Zn2+結合前后顯示出2 個發射帶, 并成為一個真正的比例計量型Zn2+探針;另一方面,提高探針本身的發光效率,有利于DBITA 在生物體系中的應用。
1 實驗部分
1.1 試劑與儀器
KNO3,Zn(NO3)2,HEPES(2-(4-(2-hydroxyethyl)-1-piperazinyl)ethanesulfonic acid),EGTA(ethylenebis(oxyethylenenitrilo)tetraacetic acid),2,6-二羥甲基吡啶和5-氯-2-硝基苯胺購自Alfa 公司。 常用藥品(如鄰苯二胺,三乙胺,對甲基苯磺酰氯,酸堿,常規溶劑如甲醇、氯仿、乙酸乙酯、乙醇等)均為市售國產試劑,使用前未做進一步純化。 乙腈分別經P2O5回流,無水K2CO3干燥,CaH2回流蒸出后使用。 N,N-二甲基甲酰胺(DMF)、二氯甲烷和二甲基亞砜(DMSO)經CaH2干燥后減壓蒸出使用。 四氫呋喃(THF)經鈉/二苯甲酮回流蒸出后使用。 二(2-甲基吡啶基)胺(BPA)參照文獻方法合成[58]。 光譜性質測試中, 所用溶劑如DMSO 等為光譜純試劑, 購自Aldrich 公司, 水為MILIPORE 處理過的超純水。 電噴霧質譜用LCQ 電噴霧質譜儀(ESMS,Finnigan)測定,并用ISOPRO 3.0程序模擬其同位素分布模式。1H,13C NMR 在Bruker DRX-500 或Bruker DRX-300 核磁儀上用標準脈沖序列測定(298 K)。 紫外光譜在Perkin-Elmer Lambda 35 紫外可見光譜儀上測定。 熒光光譜在AMINCO Bowman series 2 發光光譜儀上測定。 pH值用PHS-3 精密pH 計記錄。 紫外和熒光光譜數據用Origin 軟件包處理。
1.2 DBITA 的合成
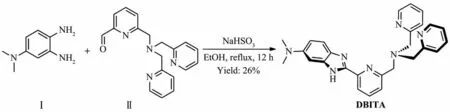
Scheme 1 DBITA 合成線路圖Scheme 1 Synthesis of DBITA
化合物Ⅰ(4-N,N-二甲氨基-鄰苯二胺)和Ⅱ(二(2-吡啶甲基)(6-醛基-2-吡啶甲基)胺)根據文獻方法合成[59-60]。DBITA 合成路線[61]見Scheme 1。在裝有攪拌磁子、 恒壓滴液漏斗和回流冷凝管的100 mL 三頸燒瓶中加入新制的化合物Ⅰ(0.070 mg 0.46 mmol)、NaHSO3(0.053 g,0.51 mmol)和乙醇(5 mL)。 加熱至回流, 用恒壓滴液漏斗緩慢向反應液中滴加化合物Ⅱ(0.156 mg,0.46 mmol) 的乙醇溶液10 mL,20 min 滴加完畢。 保持回流反應12 h 后停止。 減壓蒸餾去除溶劑,將所得油狀物用CH2Cl2和水溶解,分出有機相, 飽和NaHCO3溶液和飽和食鹽水洗滌, 無水MgSO4干燥,濾除干燥劑,減壓蒸餾去除溶劑,柱層析分離(中性氧化鋁,CH2Cl2~CH2Cl2/MeOH(200∶1,V/V))得產品0.054 g,收率26%。 棕黃色油狀物,Rf=0.3(VEtOAc∶VMeOH=20∶1)。1H NMR (500 MHz,CDCl3):δ 3.04(s,6H,-N(CH3)2),3.91(s,2H,-CH2),4.03(s,4H,-CH2),6.93(s,1H,BI-H),7.23(t,2H,J=6.0,Py-H),7.29(d,2H,J=7.5,Py-H),7.66~7.78(m,6H,BI-H and Py-H),8.20(d,1H,J=7.5,BI-H),8.65 (d,2H,J=4.5,Py-H)。13C NMR(125 MHz,CDCl3):δ 41.56,58.23,59.90,93.99,111.16,118.95,119.22,119.79,122.17,122.99,123.43,135.77,136.52,137.17,148.09,148.57,148.74,149.69,156.93,158.98。MALDI-TOF(m/z):Calcd. 450.23,Found:450.4 for [M+H]+。 Element analysis(%) Calcd. for C27H27N7:C,72.14;H,6.05;N,21.81。 Found:C,72.89;H,6.54;N,21.03。
1.3 DBITA 的光譜性質測試
DBITA 用 光 譜 純DMSO 配 成1.18 mmol·L-1。取DBITA 的DMSO 儲備液加入到100 mL 的容量瓶中并用HEPES 緩沖溶液(50 mmol·L-1,100 mmol·L-1KNO3,pH=7.2) 和DMSO 定容, 配成濃度為10 μmol·L-1的(VDMSO∶VHEPES=1∶99)溶液,然后分別進行紫外以及熒光光譜的測量。
DBITA 的Zn2+紫外和熒光滴定實驗在DMSOH2O(1∶99,V/V,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH=7.20)體系中進行,紫外滴定參比溶液為空白的DMSO-H2O 溶液。 向3 mL DBITA(10 μmol·L-1)的配體溶液中分別加入不同體積的Zn(NO3)2水溶液(1.2 mmol·L-1),每次加25 μL,充分混勻后進行紫外和熒光測試。
1.4 金屬離子選擇性實驗
金屬離子選擇性及Zn2+與堿金屬、 堿土金屬的競爭性實驗都在上述DMSO-H2O 體系中進行。 實驗中,向3 mL DBITA(10 μmol·L-1)的溶液中加入25 μL 濃度為1.2 mmol·L-1的金屬離子水溶液,使金屬離子濃度與DBITA 濃度相等, 充分混勻后進行測試。 競爭性實驗中,向3 mL DBITA(10 μmol·L-1)的溶液中加入25 μL 濃度為1.2 mol·L-1的Zn(NO3)2水溶液,充分混勻后記錄光譜。然后再向此溶液中分別加30 μL 濃度為1.0 mol·L-1的堿金屬或堿土金屬離子水溶液, 使溶液中堿金屬或堿土金屬的量達到10 mmol·L-1,即Zn2+濃度的1 000 倍,充分混勻后再次記錄光譜。
1.5 DBITA 對生物細胞內Zn2+的造影研究
造影實驗中所用HeLa 細胞在含有10%胚胎小 牛 血清(FBS,Invitrogen),青 霉 素(100 units·mL-1)和鏈霉素(100 mg·mL-1)的Dulbecco′s Modified Eagle Medium(DMEM,Invitrogen)中,37 ℃,5%(V/V) CO2的培養箱中培養。 為了便于成像,HeLa 細胞培養在玻璃底的培養皿中。當去掉介質后,細胞用不含金屬的PBS 溶液(10 mmol·L-1)洗滌3 次,加入10 μmol·L-1DBITA 溶液在室溫下孵育20 min;吸掉溶液,再用PBS 溶液洗滌3 次, 然后用激光共聚焦熒光顯微鏡進行觀測。 細胞外源鋅的引入通過在Zn(NO3)2/巰基吡啶硫酮(pyrithone(2-mercaptopyidine-N-oxide))的1∶1 的PBS 溶液(5 μmol·L-1)中孵育10 min,用激光共聚焦熒光顯微鏡進行造影。 造影完畢后, 細胞再用0.05 mmol·L-1TPEN(由TPEN 的濃儲液通過PBS 稀釋得到)處理20 min 后,再用PBS 洗滌一次后造影。
成像在Olympus FV10-ASW 激光共聚焦熒光顯微鏡上完成。 激發波長為488 nm,觀察波長在500~540 nm 和580~620 nm 之間。
2 結果與討論
2.1 DBITA 的光譜性質
為了便于比較, 將PBITA 與DBITA 光譜數據列于表S1。 紫外光譜實驗結果表明,與PBITA 相比,由于在PBI 的5 位引入供電子基團N,N-二甲基,使DBITA 的最大吸收峰紅移到340 nm (ε=1.3×104L·mol-1·cm-1),最大吸收峰歸屬于DBITA 中苯并咪唑部分π-π*躍遷引起的。 熒光光譜中(圖S1),DBITA在水溶液中的熒光較強,熒光強度大約是PBITA 的3.5 倍,量子產率為0.18。 其最大激發和發射波長為362 和534 nm, 與PBITA 相比分別紅移了約26 和149 nm。與PBITA 類似,在DBITA 的激發以及發射光譜中除了最大激發和發射峰外,在392 和493 nm處還同時存在一個激發和發射峰。以上結果表明,具有供電子作用的N,N-二甲基的引入,使DBITA 的紫外及發射波長發生了紅移,量子產率大幅度提高,達到了預期的設計目的。
2.2 DBITA 熒光對pH 的依賴性
由于生命體內pH 值不會偏離中性太多, 因此發射光譜在近中性條件下不隨pH 變化是Zn2+熒光探針能夠在生命體系的應用必要條件之一。 檢測了pH 值對DBITA 熒光發射譜的影響。 實驗在含5 μmol·L-1DBITA 的DMSO/H2O(1∶99,V/V)溶液中進行,溶液pH 值用5 mol·L-1的HNO3及5 mol·L-1的NaOH 水溶液調節。
如圖S2 所示,PBITA 的熒光發射光譜受pH 的影響較大。而DBITA 中5 位N 原子、吡啶以及苯并咪唑的N 原子在酸性條件下都容易發生質子化,減弱了分子的ICT 效應, 所以DBITA 的熒光發射強度在pH 2~6 的范圍內隨酸性的增強熒光強度逐漸減弱, 并且在pH 2~3 時發射波長會發生一定的紅移。 在pH 6~10 的范圍內DBITA 的熒光強度受pH變化較小,都體現出較強的熒光。這說明螯合團與熒光團之間的PET 效應很弱, 即使BPA 單元中的N原子質子化以后也不會使探針的熒光有明顯增強,這與N,N-二甲基的推電子效應密切相關。 隨pH 增大到10 以上,探針的熒光強度有所減弱,這可能是由于咪唑脫質子后使5 位的N,N-二甲基到咪唑以及吡啶的推拉電子效應(ICT 效應)減弱導致的。結果表明,DBITA 則在近中性條件下熒光強度較為穩定,具有適合應用于生命體內造影的潛力。
2.3 DBITA 與Zn2+的熒光響應行為
在HEPES 溶液中的Zn2+熒光滴定表明(圖1a),隨著Zn2+的加入,DBITA 在493 和534 nm 處的發射峰逐漸降低,同時在609 nm 處出現一個新的發射峰,并且熒光強度逐漸增強。當c(Zn2+)total/c(DBITA)的值達到1 后,2 個發射峰的熒光強度不再發生改變,這說明Zn2+與DBITA 的方式結合為1∶1 結合。 用609和534 nm 處的熒光強度的比值(F609/F534)與 c(Zn2+)/c(DBITA)作圖可知,F609/F534比值與c(Zn2+)total呈線性關系(圖1a 插圖),比值大約從0.3 增強到1.5。 由于DBITA 存在由從推電子基團N,N-二甲基到咪唑以及吡啶單元的ICT 效應, 當DBITA 與Zn2+結合后,PBI 與Zn2+配位后不僅會使芳環平面性增強, 共軛程度增加,波長發生紅移,而且由于Zn2+的拉電子作用導致拉電子單元拉電子能力增強, 使分子內的ICT 效應進一步增強,同樣也會導致波長發生紅移。這兩種效應的疊加是導致DBITA 與Zn2+結合后波長紅移要比PBITA 與Zn2+結合所導致的波長紅移大的主要原因。 另外,在含EGTA/Zn2+的HEPES 緩沖溶液中對DBITA 的Zn2+配合物的Kd值進行了測定。實驗結果表明DBITA 與Zn2+的結合能力要遠高于PBITA(表S1),配合物DBITA/Zn2+的Kd值為0.16 pmol·L-1(圖S3),原因可能是因為N,N-二甲基較強的供電子能力增強了咪唑N 原子的配位能力。
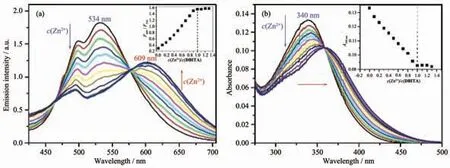
圖1 Zn2+對10 μmol·L-1 DBITA 在HEPES 溶液中的熒光(a)和紫外(b)滴定光譜圖; (a) 中插圖為F609/F543 滴定曲線,(b)中插圖為340 nm 波長處的紫外滴定曲線Fig.1 (a) Emission spectra of 10 μmol·L-1 DBITA (λex, 362 nm) in HEPES buffer solution; Inset in the titration profile based on the emission ratio at 609 and 543 nm, F609/F543; (b) Absorption spectra of 10 μmol·L-1 DBITA in HEPES buffer when titrated with Zn2+(1.2 mmol·L-1) solution; Inset in Zn2+titration profile according to the absorbance at 340 nm
2.4 DBITA 與Zn2+結合方式
2.4.1 紫外滴定實驗
進一步采用紫外滴定、 核磁滴定和質譜研究了DBITA 與Zn2+結合方式。 紫外滴定實驗結果表明當在DBITA 的HEPES 溶液中滴加Zn2+以后,DBITA在340 nm 處的吸收峰逐漸降低,并伴隨有明顯的紅移,移動到364 nm 處(圖1b)。 PBITA 吸收峰的紅移是Zn2+誘導的芳環共面導致的結果。 而對于DBITA來說, 由于同時存在Zn2+誘導的芳環共面以及ICT效應的改變,使其吸收峰的紅移距離(Δλabs=24 nm)要大于PBITA(Δλabs=15 nm)。 DBITA 的滴定光譜中在359 nm 處出現了等消光點,這表示自由配體已完全轉化為一種鋅的配合物。用340 nm 處的吸收峰吸收強度對c(Zn2+)total/c(DBITA)作圖可知:當c(Zn2+)total/c(DBITA)≤1 時,紫外吸光度的降低與總鋅濃度呈線性關系;而當c(Zn2+)total/c(DBITA)>1 時,更高的總鋅濃度也不會再使光譜發生明顯的改變。 這表明所生成的Zn2+配合物的化學計量比為1∶1。
2.4.2 核磁滴定實驗
Zn2+對DBITA 的核磁滴定實驗在CD3OD 體系中進行。 由圖2 可以看出,隨著Zn2+的加入,除了自由的DBITA 的信號峰外(圖2c), 還出現了另一組Zn2+/DBITA 配合物的信號峰。當c(Zn2+)total/c(DBITA)=0.5 時,兩組信號峰的強度基本相同(圖2b);然而其比值達到1 時, 則只能觀察到Zn2+配合物的信號峰(圖2a)。 加入更多的Zn2+也不會引起核磁譜的進一步變化。這同樣也證實了DBITA 與Zn2+的結合比為1∶1。
詳細的信號峰的指認結果列于表S2。 Zn2+的配位使得探針的所有質子的信號都發生了改變, 這表明吡啶環上的氮原子以及咪唑環的氮原子都可能參與了Zn2+的直接配位。 因此, 我們推測Zn2+與DBITA 的結合模式可能如圖2d 所示。
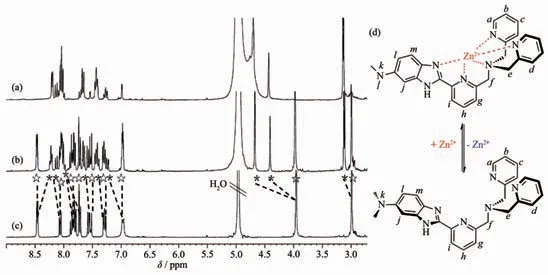
圖2 Zn2+對DBITA 在CD3OD 中的1H 核磁滴定譜圖Fig.2 1H NMR spectra of DBITA in CD3OD upon Zn2+titration
2.4.3 配合物質譜研究
DBITA 的Zn2+配合物的電噴霧質譜結果如圖3所示,在DBITA/Zn2+配合物的正離子電噴霧質譜中可以觀察到2 個峰:256.83 處較低的峰為配合物的二價峰[DBITA+Zn2+]2+;512.33 處的峰可以歸屬為配合物的一價峰[DBITA+Zn2+-H]+。 這些離子峰的同位素分布方式與ISOPRO 3.0 模擬的結果基本一致,這進一步表明了DBITA 與Zn2+結合方式為1∶1 結合。
2.5 DBITA 與Zn2+結合的選擇性研究
對金屬離子的選擇性熒光響應是一個合格探針所必須具有的重要的光學性質。 因此我們在DMSOH2O 體系中對DBITA 與Zn2+結合的選擇性進行了研究。實驗結果(圖4a)表明,在生命體相關的金屬離子存在下,DBITA 對Zn2+和Cd2+有較好的選擇性比例計量響應(F609/F534),其它的金屬陽離子,如等濃度的Cu2+,Hg2+,Pb2+,CO2+,Ni2+、Mn2+、Fe2+以及1 000 倍的堿金屬和堿土金屬離子等都對配體熒光強度無明顯影響。 由各種離子存在下DBITA 在609 和534 nm 處的熒光強度的比值可知,Zn2+和Cd2+在2 個波長下強度的比值都在1.6 左右, 而其余金屬離子的比值都在0.3 左右,因此DBITA 對Zn2+的比例計量行為不會受到除Cd2+外其他金屬離子的干擾。 以上結果表明,DBITA 與大部分Zn2+探針類似, 難以排除處同一族性質極為相似的Cd2+對其增強以及比例計量行為的干擾。 但由于正常細胞或生命體內沒有Cd2+,所以不會對Zn2+的響應帶來干擾。
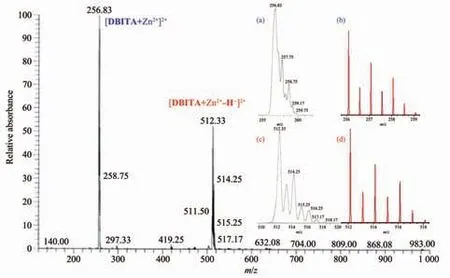
圖3 DBITA/Zn2+配合物的正離子電噴霧質譜Fig.3 MS spectrum of DBITA/Zn2+complex
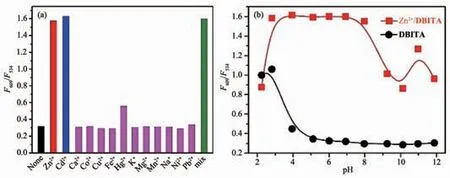
圖4 (a) HEPES 緩沖溶液中(50 mmol·L-1, pH 7.2, 0.1 mol·L-1 KNO3), 金屬離子對10 μmol·L-1 DBITA 的熒光選擇性響應柱狀圖(F609/F534, λex=362 nm); 其中Zn2+、Cd2+、Cu2+、Ni2+、Co2+、Hg2+、Pb2+、Mn2+、Fe2+的含量與DBITA含量相同, Na+、K+、Ca2+、Mg2+的含量是DBITA 含量的1000 倍; (b) DBITA 及其Zn2+配合物(10 μmol·L-1)在609 和543 nm 波長下的熒光強度比值隨pH 變化曲線Fig.4 (a) Emission ratio at 609 and 543 nm of DBITA (10 μmol·L-1, λex=362 nm) induced by different metal cations in HEPES buffer (50 mmol·L-1, pH 7.2, 0.1 mol·L-1 KNO3); Final concentration for Zn2+, Cd2+, Cu2+, Fe2+, Hg2+, Mn2+,Ni2+, Hg2+, Co2+and Pb2+is 10 μmol·L-1, for Na+, K+, Ca2+, and Mg2+is 0.10 mmol·L-1, (b) Emission ratio F609/F534 of DBITA and DBITA/Zn2+complex (10 μmol·L-1) in aqueous solutions with different pH values, λex=362 nm
進一步研究了pH 變化對DBITA 的Zn2+比例計量響應行為的影響。 如圖4b 所示,DBITA 在609和534 nm 處的熒光強度的比值只在酸性條件下才會增強, 而在pH≥5 的范圍內基本保持不變,而DBITA/Zn2+配合物的比值在pH 4~8 之間穩定,因此可以認為DBITA 對Zn2+比例計量行為不受pH干擾,非常適合于生理環境下Zn2+的響應。
2.6 DBITA 對細胞內Zn2+的造影性能研究
由于DBITA 對Zn2+發射波長紅移的比例計量響應, 因此我們利用雙通道對DBITA 在細胞內的Zn2+造影能力進行了研究。 雖然DBITA 的最大激發波長在362 nm, 但從激發光譜上可以看出在405 nm 處仍可以對DBITA 進行激發。 因此,為了減小紫外激發對細胞帶來的光損傷, 我們選用了波長相對較長的405 nm 作為激發波長對DBITA 進行了造影研究。 根據圖S4 可知,用405 nm 作為激發波長對DBITA 的金屬離子選擇性以及Zn2+的比例計量響應幾乎沒有影響, 在熒光增強的作用上Zn2+導致的熒光增強4.95 倍增加到6.35 倍,而Cd2+導致的熒光增強5.12 倍增加到5.31 倍。
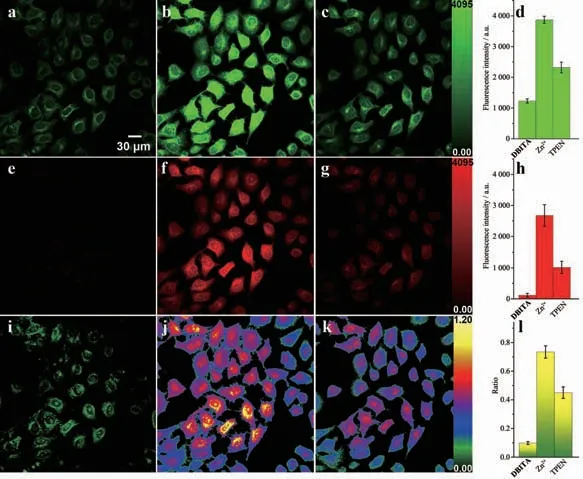
圖5 DBITA 對HeLa 細胞內的激光共聚焦雙通道成像: (a, e, i) HeLa 細胞用DBITA(10 μmol·L-1)溶液25 ℃孵育20 min; (b, f, j)將染色細胞暴露于5 μmol·L-1 Zn(NO3)2/2-巰基吡啶-N-氧化物溶液中5 min, 然后再用DBITA溶液孵育20 min 成像; (c, g, k)進一步用TPEN 溶液(25 μmol·L-1, 20 min)處理(b, f, j)中的細胞; (a, b, c) 500~540 nm 通道熒光圖像; (e, f, g) 580~620 nm 通道熒光圖像; (i, j, k)由(e, f, g)和(a, b, c)生成的比例圖像,λex=405 nm; (d)與(a~c)中所示圖像對應的平均信號強度柱狀圖; (h) 與(e~g) 中所示圖像對應的平均信號強度柱狀圖; (l)與(i~k) 中所示圖像對應的平均比值柱狀圖Fig.5 Dual emission ratiometric imaging of intracellular Zn2+in HeLa cells via DBITA (10 μmol·L-1, 20 min) staining at 25 ℃:(a, e, i) HeLa cells incubated with DBITA at 25 ℃for 20 min; (b, f, j) the stained cells were exposed to 5 μmol·L-1 Zn(NO3)2/2-mercaptopyridine-N-oxide solution at 25 ℃for 5 min, followed by washing with DBITA solution, (c, g, k) the cells in (b, f, j) further treated by TPEN solution (25 μmol·L-1, 20 min, bottom); (a, b, c) Fluorescence images obtained according to the emission collected at 500~540 nm; (e, f, g) Fluorescence images obtained according to the emission collected at 580~620 nm; (i, j, k) Ratiometric images generated from (e, f, g) and (a, b, c), λex=405 nm; (d) Histogram of the average signal intensity corresponding to images shown in (a~c); (h) Histogram of the average signal intensity corresponding to images shown in (e~g); (l) Histogram of the average ratio value corresponding to images shown in (i~k)
DBITA 溶液對HeLa 細胞造影結果如圖5 所示。 綠色通道收集500~540 nm 熒光,紅色通道收集580~620 nm 熒光;熒光比值為綠色通道熒光與紅色熒光通道比值。 HeLa 細胞經DBITA 溶液染色后,2個通道的比值非常低,約為0.098±0.011(圖5i);這表明細胞中的游離Zn2+相對較低,DBITA 主要以游離形式存在。 用Zn(NO3)2/pyrithione 溶液孵育后,再加入DBITA 溶液, 紅色通道的熒光強度信號由117±59(圖5e)增加到2 678±348(圖5f),綠色通道的熒光強度信號由1 232±69(圖5a)增加到3 871±116(圖5b);因此,熒光信號的比值明顯增加,大多數細胞的比值在0.73±0.04 左右,少數細胞的比例增加到1.0左右(圖5j)。這表明外源性Zn2+的加入增加了細胞中Zn2+的濃度,DBITA 與Zn2+結合后導致比值增大。繼續將HeLa 細胞用TPEN 溶液孵育20 min 后進行造影,結果如圖5k,細胞內兩個通道的比值明顯下降,約為0.45±0.04,但仍高于細胞的初始比例。 這是由于DBITA 對Zn2+有很強的螯合能力,即使在高濃度的TPEN 存在下,DBITA 螯合的Zn2+仍不能完全被去除。 以上結果表明,DBITA 具有良好的細胞膜透性,實現了細胞中Zn2+比值檢測。 根據文獻報道,鋅過量會對發育和成熟的神經系統產生深遠的影響。例如, 谷氨酸能突觸釋放過多的Zn2+是導致缺血時神經元死亡的原因[4],視神經損傷后Zn2+的積累導致視網膜神經節細胞死亡[62]。 同樣,細胞內Zn2+的激增也與對成熟少突膠質細胞的興奮性毒性或硝化性損傷有關[63-65]。 DBITA 具有體內Zn2+過多的診斷和治療潛力。
3 結 論
綜上所述,以2-PBI 為熒光團,通過在PBI 的5-位引入強的推電子基團N,N-二甲基,設計了Zn2+結合誘導發射光譜紅移的比例計量型Zn2+探針DBITA。當探針與Zn2+結合后,可發生Zn2+誘導的芳環翻轉/共面, 從而使發射峰發生較大距離的紅移。進一步用紫外-可見光譜、 核磁共振氫譜和質譜研究了DBITA 與Zn2+的1∶1 結合行為。 在HeLa 細胞內的比例計量造影實驗表明,DBITA 能夠應用于細胞內Zn2+的定量檢測。 本研究進一步證明,通過Zn2+誘導的芳環翻轉/共面是構筑比例計量型Zn2+熒光探針的有效策略。 這一策略應該適合于2,2′-氮雜-1,1′-二芳基型熒光團的比例計量型探針的設計。
Supporting information is available at http://www.wjhxxb.cn

