骨形成蛋白-2基因活化納米骨漿促進脊柱椎體間融合的作用
丁一 趙偉峰 李波 周焯家 郭濤 簡月奎
(貴州省人民醫院骨科,貴州 貴陽 550002)
脊柱骨質疏松是較為常見的骨質疏松類型,早期治療手段主要包括藥物治療及支具佩戴治療,但藥物治療見效慢,在發病期間快速提高患者骨強度的難度較大,患者仍有較高的骨折坍塌風險,故找到一種能夠快速改善患者骨密度、增強脊柱椎體檢融合、減少坍塌發生的治療方法尤為關鍵且迫切〔1,2〕。隨著納米骨漿這種新骨組織功能及材料的出現,為脊柱骨質疏松性壓縮骨折的治療帶來新的突破〔3〕。納米骨漿是一種能體現出高度仿生特性的材料,結晶羥基磷灰石、磷酸鈣是其主要成分,可代替骨組織,有著極高的生物相容性與吸收性〔4,5〕。研究表明,將BMP-2真核質粒與納米骨漿融合后,形成的基因釋放系統成骨效能更佳,骨質量高〔6,7〕。但目前國內外并未將該系統作為常用材料用于脊柱骨質疏松性壓縮骨折治療,且相關研究也較少見。本研究旨在觀察BMP-2基因活化納米骨漿促脊柱椎體間融合的價值,以期為未來BMP-2基因活化納米骨漿的臨床應用提供依據。
1 材料與方法
1.1實驗動物 2018年1月,取20只雌性山羊,年齡5~7〔平均(6.41±0.25)〕歲;體重35~45 kg,平均(39.45±2.14)kg。
1.2納米骨漿 由Cem Ostetic TM,Berkeley Advanced Biomaterials公司提供。
1.3pIRES-hBMP-2/真核表達載體 由華中科技大學分子生物實驗室構建,制備質粒后提取定量,經無菌蒸餾水稀釋保存。
1.4血液生化指標 取山羊血,經處理后取血清放至有促凝劑的生化采血管內,檢測骨鈣素、堿性磷酸酶表達。
1.5Micro CT掃描 山羊椎體離解至單個,去除周圍組織、肌肉等成分,經環鉆鉆取椎體松質骨,掃描分析皮質骨,制作環形皮質骨,21 μm分辨率,5個樣本為1組掃描,后重建分析。
1.6生物力學 對椎體與股骨髁松質骨經軸向加壓測量其力學強度,測量時在加壓磨具內置入圓錐形椎體骨塊,施加壓力逐漸將其壓縮至椎體長度50%。
1.7模型構建與觀察指標
1.7.1構建成效 觀察BMP-2基因活化納米骨漿構建情況,看其是否符合本次實驗的要求。
1.7.2椎體最大載荷 隨機抽取15具椎體,Micro CT掃描測定60個椎體的骨密度,保證其在椎體骨密度一致的條件下,將其隨機分為3組,包括空白對照組(n=30)、納米骨漿組(n=15)、BMP-2基因活化納米骨漿組(n=15)。在C型臂X線機引導下,分別經雙側椎弓根為納米骨漿組與BMP-2基因活化納米骨漿組填充納米骨漿及BMP-2基因活化納米骨漿,后壓縮全部椎體高度為原始高度50%,對比3組模型脊柱椎骨最大壓縮應力與最大載荷。
1.7.3血液生化指標 將20只雌性山羊使用Micro CT掃描,確認其山羊骨密度一致后,隨機分為正常組(n=5)、假手術組(n=5,開腹后便將切口縫合)、雙側卵巢切除術組(n=10,將山羊雙側卵巢切除)。分別于術前、術后6個月檢測山羊血清內骨鈣素與堿性磷酸酶表達。術后6個月檢測雙側卵巢切除組骨密度及骨小梁結構,保證其骨密度降低、骨小梁稀疏發生,構建骨質疏松模型。
1.7.4雙基因活化納米骨漿用于骨質疏松效果觀察 選取骨質疏松模型構建成功的雙側卵巢切除山羊每只L2~L6椎體,麻醉后向其中4只經椎弓根填充納米骨漿,其他4只填充BMP-2基因活化納米骨漿,其他2只作為空白對照組不注射納米骨漿。注射成功后4個月將山羊處死,將椎體取出后檢測其骨密度及結構力學強度,檢測并對比各組脊柱椎體最大壓縮應力及最大壓縮載荷。
1.8統計學方法 應用SPSS20.0統計學軟件進行單因素方差分析和LSD-t檢驗。
2 結 果
2.1BMP-2基因活化骨漿構建情況 使用購自華中科技大學BNP-2基因活化骨漿開展RT-PCR驗證,結果顯示BMP-2基因活化骨漿BMP-2水平表達明顯增加,與實驗要求相符。其中空白對照組30個椎體平均BMP-2相對表達為(1.02±0.24),基因活化的納米骨漿15個,椎體平均BMP-2相對表達為(5.21±0.85)。基因活化的納米骨漿表達明顯較空白對照組增強,差異有統計學意義(t=25.309,P<0.01)。
2.2椎體最大載荷比較 BMP-2基因活化納米骨漿組最大壓縮應力、最大壓縮載荷均顯著高于空白對照組與納米骨漿組,差異有統計學意義(P<0.05),空白對照組與納米骨漿組比較差異無統計學意義(P>0.05)。見表1。
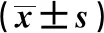
表1 不同山羊模型脊柱椎體最大載荷比較
與空白對照組比較:1)P=0.516,2)P=0.085;3)P=0.003,4)P<0.001;與納米骨漿組比較:5)P=0.039,6)P=0.033
2.3各山羊模型組血液生化指標水平表達比較 術前,正常組、假手術組、雙側卵巢切除術組山羊模型血清骨鈣素、堿性磷酸酶水平表達比較,差異均無統計學意義(P>0.05);術后6個月,雙側卵巢切除術組山羊模型血清骨鈣素、堿性磷酸酶水平表達均較其他兩組顯著降低,差異有統計學意義(P<0.05);正常組與假手術組術后6個月血清骨鈣素、堿性磷酸酶水平較術前未見明顯變化,且組間表達比較差異無統計學意義(P>0.05)。見表2。術后6個月,選擇正常組與雙側卵巢切除術組山羊模型中1只動物進行Micro CT掃描,結果顯示雙側卵巢切除術組山羊模型骨密度顯著降低,骨小梁稀疏,骨質疏松模型構建成功。見圖1~2。
2.4雙基因活化納米骨漿用于骨質疏松山羊模型對脊柱椎體載荷的影響觀察 3組骨質疏松山羊模型中,BMP-2基因活化納米骨漿組最大壓縮應力、最大壓縮載荷最高,其次為納米骨漿組,空白對照組最低,組間兩兩比較差異有統計學意義(P<0.05)。見表3。在納米骨漿注射后4個月,將山羊模型處死后,選擇納米骨漿組與BMP-2基因活化納米骨漿組各1只山羊模型,將其椎體取出檢測骨密度及結構力學強度,結果顯示,較納米骨漿組,BMP-2基因活化納米骨漿組山羊模型脊柱椎體骨密度、最大壓縮應力均增加,椎骨小梁致密程度好,且孔隙率更低。見圖3、4。
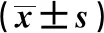
表2 各山羊模型組血液生化指標水平表達比較
與同組術前比較:1)P<0.05;與正常組比較:2)P=0.706,3)P=0.102,4)P=0.756,5)P=0.742,6)P=0.767,7)P<0.001,8)P=0.502,9)P=0.002;與假手術組比較:10)P=0.560,11)P<0.001,12)P=0.642,13)P=0.015

圖1 正常組三維重建圖像

圖2 雙側卵巢切除術組三維重建圖像
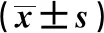
表3 3組骨質疏松山羊模型脊柱椎體載荷比較
與空白對照組比較:1)P=0.041,2)P=0.024,3)P=0.008,4)P=0.002;與納米骨漿組比較:5)P=0.046,6)P=0.037

圖3 骨質疏松山羊模型注射納米骨漿4個月后三維重建圖

圖4 骨質疏松山羊模型注射BMP-2基因活化納米骨漿4個月后三維重建圖
3 討 論
目前,經椎弓根內固定技術已成為脊柱內固定鄰域的重要內容,椎弓根螺釘可經牽引、加壓及旋轉等方式為脊柱提供理想矯治,從而幫助脊柱獲得接近正常的解剖位置〔8〕。椎弓根螺釘獲得的骨-螺釘界面握力是否足夠決定了椎弓根螺釘固定的優越性,且提供的握力應持續至椎體骨性融合完全達到穩定,椎弓根螺釘固定成敗取決于椎弓根螺釘置入成功與否〔9〕。但目前,在實際臨床工作中,接受椎弓根螺釘固定者多為老年患者,這類患者常合并不同程度骨質疏松,骨質疏松的存在在一定程度上可降低椎弓根螺釘固定能力,致使螺釘松動,導致椎體間融合失敗〔10,11〕。
為解決骨質疏松導致的椎弓根螺釘強度不佳等情況,臨床常常通過增加螺釘長度與直徑、對釘道進行不攻絲或預攻絲、釘道經骨質填充、使用骨水泥等材料填充釘道等方法來提高椎弓根的固定強度,但這些手段依然有其不足之處,無法達到臨床預期〔12,13〕。骨質疏松不僅會影響到椎弓根螺釘強度,同時患者本身也極易發生各種骨改變,如骨小梁減少、骨質減少、骨小梁間隙增加等,因骨小梁減少,故合并骨質疏松的人群較其他人更容易發生骨折〔14,15〕。基因納米骨漿是將基因與納米骨漿向融合并經基因真核表達載體所構建的一種納米骨漿的延續,構建出來的填充物同時擁有基因及納米骨漿自身優勢〔16,17〕。具有高仿生特性的納米骨漿,在使用后一方面能創造適宜微環境為膠原與礦物質沉積提供條件,一方面可推動成骨細胞的黏附,加速細胞與生物材料間的交互作用,幫助成骨細胞分化,在納米骨漿基礎上加入BMP-2載體,獲得的生物材料在植入后能夠發揮理想的生物學效應,增加成骨細胞生成能力〔18~20〕。
本研究結果提示BMP-2基因活化納米骨漿的注射能夠顯著增加椎骨對外界壓力的承受能力。提示,BMP-2基因活化納米骨漿較普通納米骨漿對合并骨質疏松的骨折患者椎體成形術脊柱椎體間融合的影響更好。但值得注意的是,因該技術尚未被過多用于臨床實際,研究結果的真實性尚無較多循證依據可以支持,結論的可靠性還應在未來展開相關實驗研究加以證實。
綜上所述,BMP-2基因活化納米骨漿較普通納米骨漿更利于提高脊柱椎體骨密度及生物力學強度,在促進脊柱椎體間融合方面應用價值高,可作為合并骨質疏松骨折患者椎體成形術理想的填充材料。

