楊梅素通過磷脂酰肌醇3-激酶/蛋白激酶B/哺乳動物雷帕霉素靶蛋白信號通路誘導MTB感染巨噬細胞發生自噬的研究
孫錦霞 張晴雯 李銀虹 姜昕
結核病仍然是威脅全球健康的一種感染性疾病。2019年WHO最新數據顯示,2018年感染MTB的新發患者約1000萬例,有55.8萬例利福平耐藥新發患者,其中有82%是耐多藥結核病患者,排名前三位的國家是印度、中國和印度尼西亞[1]。我國的結核病防治形勢依然非常嚴峻。耐藥、潛伏感染、與HIV并發感染等問題是實現控制結核病面臨的巨大挑戰[2]。
MTB是胞內寄生菌,主要存在于巨噬細胞內,因此固有免疫在清除MTB中發揮關鍵的作用。自噬是存在于真核生物體內的一種高度保守的生物過程,指通過溶酶體介導的胞內組分的自我消化和再利用來維持細胞穩態的過程[3]。自1963年首次提出自噬這一概念以來,自噬在抵抗、清除胞內病原體中的重要作用也被越來越多的研究所證實[4-8]。通過誘導或增強巨噬細胞的自噬作用來清除胞內的MTB在2004年被Gutierrez等[9]首次證明。
宿主為導向的治療策略(host-directed therapies,HDT)是一種新興的治療理念,通過小分子化合物對宿主免疫反應的調控來更好地控制MTB。與抗生素作用不同的是:HDT藥物直接調節宿主細胞的免疫功能,從而避免了MTB耐藥性的發生。在結核病治療過程中,輔以自噬誘導劑來增強宿主細胞的自噬功能,能縮短治療周期,降低復發和再感染率[10-11]。
楊梅素(myricetin,MYR)是一種多羥基黃酮類化合物,具有較強的抗腫瘤[12]、抗氧化[13]、抗炎[14]、抗菌[15]、抗病毒[16]和鎮痛[17]等多種生物活性。楊梅素在MTB感染中的作用,還未見相關報道。本課題組在前期研究中發現了楊梅素具有一定的調控MTB感染巨噬細胞自噬的能力,為此本研究以楊梅素為研究對象,探討經典自噬通路——磷脂酰肌醇3-激酶/蛋白激酶B/哺乳動物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信號通路在楊梅素誘導MTB感染的巨噬細胞發生自噬中的作用。
材料和方法
一、材料及試劑
MTB H37Ra(ATCC25177)、小鼠巨噬細胞Raw 264.7由本實驗室保存;楊梅素購自上海同田生物技術股份有限公司;DMEM高糖培養液購自美國Hyclone公司;胎牛血清購自以色列BI公司;Middlebrook 7H9、7H10培養基購自美國BD公司;CCK8購自上海基劍生物科技公司;BCA蛋白濃度測定試劑盒、RIPA細胞裂解液購自上海碧云天公司;兔抗鼠LC3、p62、mTOR、p-mTOR、Akt、p-Akt單克隆抗體購自美國CST公司;小鼠抗β-actin單克隆抗體購自美國Proteintech公司;HRP標記的羊抗兔、羊抗鼠二抗購自美國CST公司。
二、方法
1. Raw 264.7細胞的培養:Raw 264.7細胞用含10%胎牛血清的DMEM培養基,在37 ℃、含5% CO2的培養箱中培養。
2. 楊梅素對Raw 264.7細胞的細胞毒性實驗:楊梅素用DMSO溶解制備成100 mmol/L的藥物儲液,Raw 264.7細胞生長至對數期,收集后鋪板于96孔板中,細胞濃度為2×104/孔,加入不同濃度(25、50、100、150、200 μmol/L)的楊梅素,并設空白組、DMSO對照組,每組設6復孔。在37 ℃、含5% CO2的培養箱中培養24、48、72 h后,避光加入CCK-8(cell counting kit-8),10 μl/孔,放入培養箱繼續培養30 min后,酶標儀測定各孔的吸光度值(A450值),根據各孔平均值,繪制細胞的生長曲線。細胞存活率(%)=(待測樣品-空白組)/(對照組-空白組)×100%。
3. MTB H37Ra的培養:H37Ra菌株用含有10% 白蛋白-葡萄糖-過氧化氫酶(albumin dextrose catalase,ADC)營養添加劑的Middlebrook 7H9液體培養基,37 ℃培養箱培養約21 d生長至對數期。
4. H37Ra菌株感染Raw 264.7細胞模型的建立:Raw 264.7細胞離心收集后,鋪板于6孔板中,細胞濃度為1×106/孔,設空白組、模型組、藥物處理組,每組3個復孔,37 ℃培養箱培養過夜。收集生長至對數期的MTB,磷酸鹽緩沖液(PBS)洗3遍,按感染復數(MOI,即細菌∶細胞=10∶1)加入模型組、藥物處理組,共孵育4 h后,PBS洗3遍,以便棄掉未進入胞內的MTB;而后細胞分別采用不同濃度的楊梅素處理不同的時間,模型組用PBS處理。
5. 菌落形成單位(CFU)法檢測楊梅素對MTB感染的Raw 264.7細胞中細菌的殺滅作用:楊梅素誘導自噬的最佳濃度100 μmol/L作用于感染細胞模型,并設空白組、模型組。37 ℃、5% CO2培養72 h 后,PBS洗3遍,收集細胞中加入100 μl的0.1% Triton-100,冰浴10 min,釋放胞內MTB,各組分別用PBS稀釋至106倍,設3個復孔,涂板于7H10固體培養基,37 ℃培養21 d后進行菌落計數。楊梅素對胞內MTB的抑制率(%)=(模型組胞內菌-楊梅素組胞內菌)/模型組胞內菌×100%。
6. 蛋白免疫印跡法(western blot,WB)檢測Raw 264.7細胞相關蛋白的表達水平:在自噬相關蛋白(LC3和p62)的檢測中,以不同濃度(12.5、25、50、100 μmol/L)的楊梅素處理模型組細胞24 h;在自噬通路相關蛋白(p-Akt和p-mTOR)檢測中,以100 μmol/L楊梅素處理模型組細胞30、60、180 min。不同處理組細胞分別用預冷的PBS洗3遍,加入預冷的RIPA細胞裂解液,冰上裂解30 min。4 ℃、r=10 cm,12 000 r/min 離心15 min,收集蛋白上清。BCA法檢測蛋白濃度,然后將蛋白與上樣緩沖液(loading buffer)混合后煮沸。在SDS-聚丙烯酰胺凝膠(PAGE)(SDS-PAGE)上分離蛋白并轉印至硝酸纖維素膜(NC膜)上,5%脫脂牛奶封閉2.5 h后,將NC膜轉移至預先按1∶1000進行稀釋好的兔抗LC3、p62、mTOR、 p-mTOR、Akt、p-Akt單克隆抗體,小鼠抗 β-actin單克隆抗體中,4 ℃ 孵育過夜。TBST洗3遍,每遍10 min后,將膜放入1∶5000稀釋的HRP標記的羊抗兔或羊抗鼠二抗中,室溫下孵育1 h,TBST洗3次。用ECL試劑盒在Protein Sample儀器上進行顯影,并通過Image J軟件對蛋白質的表達進行像素的灰度值測定與分析。
三、制圖與統計學分析
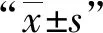
結 果
一、楊梅素對Raw 264.7細胞活力的影響
在不同時間點(24、48、72 h)用CCK8法檢測不同濃度(0、12.5、25、50、100、200 μmol/L)楊梅素處理后細胞的存活情況。結果顯示,楊梅素作用24 h和48 h細胞的存活率均能保持在90%左右,200 μmol/L 的楊梅素處理細胞72 h后,Raw 264.7細胞的生存率仍能達到(79.65±1.36) %(表1)。為此后續實驗選擇100 μmol/L為最大藥物安全使用濃度。
二、楊梅素誘導MTB感染的Raw 264.7細胞自噬
利用Western bolt檢測自噬相關蛋白LC3Ⅱ和p62蛋白的表達情況。以小鼠肌動蛋白(β-actin)為內參,模型組與藥物處理組的LC3Ⅱ和p62蛋白的表達差異見圖1。與模型組相比,楊梅素作用24 h能明顯誘導MTB感染的Raw 264.7細胞發生自噬,且隨藥物濃度的增加,呈現一定的劑量依賴性。模型組LC3Ⅱ蛋白的相對表達量較低,楊梅素不同濃度(12.5、25、50、100 μmol/L)處理均能促進LC3Ⅱ的表達;相較于模型組p62蛋白,藥物處理亦能抑制p62的表達,25 μmol/L楊梅素處理組差異無統計學意義,12.5、50、100 μmol/L處理組差異均有統計學意義,具體見表2。楊梅素在最高作用濃度100 μmol/L 下,其LC3Ⅱ蛋白表達最高,同時p62蛋白表達最低。
三、楊梅素能明顯殺傷Raw 264.7細胞內的MTB
楊梅素能降低Raw 264.7細胞的荷菌量。模型組胞內的MTB數量為(39.67±2.33)×106,100 μmol/L 楊梅素處理72 h后,胞內MTB的數量降為(31.33±0.88)×106,差異有統計學意義(t=3.34,P=0.03)。楊梅素對胞內MTB的抑制率(%)為21.02%(圖2)。
四、楊梅素通過抑制PI3K/Akt/mTOR通路誘導自噬
利用Western bolt檢測自噬經典途徑PI3K/Akt/mTOR通路中關鍵接頭蛋白Akt、mTOR的磷酸化水平。以各組p-Akt/Akt和p-mTOR/mTOR來表示該組p-Akt和p-mTOR蛋白的相對灰度值。與空白組相比,空白+楊梅素組Akt和mTOR蛋白的磷酸化水平沒有變化,可見楊梅素本身對空白

表1 不同濃度楊梅素作用下Raw 264.7細胞的存活率

圖1 Western bolt檢測不同濃度楊梅素作用下細胞中自噬相關蛋白LC3Ⅱ和p62的表達情況。與模型組相比,不同濃度楊梅素處理組能明顯促進LC3Ⅱ的表達,同時促進p62蛋白的降解

圖2 楊梅素對Raw 264.7細胞內MTB的殺傷作用

空白+楊梅素組與空白組相比,楊梅素本身對細胞的Akt和mTOR蛋白的磷酸化無影響。與模型組相比,在不同時間點(30、60、180 min),楊梅素均能明顯抑制Akt蛋白的磷酸化,差異有統計學意義;模型組p-mTOR蛋白水平僅在MTB感染后180 min明顯增加,楊梅素作用180 min亦能明顯抑制mTOR蛋白的磷酸化圖3 Western bolt檢測楊梅素對細胞中PI3K/Akt/mTOR通路相關蛋白磷酸化水平的影響
討 論
目前,治療結核病的主要手段仍然是化療,而臨床普遍使用的一線抗結核藥物,仍停留在20世紀90年代研發的鏈霉素、異煙肼、利福平。然而由于耐藥、耐多藥、與HIV并發感染等問題的出現,使得開發新的抗結核藥物成為全球結核病防治事業的當務之急。針對殺滅MTB的藥物研發進展緩慢,HDT療法另辟蹊徑,從宿主角度出發,通過增強宿主的免疫力來清除MTB。MTB是一種胞內寄生菌,通過抑制吞噬體的成熟從而在感染的巨噬細胞內長期存活。自噬是細胞自發的對胞內寄生菌的一種防御行為,已經被確認可以通過不同機制清除胞內菌。通過自噬,細胞能清除胞內受損的細胞器、蛋白聚集物及進入細胞的病原體。經典的自噬分為巨自噬、微自噬及分子伴侶介導的自噬[18],通常所說的自噬即是巨自噬。自噬是由多種基因共同參與的漸進式的過程,以雙層膜包裹的需降解的胞內成分形成的自噬體為標志,通過與溶酶體的融合來降解其內容物。自噬發生時,胞質中的LC3會發生酶解形成LC3Ⅰ,LC3Ⅰ在ATG幫助下與磷脂酰乙醇胺(PE)結合后形成膜型的LC3Ⅱ,LC3Ⅱ會與自噬體膜融合,因此,通過LC3Ⅱ/LC3Ⅰ比值的大小可以評估自噬水平的高低。而自噬流是否通暢,可以觀察p62蛋白的表達水平。p62蛋白是細胞接頭蛋白,是細胞內多種蛋白復合物的主要成分[19]。當自噬流通暢時,p62蛋白會與LC3形成復合物,p62作為自噬特異性底物與吞噬溶酶體內的其他內容物被一同降解[20]。自噬已經成為治療結核病的新靶標,其限制MTB生長的作用也被很多研究者所證實[21-22]。

表3 楊梅素作用不同時間對Akt和mTOR蛋白磷酸化水平的影響
楊梅素作為一種天然的黃酮類化合物,具有廣泛的藥理活性,且毒性較小,具有很好的應用前景。楊梅素具有抗腫瘤、抗氧化、抗微生物、抗神經退化、抗高血壓、抗過敏、抗酸、降血糖和抗炎、鎮痛等多種藥理作用。近年來,大量的研究聚焦在了楊梅素的抗菌、抗炎活性上。楊梅素具有抑制金黃色葡萄球菌、大腸埃希菌、肺炎鏈球菌生長的作用[23-25]。然而結核病模型中,還未見有關楊梅素的相關報道。目前在楊梅素的作用機制研究方面,Cao等[26]發現楊梅素在較高濃度下可顯著降低肝癌細胞HepG2的活力,增加自噬體形成和選擇性吞噬過程中起關鍵作用的蛋白LC3的表達,降低mTOR及其下游信號分子的磷酸化,促使細胞的自噬過程進行。
本實驗中首先通過CCK8法檢測楊梅素對Raw 264.7細胞的細胞毒性,發現楊梅素在100 μmol/L濃度以下作用24、48、72 h時細胞的存活率均在90%以上,可見楊梅素在100 μmol/L濃度下對細胞的毒性較小,因此本實驗選用100 μmol/L作為楊梅素的最大安全使用濃度。通過楊梅素干預MTB感染的小鼠Raw 264.7巨噬細胞,Western blot檢測發現楊梅素能明顯促進自噬相關蛋白LC3Ⅱ的表達,與模型組(0.52±0.01)相比,楊梅素不同濃度(12.5、25、50、100 μmol/L)處理24 h均能促進LC3Ⅱ的表達(0.59±0.02, 0.65±0.01, 0.71±0.01, 0.83±0.01),差異有統計學意義(t=2.97、P=0.04,t=7.91、P=0.00,t=9.77、P=0.00,t=16.37、P=0.00)。同時,我們發現楊梅素能促進p62蛋白降解,較模型組p62蛋白(0.86±0.02),不同濃度的楊梅素能抑制p62的表達(0.72±0.01,0.85±0.00,0.60±0.02,0.58±0.01);與模型組比較,25 μmol/L楊梅素處理組差異無統計學意義(t=0.81,P=0.46),12.5、50、100 μmol/L 處理組均有統計學意義(t=6.50、P=0.00,t=9.53、P=0.00,t=12.01、P=0.00);從中得出楊梅素在100 μmol/L濃度下LC3Ⅱ的表達最高,同時p62的表達最低,可見楊梅素誘導自噬的最佳濃度為100 μmol/L。自噬是清除胞內MTB的一種重要手段,因此選擇在自噬發生后對胞內的MTB數量進行了CFU計數,發現楊梅素在100 μmol/L濃度下作用72 h后,能降低胞內21.02%的MTB,雖然這種降低沒能產生數量級上的差異,但考慮到HDT只是一種輔助治療的手段,楊梅素可聯合其他一線抗結核藥物一起使用,以此達到降低藥物劑量、縮短療程和減少耐藥性產生的目的。筆者也檢測了楊梅素作用24 h和48 h后的CFU,發現差異無統計學意義,原因可能是藥物在24 h剛啟動自噬,而自噬發生后對MTB的降解需要一定的時間,因此在72 h才產生了統計學意義上的降低。通過刃天青法檢測楊梅素的體外殺菌作用,發現楊梅素本身在200 μmol/L濃度下對MTB無殺滅作用,因此,楊梅素降低MTB感染的巨噬細胞中的荷菌量不是由于楊梅素本身的殺菌作用引起的,而是通過啟動了自噬,從而引起細胞內MTB的CFU下降。
PI3K/Akt/mTOR通路是最經典的自噬通路,因此筆者首先考慮楊梅素誘導自噬的機制很可能是通過抑制了這條通路啟動了自噬。為了排除楊梅素本身對細胞PI3K/Akt/mTOR通路的影響,設立了空白+楊梅素組,與空白組相比,p-Akt和p-mTOR水平差異均無統計學意義。在100 μmol/L濃度下,楊梅素作用不同的時間(30、60、180 min),與模型組相比(1.23±0.01、1.52±0.01、0.74±0.02),Akt蛋白的磷酸化水平(0.99±0.01、0.96±0.01、0.43±0.01)均被顯著抑制,差異有統計學意義(t=27.60、P=0.00,t=30.06、P=0.00,t=18.60、P=0.00);而模型組p-mTOR蛋白水平僅在MTB感染后180 min(0.57±0.00)明顯增加,楊梅素作用180 min 亦能抑制mTOR蛋白的磷酸化(0.46±0.01),差異有統計學意義(t=21.60,P=0.00)。
綜上所述,楊梅素通過抑制Akt和mTOR蛋白的磷酸化來抑制PI3K/Akt/mTOR通路,從而誘導MTB感染的巨噬細胞發生自噬來殺滅胞內的MTB。基于本研究的實驗結果,認為楊梅素有望成為新的 HDT 候選藥,作為輔助用藥與臨床一線抗結核藥物聯合用于結核病的防治。本實驗尚存在許多不足之處,比如:采用的無毒株、細胞模型相對單一、沒有開展整體實驗、沒有與抗結核藥物進行比較等。

