逐級鹽析結合雙水相法純化貫筋藤凝乳酶
趙 瓊,王庭伊,黃艾祥
(云南農業大學食品科學技術學院,云南昆明 650201)
貫筋藤(DregeasinensisHemsl.)為蘿藦科,南山藤屬植物,攀援木質藤本,俗稱“奶漿藤”[1]。分布于云南大理、麗江、昆明等地,多生長于山地灌木叢中[2],目前尚未由人工引種栽培。貫筋藤也具有較大的藥用價值,具有抗癲癇、祛風、除濕等作用[3];其葉的汁液可治多種皮膚癬;花是云南民間十二種食用花卉之一[4]。此外,陶亮等[5]調研發現,在云南大理劍川縣、鶴慶縣等地,人們將“奶漿藤”用溫水浸泡后便作為一種凝乳劑來生產乳餅。因此,陶亮等[6-7]對貫筋藤及其凝乳成分展開了研究,并發現其主要凝乳成分為凝乳酶。姬昱等[8]對貫筋藤凝乳酶的急性毒性及遺傳毒性作了研究,結果顯示貫筋藤凝乳酶無毒性。Zhang Y等[9]鑒定貫筋藤凝乳酶分子量為24 kDa,屬于半胱氨酸蛋白酶,且具有耐高溫、穩定性高等特點,并探究了凝乳機制。這些研究為更好地開發及應用貫筋藤凝乳酶提供了一定的科學依據。
然而,目前貫筋藤凝乳酶的發展應用仍被提取制備方法單一、純度低、活力弱等因素所制約。因此亟需尋找樣品處理量大、回收率高、對酶活影響小、成本低的酶純化方法。硫酸銨逐級鹽析法常用于蛋白質分離及富集,在高濃度的硫酸銨溶液里,鹽離子能夠結合蛋白表面的水分子,從而破壞蛋白表面的水化膜,使蛋白質溶解度降低,因疏水作用聚集形成沉淀,因此可以將蛋白和其他雜質(如糖類等)分離開[10]。雙水相萃取(aqueous two-phase system,ATPS)又稱水溶液兩相分配技術始于20世紀60年代,因其具有易操作、適于放大生產、不易破壞成分活性、環保等優點而被廣泛應用。國內外關于雙水相萃取分離蛋白的報道很多,不少研究者通過雙水相萃取法從復雜組分中純化出了高純度的蛋白質及酶。如Amid M等[11]利用醇/鹽兩相純化出芒果果皮中的絲氨酸蛋白酶。馮自立等[12]研究了無花果蛋白酶在PEG/(NH4)2SO4雙水相體系中的分配行為。但關于利用雙水相萃取法分離純化貫筋藤凝乳酶的研究未見報道。
本研究首先利用硫酸銨鹽析法對貫筋藤提取液進行粗分離,再利用雙水相法粗酶進行純化,并對純化后酶的純度進行電泳分析,旨在為貫筋藤凝乳酶的純化提供一定的理論依據和技術基礎。
1 材料與方法
1.1 材料與儀器
貫筋藤鮮莖 采自云南省劍川縣;脫脂奶粉 澳大利亞德運公司;TRIS、SDS、Glycerol、Ammonium persulphate、Acrylamide、TEMED 分析純,北京索萊寶有限公司;β-巰基乙醇 生化純,上海麥克林生化科技有限公司;無水氯化鈣、氯化鈉、硫酸銨 分析純,天津市風船化學試劑科技有限公司;牛血清蛋白 生化純,上海源葉生物科技有限公司;考馬斯亮藍G-250、R-250 分析純,上海源葉生物科技有限公司;聚乙二醇 分析純,天津市光復精細化工研究所。
TLG20M臺式高速冷凍離心機 長沙邁佳森儀器設備有限公司;HWS24電熱恒溫水浴鍋 上海一恒科學儀器有限公司;FD-1A-50冷凍干燥機 上海比朗儀器制造有限公司;BIO-RAD Mini電泳儀 美國伯樂;UV-6100S紫外可見分光光度計 上海元析儀器有限公司;MS-100金屬浴 杭州奧盛儀器有限公司。
1.2 實驗方法
1.2.1 貫筋藤粗酶提取 采收貫筋藤鮮莖,陰涼處晾干后剪成5~10 cm小段,敲碎后按1∶10 (w/v)加入2.5% NaCl溶液(溶于pH6.0,0.05 mol/L磷酸緩沖溶液),4 ℃浸提12 h后用雙層濾布過濾。
1.2.2 硫酸銨逐級鹽析 采用硫酸銨逐級(0%~20%、20%~40%、40%~60%、60%~80%)沉淀出粗酶[13]。在攪拌條件下向1.2.1的提取液緩慢加入硫酸銨粉末,至溶解后飽和度為20%,于4 ℃條件下靜置30 min,離心(10000 r/min,15 min,4 ℃),收集沉淀。繼續向上清液加入硫酸銨粉末至溶解后飽和度為40%,靜置,離心(10000 r/min,15 min,4 ℃),收集沉淀。重復上述操作,將不同飽和度沉淀出的酶轉移至透析袋(3500 Da)中于去離子水中透析24 h,4 h換一次水。保持透析袋內外的靜水壓和滲透壓不同,以跨膜轉運除去硫酸銨。將透析后的截留液真空冷凍干燥(-50 ℃,0.2~1.0 mBar,72 h)成粉,-20 ℃保存備用。測其蛋白質含量及凝乳活力。
1.2.3 雙水相法純化貫筋藤凝乳酶
1.2.3.1 成相物質對凝乳酶活力的影響 不同種類及不同質量分數鹽對貫筋藤凝乳酶的影響:分別取1 mL不同濃度(10%、12.5%、15%、17.5%、20%)檸檬酸鈉、硫酸銨、硫酸鎂溶液與1 mL粗酶液(3 mg/mL,溶于pH8.0,0.05 mol/L Tris-HCl Buffer中)充分混合,室溫放置1 h。對照組為將1 mL鹽替換為1 mL純水。測其凝乳活力,并計算相對凝乳活力。
不同相對分子質量及質量分數PEG對凝乳酶活力的影響:分別取1 mL不同濃度(15%、17.5%、20%、22.5%、25%)PEG 1000、PEG 2000、PEG 4000、PEG 6000溶液與1 mL粗酶液充分混合,室溫放置1 h。對照組將1 mL PEG替換為1 mL純水。測其凝乳活力,并計算相對凝乳活力。
1.2.3.2 繪制相圖 參考Albertsson[14]濁點法,分別配制40% PEG 1000、2000、4000、6000溶液和43%硫酸銨溶液,準確稱取0.700 g的PEG溶液于試管中,加入0.5 mL超純水,然后緩慢向內滴加硫酸銨溶液,混勻,靜置觀察溶液的渾濁程度(剛好變得渾濁),記錄加入硫酸銨的量,根據該量計算出硫酸銨的質量分數。然后重復以上操作,分別記錄下達到渾濁時加入的硫酸銨的量,計算出在體系內加入硫酸銨的質量分數和PEG的質量分數,從而繪制相圖。
1.2.3.3 PEG/硫酸銨比例的篩選 用40%PEG 1000、2000、4000、6000溶液和43%硫酸銨溶液,分別按PEG/硫酸銨(%,w/w)=20.57/14.74、22.86/12.29、24.57/10.44比例制備雙水相體系,體系總體積為6 mL,再分別向體系中加入1 mL粗酶液,在渦旋混合器上充分混合1 min后室溫靜置1 h[11]。用膠頭滴管分離上下相,分別讀取上、下相的體積,測定上、下相的蛋白含量測定和凝乳活力并計算其比活力。
1.2.3.4 酶用量對純化效果的影響 在最佳的PEG/鹽體系中加入不同體積的酶液(0.5、1.0、1.5、2.0 mL),充分混勻,室溫靜置1 h,分離上下相,測定蛋白質含量及凝乳活力。
1.2.4 指標測定及計算
1.2.4.1 凝乳活力測定 參照文獻[15]方法:配制10%脫脂奶(脫脂奶粉溶于0.01 mol/L CaCl2溶液),取1 mL脫脂奶于85 ℃水浴預熱5 min后加入0.1 mL酶液,準確記錄凝乳時間。凝乳有效時間為40 min內。計算公式如下:
凝乳活力(MCA)=(2400×V)/(t×v)
式中,V(mL):乳體積;v(mL):酶液體積;t(s):凝乳時間。
1.2.4.2 考馬斯亮藍法測定蛋白含量 參照鄧麗莉等[16]方法,繪制牛血清蛋白標準曲線,標準方程為:y=0.0078x+0.0751(R2=0.9952),線性范圍為0~100 μg/mL。
1.2.4.3 相關純化指標計算 a.酶比活力:酶比活力定義為在特定條件下,單位重量(mg)蛋白質所具有的酶活力單位數。計算公式如下:
比活力=凝乳活力/蛋白含量(MAC/mg)
b.相對凝乳活力:在特定條件下,以母液酶的凝乳活力為100%,計算其他處理酶液的相對凝乳活力。計算公式[17]如下:
相對凝乳活力(%)=貫筋藤凝乳酶處理液凝乳活力/母液凝乳活力×100
c.選擇性S:在特定條件下,貫筋藤凝乳酶的分配系數(Ke)與蛋白質含量(Kp)之比。計算公式[11]如下:
選擇性S=Ke/Kp=(AT/AB)×(PB/PT)
式中,AT為上相酶的凝乳活力(MCA);AB為下相酶的凝乳活力(MCA);PB為下相總蛋白質含量(mg);PT為上相總蛋白質含量(mg)。
d.純化倍數(PFT):在特定條件下,純化后酶的比活力除以粗酶的比活力。計算公式[11]如下:
PFT=上相酶的比活力/粗酶的比活力
e.回收率YT(%):為在特定條件下,蛋白在純化過程中的回收率。計算公式[11]如下:
YT(%)=100/(1+(1/VR×Ke))
式中,VR上下相體積之比;Ke為貫筋藤凝乳酶的分配系數。
1.2.5 SDS-PAGE電泳檢測分離純化貫筋藤凝乳酶的純度 對貫筋藤凝乳酶進行SDS-PAGE電泳實驗,分析雙水相對貫筋藤凝乳酶純化情況。參照Laemmli等[18]方法稍作修改,制膠(15%分離膠、4%濃縮膠)→樣品處理(樣品∶上樣緩沖液=1∶1,混勻,金屬浴95 ℃處理10 min,10000 r/min離心2 min)→上樣(每孔上樣量10~20 μL)→電泳(濃縮膠50 V,30 min;分離膠120 V,約90 min)→固定(30%甲醇,30 min)→過夜考染→脫色(脫色至條帶清晰)→拍照→Image Lab軟件分析膠片。
1.3 數據處理
本文實驗每組重復三次,取平均值為最終數據。利用Excel 2010、OriginPro 9.0及Image Lab軟件處理數據及繪圖。
2 結果與分析
2.1 硫酸銨逐級鹽析結果
由圖1可知,逐級鹽析過程中,當硫酸銨飽和度區間為20%~40%時,貫筋藤凝乳酶的比活力最高(167.846 MCA/mg)。隨著硫酸銨的飽和度繼續升高,酶的活力逐漸降低,原因可能是貫筋藤凝乳酶情況較復雜,其在硫酸銨沉淀中是一個逐漸沉淀的過程,硫酸銨飽和度從0%~80%均能析出有活力的酶,但飽和度為20%~40%沉淀出的酶活力最高,此時到達一個生物分子之間排斥力很小的階段,酶很容易相互聚集,在溶液中的溶解度降低,從而沉淀析出,且此時析出的凝乳酶表現出較大比活力[19]。考慮到盡量在損失少量酶的同時除去其他雜蛋白,以獲得較高純度和活力的貫筋藤凝乳酶,因此選擇20%~40%為最佳硫酸銨鹽析飽和度區間。張學俊等[20]利用硫酸銨沉淀法分離PabB酶,SDS-PAGE圖發現該酶在硫酸銨飽和度20%~75%的沉淀中均有出現,并認為該酶在硫酸銨沉淀中是逐漸沉淀的過程,與本文結果結果相似。

圖1 硫酸銨逐級鹽析結果圖Fig.1 Result of ammonium sulfate stepwise salting-out diagram
2.2 雙水相純化結果
2.2.1 相成分對貫筋藤凝乳酶活力的影響
2.2.1.1 不同種類及不同質量分數鹽對貫筋藤凝乳酶的影響 硫酸鎂、檸檬酸鈉和硫酸銨等鹽常作為雙水相萃取體系中的成相成分被用于蛋白和酶的分離,且具有較好的分離效果。Senphan T等[21]利用叔丁醇/硫酸鎂雙水相體系從太平洋白蝦的肝胰腺中分離高純度的蛋白酶。Da Silva O S等[22]利用PEG/檸檬酸鈉從固態發酵產生的曲霉(Aspergillustamarii)URM4634中純化出純度較高的蛋白酶。Gagaoua M等[23]利用叔丁醇/硫酸銨體系首次從Cucumismelovar.reticulatus中純化出活性較穩定的凝乳酶。參考上述文獻,選用硫酸鎂、檸檬酸鈉和硫酸銨作為本研究的鹽體系,再從中篩選出最佳的鹽組分。
圖2為3種鹽對貫筋藤凝乳酶活力的影響,3種不同的鹽對酶活力的影響較大,硫酸鎂>檸檬酸鈉>硫酸銨。不同濃度硫酸鎂溶液處理后的酶,在有效凝乳時間(40 min)內均未凝乳。不同濃度檸檬酸鈉處理后的酶相比原酶活力降低了約70%。李雙安等[24]研究表明,檸檬酸鈉、硫酸鎂能與血液中的Ca2+子結合成螯合物,而使鈣離子失去凝血作用,從而阻止血液凝固,常用作抗凝劑。結合凝乳酶的凝乳機理發現,酶將酪蛋白表面的κ-酪蛋白剪切開,使得副κ-酪蛋白和β-酪蛋白在Ca2+作用下凝結沉淀,而檸檬酸鈉、硫酸鎂可能與Ca2+結合使乳中的游離Ca2+減少,從而導致凝乳緩慢且效果不佳。從硫酸鎂和硫酸銨兩種鹽濃度對酶的影響可看出,隨著兩種鹽的濃度增大,酶的活力逐漸減小,可能是因為鹽濃度過高,易導致蛋白析出或變性。綜上所述,在雙水相萃取體系中,選用硫酸銨作為最佳鹽相,且質量分數應小于15.0%。
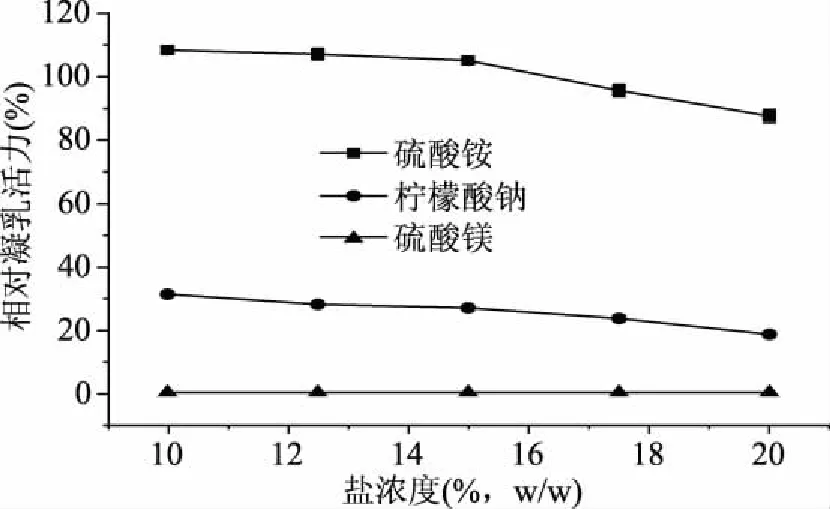
圖2 鹽對酶活力的影響Fig.2 Effect of salt on enzyme activity
2.2.1.2 不同相對分子質量及質量分數的PEG對貫筋藤凝乳酶的影響 將貫筋藤凝乳酶與不同相對分子質量、不同質量分數的PEG等比混合,考察其對酶活性的影響,結果如圖3。從圖3可看出,不同相對分子質量的PEG對貫筋藤凝乳酶的活性均有一定的影響,但透析(7000 Da)酶液后該影響可被消除。原因可能為酶液中PEG不利于凝乳酶與脫脂奶粉接觸或影響游離Ca2+與副κ-酪蛋白和β-酪蛋白接觸,導致酶的凝乳活力略微受到影響。

表1 雙水相相成分及配比篩選Table 1 Selection of composition and ratio of aqueous two phase
從PEG濃度來看,隨著PEG 2000濃度的升高,酶活力也逐漸升高,濃度達22.5%時趨于平緩,其他相對分子質量PEG隨濃度增加酶活力無明顯變化。Ooi C W等[25]也是利用PEG/鹽體系分離脂肪酶,PEG對酶的活力有一定抑制作用,但由于抑制作用不明顯且可消除,故被用于后續分離純化中。因此,在本研究中不同濃度不同相對分子質量PEG均可用作相成分對貫筋藤凝乳酶進一步純化。

圖3 PEG對酶活力的影響Fig.3 Effect of PEG on the activity of the enzyme
2.2.2 相圖 相圖是雙水相萃取法中制備穩定相體系的重要參考條件,也是兩相體系分相的重要基礎。結合成相物質對酶活力的影響,選擇硫酸銨為鹽相、不同相對分子質量PEG為有機相制作相圖。圖4為40%PEG(1000、2000、4000、6000)與43%硫酸銨的相圖。相圖中雙節線上各點為臨界點,雙節線以上的區域為分相區(上相主要為PEG,下相主要為硫酸銨),雙節線以下的區域為混合區。從圖4可看出,當PEG質量分數一定時,相對分子質量越小,所需的硫酸銨質量分數越大,PEG相對分子量越大,分相臨界點越小,成相物質濃度較少即可成相,與田盼盼等[26]研究結果相似。因此選用雙節線以上的兩相質量分數作為制備穩定的純化貫筋藤凝乳酶相體系的重要參考條件。

圖4 不同相對分子量PEG/硫酸銨體系相圖Fig.4 Phase diagram of different molecular weight PEG/ammonium sulfate system
2.2.3 PEG/硫酸銨配比的篩選 為了優化貫筋藤凝乳酶在PEG/硫酸銨體系中的分配效率,結合相圖(圖4)中雙節點以上的兩相濃度和成相物質對酶活力的影響,選出了三組濃度配比共12個穩定體系對酶分配效果進行了評價。表1為貫筋藤凝乳酶在不同相對分子質量和濃度的PEG/硫酸銨體系中的分配情況,兩相的濃度從10.44%~24.57%不等,測定了該酶在體系中的選擇性、純化倍數和回收率。實驗結果用三次重復實驗結果的平均值表示。
由表1中可知,在PEG相對分子量為6000,PEG/硫酸銨為20.57/14.74體系中,貫筋藤凝乳酶的分配效率最佳,選擇性為47.842,純化倍數為1.870,回收率為98.096%。高分子量的PEG對酶的純化效果較好,而增加PEG的濃度反而會降低酶的純化效果。從分配理論來解釋,隨著PEG的濃度增加,相界面張力也隨之增大,不利于酶向上相(PEG相)富集,而當減小PEG的濃度,硫酸銨的鹽析作用起主導作用,使得酶向上相富集[27]。Vaidya等[28]研究表明,相對分子質量小的PEG不適合蛋白質的分離。故本實驗選用PEG 6000,PEG/硫酸銨為20.57/14.74(%,w/w)作為貫筋藤凝乳酶純化的雙水相體系條件。
2.2.4 酶用量對純化的影響 由表2可知,隨著酶用量增大,純化倍數PFT也隨之增大,當用量大于1 mL時,各項指標均逐漸減小。實驗中發現,隨著用量增大,體系穩定性越差,當酶用量達2 mL時,相平衡幾乎被打破,無法達到分離效果。綜合酶處理量、純化效率等因素,故選用1 mL為最佳酶用量。

表2 酶用量對純化的影響Table 2 Effect of enzyme dosage on purification
2.3 雙水相純化效果
2.3.1 雙水相純化效果圖 由圖5可看出,雙水相萃取體系形成明顯的上下層:上層是以PEG 6000為主的有機相;下層是以硫酸銨為主的鹽相。實驗結果表明,上層顏色較深,具有較高的酶活力,主要富集了目標凝乳酶;下層顏色較淺,沒有酶活力,可能為一些帶顏色的雜質。

圖5 雙水相純化貫筋藤凝乳酶效果圖Fig.5 Effect diagram of two-phase purification of enzyme from Dregea sinensis Hemsl.
2.3.2 凝乳效果圖 圖6為經雙水相純化并透析的貫筋藤凝乳酶凝乳圖,從圖6中可看出對照組(0.05 mol/L,pH8.0 Tris-HCl)未凝乳;鹽析組(硫酸銨飽和度20%~40%)雖然凝乳,但乳塊有輕微的褐色,且乳清渾濁;雙水相純化組凝乳較好,乳塊呈乳白色,乳清呈淡黃色。說明經雙水相純化后的貫筋藤凝乳酶顏色和活力都有了一定的改善和提高。

圖6 貫筋藤凝乳酶凝乳圖Fig.6 Milk-clotting diagram of Dregea sinensis Hemsl. enzyme
2.4 SDS-PAGE電泳
從圖7可看出,對比2號(未除NaCl,影響電泳時電荷遷移所以條帶歪扭)、3號泳道可明顯看出,4號泳道酶條帶清晰、純度較高,分子量約為25 kDa。說明經過雙水相萃取純化后貫筋藤凝乳酶雜質含量少,純度較高。

圖7 貫筋藤凝乳酶電泳圖Fig.7 SDS-PAGE electropherogram of Dregea sinensis Hemsl. milk-clotting enzyme注:1號泳道為蛋白Marker(從下到上為10~180 kDa), 2號泳道為貫筋藤鹽提液,3號泳硫酸銨飽和度為20%~40% 鹽析粗酶,4號泳道為雙水相純化的貫筋藤凝乳酶。
3 結論
硫酸銨逐級沉淀貫筋藤粗酶時,當硫酸銨飽和度區間為20%~40%時,貫筋藤凝乳酶的比活力較高,說明通過硫酸銨逐級鹽析,可有效除去提取液中的雜質成分,提高酶的純度。再利用雙水相萃取法對粗酶進一步純化,當鹽組分為硫酸銨、PEG相對分子質量為6000、PEG/硫酸銨質量為20.57%/14.74%、酶用量為1 mL時,貫筋藤凝乳酶的純化倍數達1.87,回收率達98.096%。對貫筋藤凝乳酶進行SDS-PAGE分析可知經雙水相純化的貫筋藤凝乳酶條帶清晰、雜質少、純度較高,分子量約為25 kDa。利用雙水相分離純化可獲得高純度的貫筋藤凝乳酶,且該法易操作、環保、成本低,可為貫筋藤凝乳酶后續規模化生產及應用奠定基礎、提供指導意義。

